化学人教版(2019)必修第二册5.2.2氨和铵盐(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.2氨和铵盐(共17张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 13.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-15 10:54:55 | ||
图片预览






文档简介
(共17张PPT)
第二节 氮及其化合物
第二课时 氨和铵盐
第五章 化工生产中的重要非金属元素
工业合成氨
弗里茨·哈伯
第一个从空气中制造出氨的科学家,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
卡尔·博施
格哈德·埃特尔
改进了高压合成氨的催化方法,实现了合成氨的工业化生产,并在发展高压化学方面取得成就。因此获得1931年诺贝尔化学奖。
发现了哈伯-博施合成氨的作用机理,并以此为开端推动了表面化学动力学的发展。因此获得2007年诺贝尔化学奖。
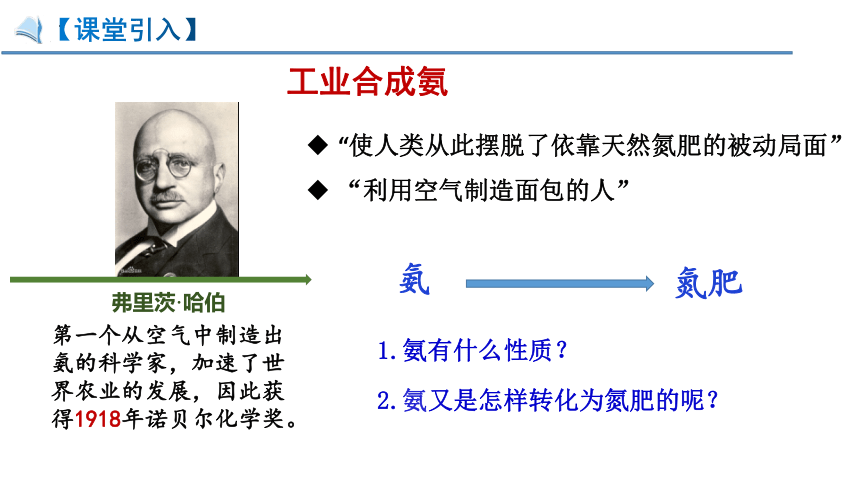
【课堂引入】
工业合成氨
弗里茨·哈伯
第一个从空气中制造出氨的科学家,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
“使人类从此摆脱了依靠天然氮肥的被动局面”
“利用空气制造面包的人”
氨
氮肥
1.氨有什么性质?
2.氨又是怎样转化为氮肥的呢?
【课堂引入】
【学习任务一】氨的性质:物理性质
溶解性:
颜 色:
状 态:
气 味:
密 度:
无色
气体
有刺激性气味
比空气的小
氨易液化得到液氨,液氨可用作制冷剂。
1.物理性质
【实验5-6】喷泉实验
操作:打开橡胶管上的弹簧夹,挤压胶头滴管,使少量水进入烧瓶。
现象:烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,烧瓶内液体颜色呈红色。
原理:氨极易溶于水,使烧瓶内的压强迅速减小,形成较大的压强差,导致烧杯中的水在大气压的作用下进入烧瓶。
【思考】氨气为什么能形成喷泉现象?
溶解性:
极易溶于水。常温常压下,1体积水大约可溶解700体积氨。
【学习任务一】氨的性质:喷泉实验
【学习任务一】氨的性质:喷泉实验
【思考2】氨的喷泉实验成功的关键是什么?
1.NH3纯度尽可能高,且充满烧瓶;
2.烧瓶干燥;
3.装置气密性好。
【学习任务一】氨的性质:化学性质
1.与水反应
(一水合氨)
+ OH-
NH4
+
NH3 + H2O NH3·H2O
【检验氨气】使湿润的红色石蕊试纸变蓝。
氨水
2.与酸反应
NH3+HCl == NH4Cl
NH3 + HNO3 == NH4NO3
2NH3 + H2SO4 == (NH4)2SO4
现象:
生成大量白烟
【检验氨气】
NH3 + H+ == NH4+
3.与O2反应
( 氨的催化氧化)
4NH3 + 5O2 4NO + 6H2O
高温
催化剂
?
氧化剂、还原剂分别是?转移电子数为?
【学习任务一】氨的性质:化学性质
【结论】氨气能与水、酸发生反应,具有还原性。
1.与水反应
2.与酸反应
NH3+H2O NH3·H2O
NH3+HCl == NH4Cl
3.还原性
制备氨水
合成铵态氮肥
工业制硝酸
【学习任务一】氨的性质:应用
早期农业常用氮肥
(NH4)2SO4
NH4NO3
NH4HCO3
NH4Cl
【学习任务二】铵盐的性质
【学习任务二】铵盐的性质
NH4Cl NH3↑+HCl↑
△
NH4HCO3 NH3↑ +H2O ↑+CO2↑
△
2NH3↑+H2O ↑+CO2 ↑
(NH4)2CO3
△
1.不稳定性:
2.与碱反应:
NH4++ OH- = NH3↑+H2O
△
【结论】
1.铵盐易溶于水,大多数铵盐受热易分解生成NH3,与强碱在加热条件下反应放出NH3。
2.NH4+的检验:向待测液加入NaOH溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,若试纸变蓝,则说明原溶液中有NH4+。
【学习任务三】氨的制备
1.工业制法
N2+3H2 2NH3
2.实验室制法
实验室用铵盐(NH4Cl)与消石灰混合加热来制取氨气。
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
氨的实验室制法
【思考】
1.如何检验试管中已收集满氨?
在试管口放置一片湿润的红色石蕊试纸
2.如何吸收处理实验中多余的氨?
可在导管口放一团用水或稀硫酸浸湿的棉花球
3.如何干燥氨气?
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
【学习任务三】氨的制备
学习评价
1.下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨极易溶于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使酚酞试剂变为红色
C
2.下列反应中说明氨气具有还原性和碱性的是( )
D. NH3+HCl === NH4Cl
B
B. 8NH3+3Cl2 === 6NH4Cl+N2
C.4NH3+5O2===4NO+6H2O
催化剂
A. 2NH3+3CuO === 3Cu+N2+3H2O
学习评价
3.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( )
学习评价
C
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
g.mol-1
M=m/n
Na
6.02X1023mol-1
n=N/M
摩尔(mol)
n
M
【小结】
第二节 氮及其化合物
第二课时 氨和铵盐
第五章 化工生产中的重要非金属元素
工业合成氨
弗里茨·哈伯
第一个从空气中制造出氨的科学家,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
卡尔·博施
格哈德·埃特尔
改进了高压合成氨的催化方法,实现了合成氨的工业化生产,并在发展高压化学方面取得成就。因此获得1931年诺贝尔化学奖。
发现了哈伯-博施合成氨的作用机理,并以此为开端推动了表面化学动力学的发展。因此获得2007年诺贝尔化学奖。
【课堂引入】
工业合成氨
弗里茨·哈伯
第一个从空气中制造出氨的科学家,加速了世界农业的发展,因此获得1918年诺贝尔化学奖。
“使人类从此摆脱了依靠天然氮肥的被动局面”
“利用空气制造面包的人”
氨
氮肥
1.氨有什么性质?
2.氨又是怎样转化为氮肥的呢?
【课堂引入】
【学习任务一】氨的性质:物理性质
溶解性:
颜 色:
状 态:
气 味:
密 度:
无色
气体
有刺激性气味
比空气的小
氨易液化得到液氨,液氨可用作制冷剂。
1.物理性质
【实验5-6】喷泉实验
操作:打开橡胶管上的弹簧夹,挤压胶头滴管,使少量水进入烧瓶。
现象:烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,烧瓶内液体颜色呈红色。
原理:氨极易溶于水,使烧瓶内的压强迅速减小,形成较大的压强差,导致烧杯中的水在大气压的作用下进入烧瓶。
【思考】氨气为什么能形成喷泉现象?
溶解性:
极易溶于水。常温常压下,1体积水大约可溶解700体积氨。
【学习任务一】氨的性质:喷泉实验
【学习任务一】氨的性质:喷泉实验
【思考2】氨的喷泉实验成功的关键是什么?
1.NH3纯度尽可能高,且充满烧瓶;
2.烧瓶干燥;
3.装置气密性好。
【学习任务一】氨的性质:化学性质
1.与水反应
(一水合氨)
+ OH-
NH4
+
NH3 + H2O NH3·H2O
【检验氨气】使湿润的红色石蕊试纸变蓝。
氨水
2.与酸反应
NH3+HCl == NH4Cl
NH3 + HNO3 == NH4NO3
2NH3 + H2SO4 == (NH4)2SO4
现象:
生成大量白烟
【检验氨气】
NH3 + H+ == NH4+
3.与O2反应
( 氨的催化氧化)
4NH3 + 5O2 4NO + 6H2O
高温
催化剂
?
氧化剂、还原剂分别是?转移电子数为?
【学习任务一】氨的性质:化学性质
【结论】氨气能与水、酸发生反应,具有还原性。
1.与水反应
2.与酸反应
NH3+H2O NH3·H2O
NH3+HCl == NH4Cl
3.还原性
制备氨水
合成铵态氮肥
工业制硝酸
【学习任务一】氨的性质:应用
早期农业常用氮肥
(NH4)2SO4
NH4NO3
NH4HCO3
NH4Cl
【学习任务二】铵盐的性质
【学习任务二】铵盐的性质
NH4Cl NH3↑+HCl↑
△
NH4HCO3 NH3↑ +H2O ↑+CO2↑
△
2NH3↑+H2O ↑+CO2 ↑
(NH4)2CO3
△
1.不稳定性:
2.与碱反应:
NH4++ OH- = NH3↑+H2O
△
【结论】
1.铵盐易溶于水,大多数铵盐受热易分解生成NH3,与强碱在加热条件下反应放出NH3。
2.NH4+的检验:向待测液加入NaOH溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,若试纸变蓝,则说明原溶液中有NH4+。
【学习任务三】氨的制备
1.工业制法
N2+3H2 2NH3
2.实验室制法
实验室用铵盐(NH4Cl)与消石灰混合加热来制取氨气。
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
氨的实验室制法
【思考】
1.如何检验试管中已收集满氨?
在试管口放置一片湿润的红色石蕊试纸
2.如何吸收处理实验中多余的氨?
可在导管口放一团用水或稀硫酸浸湿的棉花球
3.如何干燥氨气?
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
△
【学习任务三】氨的制备
学习评价
1.下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨极易溶于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(不容易分解)
D.氨溶于水显弱碱性,因此可使酚酞试剂变为红色
C
2.下列反应中说明氨气具有还原性和碱性的是( )
D. NH3+HCl === NH4Cl
B
B. 8NH3+3Cl2 === 6NH4Cl+N2
C.4NH3+5O2===4NO+6H2O
催化剂
A. 2NH3+3CuO === 3Cu+N2+3H2O
学习评价
3.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( )
学习评价
C
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
g.mol-1
M=m/n
Na
6.02X1023mol-1
n=N/M
摩尔(mol)
n
M
【小结】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
