鲁教版九年级下册第七单元 常见的酸和碱测试题
文档属性
| 名称 | 鲁教版九年级下册第七单元 常见的酸和碱测试题 |  | |
| 格式 | zip | ||
| 文件大小 | 174.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-03-20 14:33:59 | ||
图片预览



文档简介
常见酸与碱测试题
一.选择题(共17小题)
1.下列酸碱盐之间的转化不能 一步完成的是( )
A. Fe(OH)3→Fe2(SO4)3 B. H2SO4→CuSO4
C. Na2CO3→NaOH D. BaSO4→Ba(NO3)2
2.下列各组物质中符合“酸碱盐氧化物”顺序的是( )
A. H2SO4、Na2O、MgCl2、C B. NaHCO3、Ba(OH)2、Na2CO3、Zn
C. HNO3、KOH、Na2CO3、O2 D. HCl、KOH、Na2CO3、SiO2
3.(2013 自贡)推理是化学学习中常用的思维方法.下列推理正确的是( )
A. 氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物
B. NaOH溶液中的OH﹣能与酸反应,则KOH溶液中的OH﹣也能与酸反应
C. 饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
D. 盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐
4.(2013 珠海)盐酸先生闯迷宫(如图),请你帮他选择行进路线(不发生化学反应)( )
A. A B. B C. C D. D
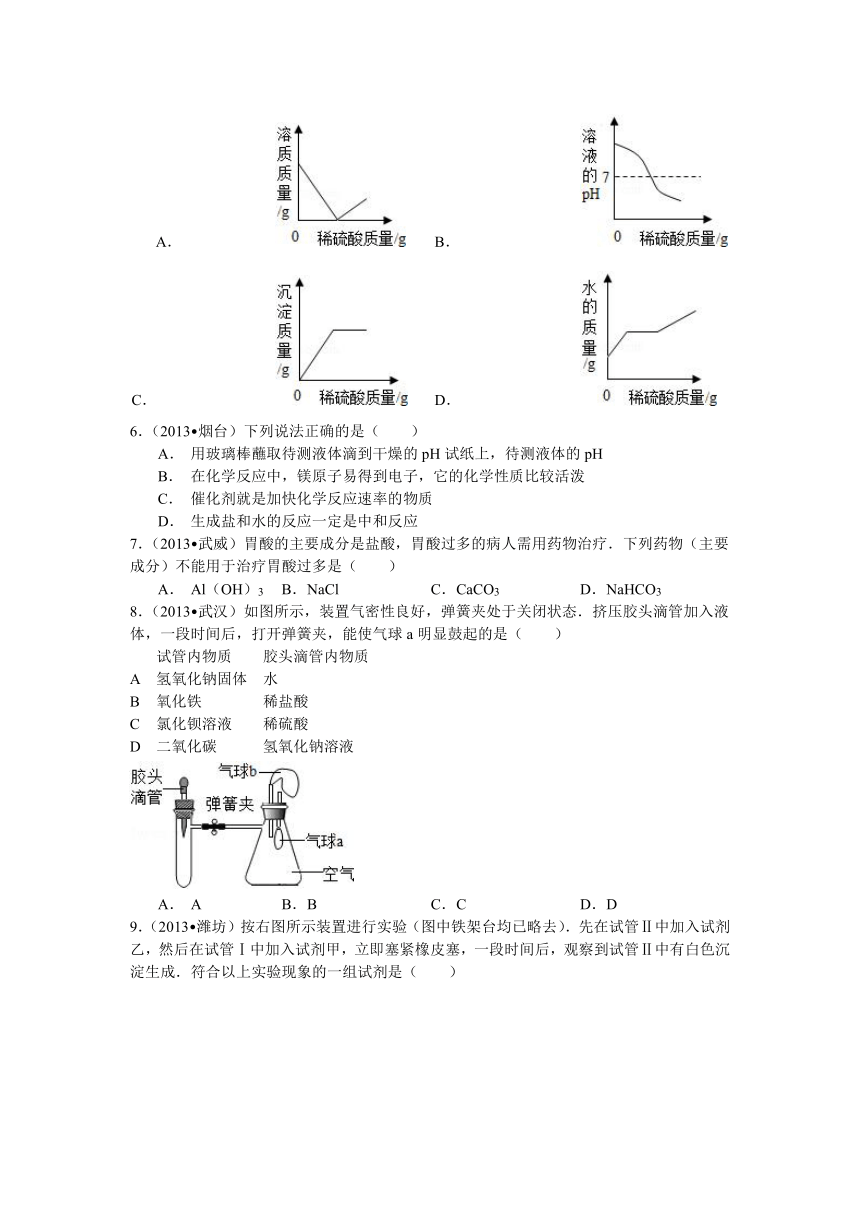
5.(2013 枣庄)向盛有50g10%Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,如图(纵坐标表示烧杯中其他量的变化)所有有关量的变化与所加入稀硫酸质量的关系错误的是( )
A. B. C. D.
6.(2013 烟台)下列说法正确的是( )
A. 用玻璃棒蘸取待测液体滴到干燥的pH试纸上,待测液体的pH
B. 在化学反应中,镁原子易得到电子,它的化学性质比较活泼
C. 催化剂就是加快化学反应速率的物质
D. 生成盐和水的反应一定是中和反应
7.(2013 武威)胃酸的主要成分是盐酸,胃酸过多的病人需用药物治疗.下列药物(主要成分)不能用于治疗胃酸过多是( )
A. Al(OH)3 B. NaCl C. CaCO3 D. NaHCO3
8.(2013 武汉)如图所示,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能使气球a明显鼓起的是( )
试管内物质 胶头滴管内物质
A 氢氧化钠固体 水
B 氧化铁 稀盐酸
C 氯化钡溶液 稀硫酸
D 二氧化碳 氢氧化钠溶液
A. A B. B C. C D. D
9.(2013 潍坊)按右图所示装置进行实验(图中铁架台均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是( )
A.甲:NaHCO3、稀HCl;乙:NaOH溶液 B. 甲:Al,稀H2SO4;乙:Ba(NO3)2溶液
C.甲:MgO,稀盐酸;乙:AgNO3 D. 甲:Cu、稀H2SO4;乙:BaCl2溶液
10.(2013 泰州)下列实验方案设计中,正确的是( )
A. 除去 NaCl 中少量的 Na2CO3杂质,先加入足量稀盐酸,再蒸发结晶
B. 检验可燃性气体中是否含有氢元素,在其燃烧火焰上方罩上干冷的烧杯,观察有无水雾
C. 实验测定某矿石中碳酸钙的质量分数,先加入硫酸,再比较反应前后的质量变化
D. 实验室制备干燥、纯净的氢气,用锌与浓盐酸反应,产生的气体经浓硫酸干燥后收集
11.(2013 泰安)生活中一些物质的pH如下表所示,其中显碱性的是( )
柠檬 糖水 牙膏 牛奶
pH 2~3 7 8~9 6~7
A.柠檬 B. 糖水 C. 牙膏 D. 牛奶
12.(2013 苏州)下列除去杂质(在括号内)选用的试剂(在箭头右侧)错误的是( )
A. CO2气体(H2O)→生石灰 B. C粉(CuO)→稀盐酸
C. CaCl2溶液(HCl)→碳酸钙粉末 D. CO气体(CO2)→氢氧化钠溶液
13.(2013 日照)向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
烧杯中的物质 x溶液
A 稀盐酸和硫酸铜溶液 烧碱溶液
B 稀硫酸和稀盐酸 氯化钡溶液
C 镁铝合金 稀盐酸
D 氯化钠和碳酸氢钠溶液 稀盐酸
A. A B. B C. C D. D
14.(2013 日照)如图所示,实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响.经数小时实验后,U形管A、B两处的液面会出现下列哪种情况( )
A. A处下降,B处上升 B. A、B两处都下降
C. A处上升,B处下降 D. A、B两处都不变
15.(2013 庆阳)电影《黄金大劫案》上映后,里面用“王水”(浓盐酸与浓硝酸的混合液)溶解黄金的情节引起了广泛的热议.黄金溶解在“王水”中形成HAuCl4(四氯合金酸),没有氢气产生.根据以上信息,下列有关说法正确的是( )
①“王水”溶解黄金是化学变化;
②金比氢活泼;
③HAuCl4中,Au的化合价为+3价;
④可以将pH试纸伸入“王水”中测其酸碱度;
⑤“王水”可以用铁质容器盛装.
A.①④⑤ B. ①②③ C. ③④⑤ D. ①③
16.(2013 青岛)逻辑推理是化学学习中常用的思维方法.下列推理正确的是( )
A. 中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B. 化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
C. 单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D. 活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
17.(2013 哈尔滨)除去下列物质中的少量杂质.所选用的试剂和操作方法都正确的是( )
选项 物质 杂质 试剂 操作方法
A MnO2 KCl 适量水 溶解、过滤、蒸发、结晶
B CO2 H2 足量氧气 点燃
C NaOH溶液 Ca(OH)2 适量Na2CO3溶液 过滤
D 稀盐酸 硝酸 适量硝酸银溶液 过滤
A. A B. B C. C D. D
二.填空题(共6小题)
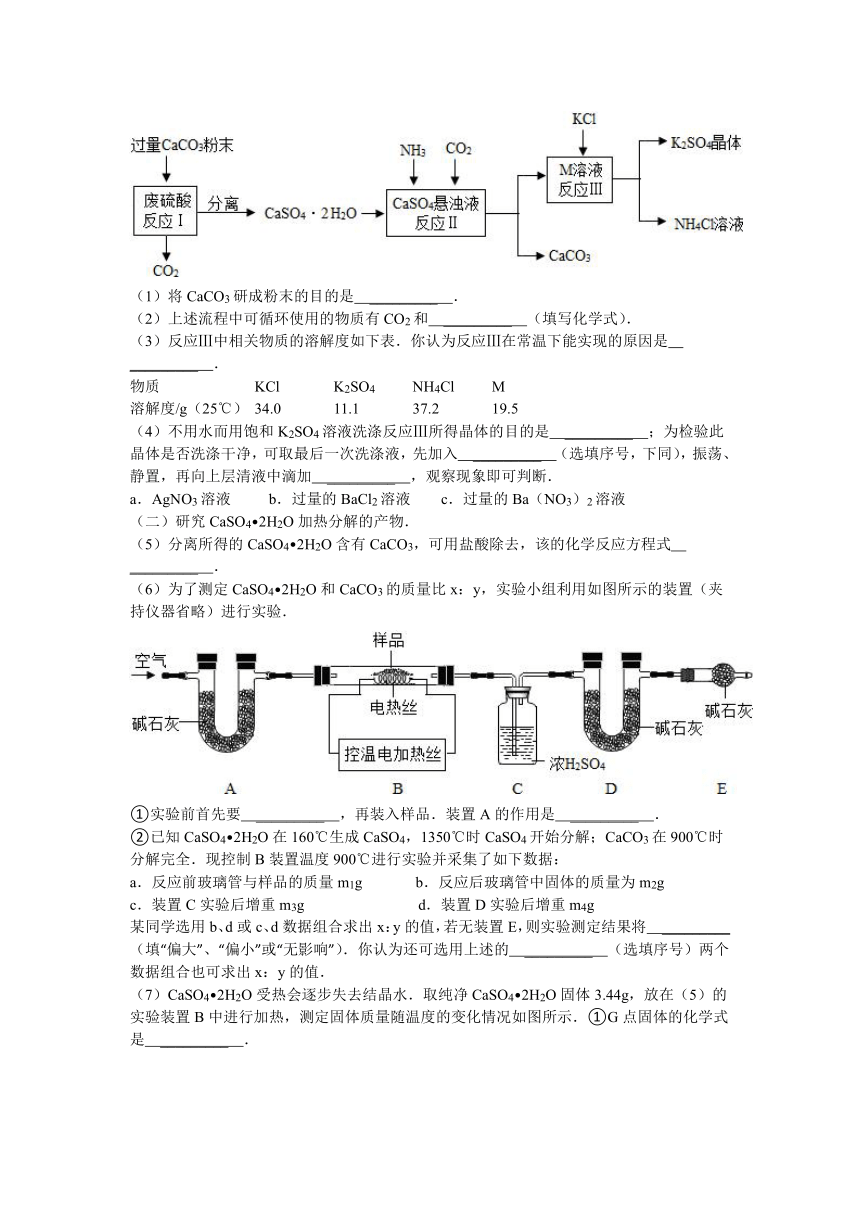
18.(2013 镇江)某实验小组利用废硫酸液制备K2SO4并研究CaSO4 2H2O加热分解的产物.
(一)K2SO4的制备
(1)将CaCO3研成粉末的目的是 _________ .
(2)上述流程中可循环使用的物质有CO2和 _________ (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 _________ .
物质 KCl K2SO4 NH4Cl M
溶解度/g(25℃) 34.0 11.1 37.2 19.5
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 _________ ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 _________ (选填序号,下同),振荡、静置,再向上层清液中滴加 _________ ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4 2H2O加热分解的产物.
(5)分离所得的CaSO4 2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 _________ .
(6)为了测定CaSO4 2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.
①实验前首先要 _________ ,再装入样品.装置A的作用是 _________ .
②已知CaSO4 2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 _________ (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 _________ (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4 2H2O受热会逐步失去结晶水.取纯净CaSO4 2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 _________ .
②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 _________ .
19.(2013 梅州)我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:
(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液呈 _________ 色.
(2)写出反应I的化学方程式 _________ ;该反应的基本类型为 _________ .
(3)操作a的过程是蒸发浓缩、 _________ 、过滤.
(4)上述工艺流程中可循环利用的物质是 _________ .
20.(2013 泉州)化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:
(1)A、B、C三种金属的活动性顺序为 _________ > _________ > _________ .
(2)金属C是 _________ ,操作a的名称是 _________ .
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: _________ .
21.(2013 荆门)用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如下:
请回答下列问题:
(1)固体B的成分是 _________ (用符号表示);
(2)操作I的名称是 _________ ;操作I所需要的仪器和用品:铁架台、玻璃仪器、试剂、 _________ (填一种实验物品名称).
(3)反应①、②、③中没有涉及到的化学反应类型是 _________ (填字母代号)
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(4)请书写下列反应的化学方程式:
反应② _________ ;
反应③ _________ .
22.(2013 锦州)张老师在指导学生记忆化学方程式时指出很多反应可以归纳,如:氧化钙、氢氧化钙、碳酸钙等与盐酸反应时生成物中都含有氯化钙和水.同学们兴趣很高,也进行了归纳:
(1)甲物质与稀硫酸反应时生成物中有CuSO4和H2O,则甲物质可以是 _________ 和 _________ (请填写两种不同类别物质的化学式);写出上述转化过程中,属于中和反应的化学方程式 _________ .
(2)A﹣H都是初中常见的物质,其中D为蓝色沉淀,A、E是组成元素相同的两种气体,F、H为黑色固体.他们之间转化关系如下图(反应条件及部分反应物和生成物已略去)
①反应F→B属于 _________ (填基本反应类型)
②C的化学式是 _________ .
③写出反应AE化学方程式 _________
④答出G的一种用途 _________ .
23.(2013 鄂尔多斯)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉.某同学自制了脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐),并用该脱氧剂进行如下两个实验:
实验Ⅰ:
请回答:操作a的名称是 _________ ,溶液丙中含有的溶质是 _________ .(写化学式)
实验Ⅱ:将乙烘干后进行如下实验,物质之间的转化关系如图(部分产物略去).
(1)反应②属于基本反应类型中的 _________ 反应.
(2)向溶液C中加入Ba(NO3)2溶液,有白色沉淀产生,其化学方程式为 _________ .
(3)区别溶液C与溶液D的物理方法是 _________ .
三.解答题(共3小题)
24.(2013 潍坊)化学实验技能是学习化学和进行探究活动的基础和保证.某化学兴趣小组进行了一些实验,主要操作过程如图所示:
请回答下列问题:
(1)实验甲中烧杯内的现象是 _________ ;所需的硫酸铜溶液,在配制前应先将硫酸铜晶体放于 _________ 内将其捣碎.
(2)实验乙中的一处明显错误是 _________ .
(3)实验乙、丙中均使用到了玻璃棒.下列实验中必须使用玻璃棒 _________ (填写字母序号).
A.稀释浓硫酸
B.硫在氧气中燃烧
C.用PH试纸测肥皂水的PH
D.实验室制取二氧化碳
(4)实验丁中将氧化铜和木炭粉混合物加入试管中的正确操作是 _________ .为进一步提高实验的温度,应采取的措施是 _________ .
25.实验室有一瓶未知溶质质量分数的氢氧化钠溶液.某探究小组欲通过化学实验测定其溶质质量分数,取40g该氢氧化钠溶液于烧杯中,滴入酚酞试液.
(1)向其中慢慢滴加19.6%稀硫酸,并不断搅拌,当用去19.6%的稀硫酸20g时,溶液恰好褪成无色,此时溶液pH _________ 7(填:“>”“=”“<”).
(2)求氢氧化钠溶液中溶质的质量分数.
26.(2013 淮安)某化学兴趣小组学习酸、碱、盐性质后,通过实验对碱的化学性质进行验证和总结,如图所示(已知:CaCl2溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl).
(1)甲同学将酚酞试液滴入Ca(OH)2溶液中,观察到溶液变红,得出结论:Ca(OH)2溶液呈 _________ (填“酸性”、“碱性”或“中性”);
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到红色褪去,此时所得溶液中含有的溶质有 _________ (酸碱指示剂除外);
(3)丙同学根据反应③得出结论:实验室存放碱溶液时需 _________ ;
(4)丁同学将Na2CO3溶液加入Ca(OH)2溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是 _________ (酸碱指示剂除外),可能含有的溶质是 _________ ;为验证可能含有的溶质,应该补充的实验操作是 _________ .
参考答案
一.选择题(共17小题)
1. D.2. D.3. B.4. B.5. D.6. A.7. B.8. D.9. B.10. AB.11. C.12. A13. A.14. C.15. D.16. B.17. C.
二.填空题(共6小题)
18.(1)加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分).
(2)CaCO3
(3)常温下K2SO4的溶解度小.
(4)减少K2SO4的溶解.c a
(5)CaCO3+2HCl=CaCl2+CO2↑+H2O
(6)①检查装置的气密性. 除去空气中的CO2和H2O(意思相近均给分).②偏小 b、c
(7)①CaSO4 H2O ②2CaSO42CaO+2SO2↑+O2↑
19.(1)红;(2)2NaHCO3Na2CO3+H2O+CO2↑,分解反应;(3)结晶;(4)CO2.
20.解:(1)A B C
(2)Ag;蒸发结晶;
(3)Mn+H2SO4=MnSO4+H2↑
21.(1)Cu,Fe (2)过滤,滤纸; (3)B;(4)FeSO4+2KOH=Fe(OH)2↓+K2SO4,2Fe(OH)2+H2O2=2Fe(OH)3.
22.(1)CuO;Cu(OH)2;H2SO4+Cu(OH)2=CuSO4+2H2O;
(2)①置换反应;②CuSO4;③Fe2O3+3CO2Fe+3CO2;④做建筑材料等;
23.实验Ⅰ:过滤;FeSO4、NaCl、H2SO4;实验Ⅱ:(1)置换(2)CuSO4+Ba(NO3)2═BaSO4↓+Cu(NO3)2;(3)观察溶液颜色,蓝色为CuSO4溶液,浅绿色为FeSO4溶液.
三.解答题(共3小题)
24.(1)有蓝色沉淀;研钵;
(2)滤纸上边缘没有低于漏斗口;
(3)AC;
(4)试管倾斜,把盛有药品的药匙(或纸槽)送至试管底部,将试管直立;加网罩使火焰集中.
25.解:(1)向滴有酚酞试液的氢氧化钠溶液滴加稀硫酸时,溶液恰好褪成无色,氢氧化钠与所加入硫酸恰好完全反应,所得溶液呈中性,溶液pH=7;
故答案为:=;
(2)设氢氧化钠溶液中溶质的质量为x.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 20g×19.6%
=
x=3.2g
氢氧化钠溶液中溶质的质量分数==8%
答:氢氧化钠溶液中溶质的质量分数为8%.
26.(1)碱性;(2)CaCl2、HCl;(3)密封保存;(4)NaCl;CaCl2;取少量上层清液于试管中,向试管内滴加碳酸钠溶液,如果有白色沉淀生成,说明含有氯化钙,如果没有白色沉淀生成,说明不含有氯化钙.
一.选择题(共17小题)
1.下列酸碱盐之间的转化不能 一步完成的是( )
A. Fe(OH)3→Fe2(SO4)3 B. H2SO4→CuSO4
C. Na2CO3→NaOH D. BaSO4→Ba(NO3)2
2.下列各组物质中符合“酸碱盐氧化物”顺序的是( )
A. H2SO4、Na2O、MgCl2、C B. NaHCO3、Ba(OH)2、Na2CO3、Zn
C. HNO3、KOH、Na2CO3、O2 D. HCl、KOH、Na2CO3、SiO2
3.(2013 自贡)推理是化学学习中常用的思维方法.下列推理正确的是( )
A. 氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物
B. NaOH溶液中的OH﹣能与酸反应,则KOH溶液中的OH﹣也能与酸反应
C. 饱和溶液不能继续溶解某种溶质,则饱和溶液也不能继续溶解其他溶质
D. 盐是由金属离子和酸根离子组成的,NH4NO3中没有金属离子,不属于盐
4.(2013 珠海)盐酸先生闯迷宫(如图),请你帮他选择行进路线(不发生化学反应)( )
A. A B. B C. C D. D
5.(2013 枣庄)向盛有50g10%Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,如图(纵坐标表示烧杯中其他量的变化)所有有关量的变化与所加入稀硫酸质量的关系错误的是( )
A. B. C. D.
6.(2013 烟台)下列说法正确的是( )
A. 用玻璃棒蘸取待测液体滴到干燥的pH试纸上,待测液体的pH
B. 在化学反应中,镁原子易得到电子,它的化学性质比较活泼
C. 催化剂就是加快化学反应速率的物质
D. 生成盐和水的反应一定是中和反应
7.(2013 武威)胃酸的主要成分是盐酸,胃酸过多的病人需用药物治疗.下列药物(主要成分)不能用于治疗胃酸过多是( )
A. Al(OH)3 B. NaCl C. CaCO3 D. NaHCO3
8.(2013 武汉)如图所示,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能使气球a明显鼓起的是( )
试管内物质 胶头滴管内物质
A 氢氧化钠固体 水
B 氧化铁 稀盐酸
C 氯化钡溶液 稀硫酸
D 二氧化碳 氢氧化钠溶液
A. A B. B C. C D. D
9.(2013 潍坊)按右图所示装置进行实验(图中铁架台均已略去).先在试管Ⅱ中加入试剂乙,然后在试管Ⅰ中加入试剂甲,立即塞紧橡皮塞,一段时间后,观察到试管Ⅱ中有白色沉淀生成.符合以上实验现象的一组试剂是( )
A.甲:NaHCO3、稀HCl;乙:NaOH溶液 B. 甲:Al,稀H2SO4;乙:Ba(NO3)2溶液
C.甲:MgO,稀盐酸;乙:AgNO3 D. 甲:Cu、稀H2SO4;乙:BaCl2溶液
10.(2013 泰州)下列实验方案设计中,正确的是( )
A. 除去 NaCl 中少量的 Na2CO3杂质,先加入足量稀盐酸,再蒸发结晶
B. 检验可燃性气体中是否含有氢元素,在其燃烧火焰上方罩上干冷的烧杯,观察有无水雾
C. 实验测定某矿石中碳酸钙的质量分数,先加入硫酸,再比较反应前后的质量变化
D. 实验室制备干燥、纯净的氢气,用锌与浓盐酸反应,产生的气体经浓硫酸干燥后收集
11.(2013 泰安)生活中一些物质的pH如下表所示,其中显碱性的是( )
柠檬 糖水 牙膏 牛奶
pH 2~3 7 8~9 6~7
A.柠檬 B. 糖水 C. 牙膏 D. 牛奶
12.(2013 苏州)下列除去杂质(在括号内)选用的试剂(在箭头右侧)错误的是( )
A. CO2气体(H2O)→生石灰 B. C粉(CuO)→稀盐酸
C. CaCl2溶液(HCl)→碳酸钙粉末 D. CO气体(CO2)→氢氧化钠溶液
13.(2013 日照)向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
烧杯中的物质 x溶液
A 稀盐酸和硫酸铜溶液 烧碱溶液
B 稀硫酸和稀盐酸 氯化钡溶液
C 镁铝合金 稀盐酸
D 氯化钠和碳酸氢钠溶液 稀盐酸
A. A B. B C. C D. D
14.(2013 日照)如图所示,实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度变化对实验结果的影响.经数小时实验后,U形管A、B两处的液面会出现下列哪种情况( )
A. A处下降,B处上升 B. A、B两处都下降
C. A处上升,B处下降 D. A、B两处都不变
15.(2013 庆阳)电影《黄金大劫案》上映后,里面用“王水”(浓盐酸与浓硝酸的混合液)溶解黄金的情节引起了广泛的热议.黄金溶解在“王水”中形成HAuCl4(四氯合金酸),没有氢气产生.根据以上信息,下列有关说法正确的是( )
①“王水”溶解黄金是化学变化;
②金比氢活泼;
③HAuCl4中,Au的化合价为+3价;
④可以将pH试纸伸入“王水”中测其酸碱度;
⑤“王水”可以用铁质容器盛装.
A.①④⑤ B. ①②③ C. ③④⑤ D. ①③
16.(2013 青岛)逻辑推理是化学学习中常用的思维方法.下列推理正确的是( )
A. 中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B. 化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
C. 单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D. 活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
17.(2013 哈尔滨)除去下列物质中的少量杂质.所选用的试剂和操作方法都正确的是( )
选项 物质 杂质 试剂 操作方法
A MnO2 KCl 适量水 溶解、过滤、蒸发、结晶
B CO2 H2 足量氧气 点燃
C NaOH溶液 Ca(OH)2 适量Na2CO3溶液 过滤
D 稀盐酸 硝酸 适量硝酸银溶液 过滤
A. A B. B C. C D. D
二.填空题(共6小题)
18.(2013 镇江)某实验小组利用废硫酸液制备K2SO4并研究CaSO4 2H2O加热分解的产物.
(一)K2SO4的制备
(1)将CaCO3研成粉末的目的是 _________ .
(2)上述流程中可循环使用的物质有CO2和 _________ (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 _________ .
物质 KCl K2SO4 NH4Cl M
溶解度/g(25℃) 34.0 11.1 37.2 19.5
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 _________ ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 _________ (选填序号,下同),振荡、静置,再向上层清液中滴加 _________ ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4 2H2O加热分解的产物.
(5)分离所得的CaSO4 2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 _________ .
(6)为了测定CaSO4 2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.
①实验前首先要 _________ ,再装入样品.装置A的作用是 _________ .
②已知CaSO4 2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 _________ (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 _________ (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4 2H2O受热会逐步失去结晶水.取纯净CaSO4 2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 _________ .
②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 _________ .
19.(2013 梅州)我国化学家侯德榜发明了联合制碱法,其生产纯碱的产品和副产品氯化铵的工艺流程如图所示:
(1)NH3溶于水得到氨水,将无色酚酞溶液滴入氨水中,溶液呈 _________ 色.
(2)写出反应I的化学方程式 _________ ;该反应的基本类型为 _________ .
(3)操作a的过程是蒸发浓缩、 _________ 、过滤.
(4)上述工艺流程中可循环利用的物质是 _________ .
20.(2013 泉州)化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程:
(1)A、B、C三种金属的活动性顺序为 _________ > _________ > _________ .
(2)金属C是 _________ ,操作a的名称是 _________ .
(3)已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: _________ .
21.(2013 荆门)用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如下:
请回答下列问题:
(1)固体B的成分是 _________ (用符号表示);
(2)操作I的名称是 _________ ;操作I所需要的仪器和用品:铁架台、玻璃仪器、试剂、 _________ (填一种实验物品名称).
(3)反应①、②、③中没有涉及到的化学反应类型是 _________ (填字母代号)
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(4)请书写下列反应的化学方程式:
反应② _________ ;
反应③ _________ .
22.(2013 锦州)张老师在指导学生记忆化学方程式时指出很多反应可以归纳,如:氧化钙、氢氧化钙、碳酸钙等与盐酸反应时生成物中都含有氯化钙和水.同学们兴趣很高,也进行了归纳:
(1)甲物质与稀硫酸反应时生成物中有CuSO4和H2O,则甲物质可以是 _________ 和 _________ (请填写两种不同类别物质的化学式);写出上述转化过程中,属于中和反应的化学方程式 _________ .
(2)A﹣H都是初中常见的物质,其中D为蓝色沉淀,A、E是组成元素相同的两种气体,F、H为黑色固体.他们之间转化关系如下图(反应条件及部分反应物和生成物已略去)
①反应F→B属于 _________ (填基本反应类型)
②C的化学式是 _________ .
③写出反应AE化学方程式 _________
④答出G的一种用途 _________ .
23.(2013 鄂尔多斯)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉.某同学自制了脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐),并用该脱氧剂进行如下两个实验:
实验Ⅰ:
请回答:操作a的名称是 _________ ,溶液丙中含有的溶质是 _________ .(写化学式)
实验Ⅱ:将乙烘干后进行如下实验,物质之间的转化关系如图(部分产物略去).
(1)反应②属于基本反应类型中的 _________ 反应.
(2)向溶液C中加入Ba(NO3)2溶液,有白色沉淀产生,其化学方程式为 _________ .
(3)区别溶液C与溶液D的物理方法是 _________ .
三.解答题(共3小题)
24.(2013 潍坊)化学实验技能是学习化学和进行探究活动的基础和保证.某化学兴趣小组进行了一些实验,主要操作过程如图所示:
请回答下列问题:
(1)实验甲中烧杯内的现象是 _________ ;所需的硫酸铜溶液,在配制前应先将硫酸铜晶体放于 _________ 内将其捣碎.
(2)实验乙中的一处明显错误是 _________ .
(3)实验乙、丙中均使用到了玻璃棒.下列实验中必须使用玻璃棒 _________ (填写字母序号).
A.稀释浓硫酸
B.硫在氧气中燃烧
C.用PH试纸测肥皂水的PH
D.实验室制取二氧化碳
(4)实验丁中将氧化铜和木炭粉混合物加入试管中的正确操作是 _________ .为进一步提高实验的温度,应采取的措施是 _________ .
25.实验室有一瓶未知溶质质量分数的氢氧化钠溶液.某探究小组欲通过化学实验测定其溶质质量分数,取40g该氢氧化钠溶液于烧杯中,滴入酚酞试液.
(1)向其中慢慢滴加19.6%稀硫酸,并不断搅拌,当用去19.6%的稀硫酸20g时,溶液恰好褪成无色,此时溶液pH _________ 7(填:“>”“=”“<”).
(2)求氢氧化钠溶液中溶质的质量分数.
26.(2013 淮安)某化学兴趣小组学习酸、碱、盐性质后,通过实验对碱的化学性质进行验证和总结,如图所示(已知:CaCl2溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl).
(1)甲同学将酚酞试液滴入Ca(OH)2溶液中,观察到溶液变红,得出结论:Ca(OH)2溶液呈 _________ (填“酸性”、“碱性”或“中性”);
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到红色褪去,此时所得溶液中含有的溶质有 _________ (酸碱指示剂除外);
(3)丙同学根据反应③得出结论:实验室存放碱溶液时需 _________ ;
(4)丁同学将Na2CO3溶液加入Ca(OH)2溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是 _________ (酸碱指示剂除外),可能含有的溶质是 _________ ;为验证可能含有的溶质,应该补充的实验操作是 _________ .
参考答案
一.选择题(共17小题)
1. D.2. D.3. B.4. B.5. D.6. A.7. B.8. D.9. B.10. AB.11. C.12. A13. A.14. C.15. D.16. B.17. C.
二.填空题(共6小题)
18.(1)加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分).
(2)CaCO3
(3)常温下K2SO4的溶解度小.
(4)减少K2SO4的溶解.c a
(5)CaCO3+2HCl=CaCl2+CO2↑+H2O
(6)①检查装置的气密性. 除去空气中的CO2和H2O(意思相近均给分).②偏小 b、c
(7)①CaSO4 H2O ②2CaSO42CaO+2SO2↑+O2↑
19.(1)红;(2)2NaHCO3Na2CO3+H2O+CO2↑,分解反应;(3)结晶;(4)CO2.
20.解:(1)A B C
(2)Ag;蒸发结晶;
(3)Mn+H2SO4=MnSO4+H2↑
21.(1)Cu,Fe (2)过滤,滤纸; (3)B;(4)FeSO4+2KOH=Fe(OH)2↓+K2SO4,2Fe(OH)2+H2O2=2Fe(OH)3.
22.(1)CuO;Cu(OH)2;H2SO4+Cu(OH)2=CuSO4+2H2O;
(2)①置换反应;②CuSO4;③Fe2O3+3CO2Fe+3CO2;④做建筑材料等;
23.实验Ⅰ:过滤;FeSO4、NaCl、H2SO4;实验Ⅱ:(1)置换(2)CuSO4+Ba(NO3)2═BaSO4↓+Cu(NO3)2;(3)观察溶液颜色,蓝色为CuSO4溶液,浅绿色为FeSO4溶液.
三.解答题(共3小题)
24.(1)有蓝色沉淀;研钵;
(2)滤纸上边缘没有低于漏斗口;
(3)AC;
(4)试管倾斜,把盛有药品的药匙(或纸槽)送至试管底部,将试管直立;加网罩使火焰集中.
25.解:(1)向滴有酚酞试液的氢氧化钠溶液滴加稀硫酸时,溶液恰好褪成无色,氢氧化钠与所加入硫酸恰好完全反应,所得溶液呈中性,溶液pH=7;
故答案为:=;
(2)设氢氧化钠溶液中溶质的质量为x.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 20g×19.6%
=
x=3.2g
氢氧化钠溶液中溶质的质量分数==8%
答:氢氧化钠溶液中溶质的质量分数为8%.
26.(1)碱性;(2)CaCl2、HCl;(3)密封保存;(4)NaCl;CaCl2;取少量上层清液于试管中,向试管内滴加碳酸钠溶液,如果有白色沉淀生成,说明含有氯化钙,如果没有白色沉淀生成,说明不含有氯化钙.
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
