2.1.1共价键(第1课时 共价键)(课件精讲)(共30张PPT)高二化学同步课件精讲(人教版2019选择性必修2)
文档属性
| 名称 | 2.1.1共价键(第1课时 共价键)(课件精讲)(共30张PPT)高二化学同步课件精讲(人教版2019选择性必修2) |  | |
| 格式 | zip | ||
| 文件大小 | 19.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-16 09:53:00 | ||
图片预览









文档简介
(共30张PPT)
第一节 共价键
第1课时:共价键
第二章 分子结构与性质
学习
目标
PART
01
PART
02
π键的形成过程
PART
03
σ键的形成过程
共价键的概念
诺贝尔物理学奖得主理查德·费曼曾说过,假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆由原子构成”。
原子是如何构成物质的?
01
共价键的概念
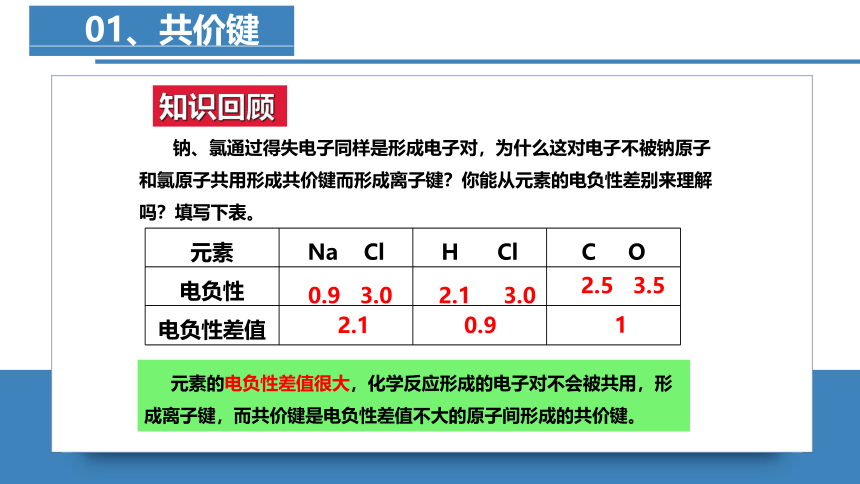
01、共价键
知识回顾
元素 Na Cl H Cl C O
电负性
电负性差值
钠、氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键?你能从元素的电负性差别来理解吗?填写下表。
0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1
元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
01、共价键
原子间通过共用电子对所形成的强烈相互作用
定义
本质
共价键的本质是原子之间形成共用电子对(或原子轨道的重叠)。自旋方向的未成对电子形成共用电子对。
(1)成键粒子:原子。
(2)成键实质:共用电子对。
(3)形成条件:一般由非金属元素的原子结合。
02
σ键及其形成过程
02、σ键及其形成过程
【思考与讨论】
H2、HCl、Cl2均通过共用电子对相结合,为什么难以形成H3、H2Cl、Cl3等分子?
由于电子对的共用,H2、HCl、Cl2分子中,各原子核外电子达到饱和。不能再形成H3、H2Cl、Cl3等分子。
02、σ键及其形成过程
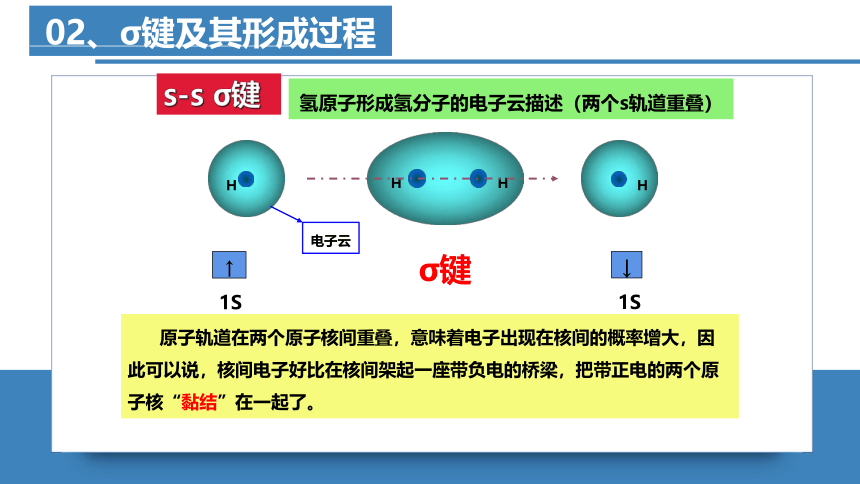
氢原子形成氢分子的过程
02、σ键及其形成过程
H
H
H
H
氢原子形成氢分子的电子云描述(两个s轨道重叠)
σ键
电子云
↑
1S
↓
1S
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,因此可以说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
s-s σ键
02、σ键及其形成过程
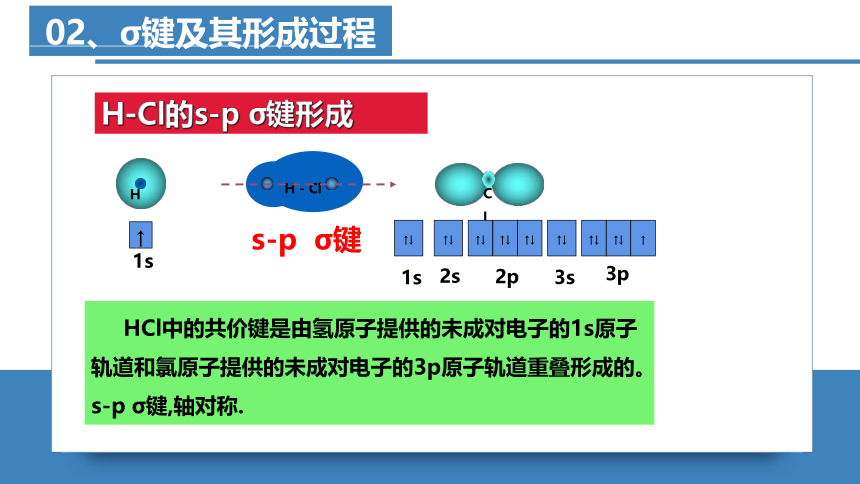
H-Cl的s-p σ键形成
02、σ键及其形成过程
H-Cl的s-p σ键形成
H
Cl
H-Cl
s-p σ键
↑
1s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
HCl中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道重叠形成的。s-p σ键,轴对称.
02、σ键及其形成过程
Cl-Cl的p-p σ键形成
02、σ键及其形成过程
Cl
Cl
Cl
Cl
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
Cl2中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。p—p σ键,轴对称.
Cl-Cl的p-p σ键形成
p-p σ键
02、σ键及其形成过程
σ键的重叠方式:“头碰头”
σ键
①概念:σ键是两原子在成键时,原子轨道以“头碰头”的方式
重叠形成的共价键。
②σ键的类型:根据成键时,原子轨道的不同,σ键可分为s-s σ
键、s-p σ键、p-p σ键。
02、σ键及其形成过程
(1)以形成化学键的两原子核的连线为轴作旋转操作,共价键电
子云的图形不变,这种特征称为轴对称。
σ键的特征
(2)形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
(3)以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,
旋转时并不破坏σ键的结构。
03
π键的形成过程
03、π键及其形成过程
p轨道与p轨道除了能形成σ键外,还能形成π键。
π键的特征是两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧。每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
π键
03、π键及其形成过程
概念:形成共价键的未成对电子的原子轨道,采取“肩并肩”
的方式重叠,这种共价键叫π键,主要类型为p-p π键,
P-P π键的形成过程
π键
03、π键及其形成过程
(1)每个π键的电子云由两块组成,分别位于由两原子核
构成平面的两侧,如果以它们之间包含原子核的平面
为镜面,它们互为镜像,这种特征称为镜面对称。
π键的特征
(2)形成π键时电子云重叠程度比σ键小,π键不如σ键
牢固。特例:N2分子中的π键比σ键稳定。
03、π键及其形成过程
N2中1个p-p σ键和2个p-p π键的形成过程
↑ ↑ ↑
2P3轨道
π键的形成过程
03、π键及其形成过程
O2 中 p-p σ键和 p-p π键的形成过程
p-p σ键
p-p π键
两队孤对
电子对电子云
↑↓ ↑ ↑
2P4轨道
π键
03、π键及其形成过程
①s-s电子、s-p电子只形成σ键;p-p电子既形
成σ键,又形成π键;且 p-p电子先形成σ键,
后形成π键。
②共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个是π键。
判断σ键、π键的一般规律
03、π键及其形成过程
观察下图中乙烷、乙烯和乙炔分子的球棍模型,回答相关问题。
问题思考:
(1)乙烯和乙炔分子中的碳原子间,既存在σ键,又存在π键,σ键和π键的成键方
式有何不同
【思考与讨论】
σ键是原子轨道以“头碰头”方式发生重叠成键;π键是p轨道与p轨道以“肩并肩”方式发生重叠成键。
03、π键及其形成过程
乙烷、乙烯和乙炔分子中的共价键分别有几个 σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
【思考与讨论】
03、π键及其形成过程
1. C – H 是σ键。
2. C—C 是σ键。
3. C=C 一个σ键,一个π键。
4. C≡C 一个σ键,两个π键。
乙烯、乙炔分子中C—C σ键比较稳定不容易断裂, π键比较容易断裂。
乙烯
乙炔
乙烯、乙炔分子的球棍模型
03、π键及其形成过程
(3)乙烯和乙炔的化学性质为什么比乙烷活泼
乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
03、π键及其形成过程
原子 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性之差 (绝对值) 2.1 0.9 1.0 当成键原子的电负性相差很大时,形成的电子对不会被共用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的化学键。
共价键的形成条件
结论:
一、化学键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
1.正误判断
(1)形成共价键后体系的能量降低,趋于稳定( )
(2)共价键的饱和性是由成键原子的未成对电子数决定的( )
(3)共价键的饱和性决定了分子内部原子的数量关系( )
(4)共价键的方向性是由成键原子轨道的方向性决定的( )
(5)原子轨道在空间都具有方向性( )
√
√
√
√
×
第一节 共价键
第1课时:共价键
第二章 分子结构与性质
学习
目标
PART
01
PART
02
π键的形成过程
PART
03
σ键的形成过程
共价键的概念
诺贝尔物理学奖得主理查德·费曼曾说过,假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆由原子构成”。
原子是如何构成物质的?
01
共价键的概念
01、共价键
知识回顾
元素 Na Cl H Cl C O
电负性
电负性差值
钠、氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键?你能从元素的电负性差别来理解吗?填写下表。
0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1
元素的电负性差值很大,化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大的原子间形成的共价键。
01、共价键
原子间通过共用电子对所形成的强烈相互作用
定义
本质
共价键的本质是原子之间形成共用电子对(或原子轨道的重叠)。自旋方向的未成对电子形成共用电子对。
(1)成键粒子:原子。
(2)成键实质:共用电子对。
(3)形成条件:一般由非金属元素的原子结合。
02
σ键及其形成过程
02、σ键及其形成过程
【思考与讨论】
H2、HCl、Cl2均通过共用电子对相结合,为什么难以形成H3、H2Cl、Cl3等分子?
由于电子对的共用,H2、HCl、Cl2分子中,各原子核外电子达到饱和。不能再形成H3、H2Cl、Cl3等分子。
02、σ键及其形成过程
氢原子形成氢分子的过程
02、σ键及其形成过程
H
H
H
H
氢原子形成氢分子的电子云描述(两个s轨道重叠)
σ键
电子云
↑
1S
↓
1S
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,因此可以说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
s-s σ键
02、σ键及其形成过程
H-Cl的s-p σ键形成
02、σ键及其形成过程
H-Cl的s-p σ键形成
H
Cl
H-Cl
s-p σ键
↑
1s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
HCl中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道重叠形成的。s-p σ键,轴对称.
02、σ键及其形成过程
Cl-Cl的p-p σ键形成
02、σ键及其形成过程
Cl
Cl
Cl
Cl
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
Cl2中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。p—p σ键,轴对称.
Cl-Cl的p-p σ键形成
p-p σ键
02、σ键及其形成过程
σ键的重叠方式:“头碰头”
σ键
①概念:σ键是两原子在成键时,原子轨道以“头碰头”的方式
重叠形成的共价键。
②σ键的类型:根据成键时,原子轨道的不同,σ键可分为s-s σ
键、s-p σ键、p-p σ键。
02、σ键及其形成过程
(1)以形成化学键的两原子核的连线为轴作旋转操作,共价键电
子云的图形不变,这种特征称为轴对称。
σ键的特征
(2)形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。
(3)以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,
旋转时并不破坏σ键的结构。
03
π键的形成过程
03、π键及其形成过程
p轨道与p轨道除了能形成σ键外,还能形成π键。
π键的特征是两个原子轨道以平行或“肩并肩” 方式重叠;原子重叠的部分分别位于两原子核构成平面的两侧。每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
π键
03、π键及其形成过程
概念:形成共价键的未成对电子的原子轨道,采取“肩并肩”
的方式重叠,这种共价键叫π键,主要类型为p-p π键,
P-P π键的形成过程
π键
03、π键及其形成过程
(1)每个π键的电子云由两块组成,分别位于由两原子核
构成平面的两侧,如果以它们之间包含原子核的平面
为镜面,它们互为镜像,这种特征称为镜面对称。
π键的特征
(2)形成π键时电子云重叠程度比σ键小,π键不如σ键
牢固。特例:N2分子中的π键比σ键稳定。
03、π键及其形成过程
N2中1个p-p σ键和2个p-p π键的形成过程
↑ ↑ ↑
2P3轨道
π键的形成过程
03、π键及其形成过程
O2 中 p-p σ键和 p-p π键的形成过程
p-p σ键
p-p π键
两队孤对
电子对电子云
↑↓ ↑ ↑
2P4轨道
π键
03、π键及其形成过程
①s-s电子、s-p电子只形成σ键;p-p电子既形
成σ键,又形成π键;且 p-p电子先形成σ键,
后形成π键。
②共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个是π键。
判断σ键、π键的一般规律
03、π键及其形成过程
观察下图中乙烷、乙烯和乙炔分子的球棍模型,回答相关问题。
问题思考:
(1)乙烯和乙炔分子中的碳原子间,既存在σ键,又存在π键,σ键和π键的成键方
式有何不同
【思考与讨论】
σ键是原子轨道以“头碰头”方式发生重叠成键;π键是p轨道与p轨道以“肩并肩”方式发生重叠成键。
03、π键及其形成过程
乙烷、乙烯和乙炔分子中的共价键分别有几个 σ键和几个π键组成?
乙炔分子中由
3个σ键和
2个π键组成。
乙烷分子中由7个σ键组成;
乙烯分子中由
5个σ键和
1个π键组成;
【思考与讨论】
03、π键及其形成过程
1. C – H 是σ键。
2. C—C 是σ键。
3. C=C 一个σ键,一个π键。
4. C≡C 一个σ键,两个π键。
乙烯、乙炔分子中C—C σ键比较稳定不容易断裂, π键比较容易断裂。
乙烯
乙炔
乙烯、乙炔分子的球棍模型
03、π键及其形成过程
(3)乙烯和乙炔的化学性质为什么比乙烷活泼
乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。
03、π键及其形成过程
原子 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性之差 (绝对值) 2.1 0.9 1.0 当成键原子的电负性相差很大时,形成的电子对不会被共用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的化学键。
共价键的形成条件
结论:
一、化学键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
特征
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
特征
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
1.正误判断
(1)形成共价键后体系的能量降低,趋于稳定( )
(2)共价键的饱和性是由成键原子的未成对电子数决定的( )
(3)共价键的饱和性决定了分子内部原子的数量关系( )
(4)共价键的方向性是由成键原子轨道的方向性决定的( )
(5)原子轨道在空间都具有方向性( )
√
√
√
√
×
