2.2.2分子的空间结构(第2课时+价层电子对互斥模型)(课件精讲)(共37张PPT)高二化学同步课件精讲(人教版2019选择性必修2)
文档属性
| 名称 | 2.2.2分子的空间结构(第2课时+价层电子对互斥模型)(课件精讲)(共37张PPT)高二化学同步课件精讲(人教版2019选择性必修2) |

|
|
| 格式 | zip | ||
| 文件大小 | 17.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-16 00:00:00 | ||
图片预览








文档简介
(共37张PPT)
第二节 分子的空间结构
第2课时:价层电子对互斥模型
第二章 分子结构与性质
学习
目标
PART
01
PART
02
中心原子上的孤电子对数
PART
03
σ键电子对数
价层电子对互斥模型
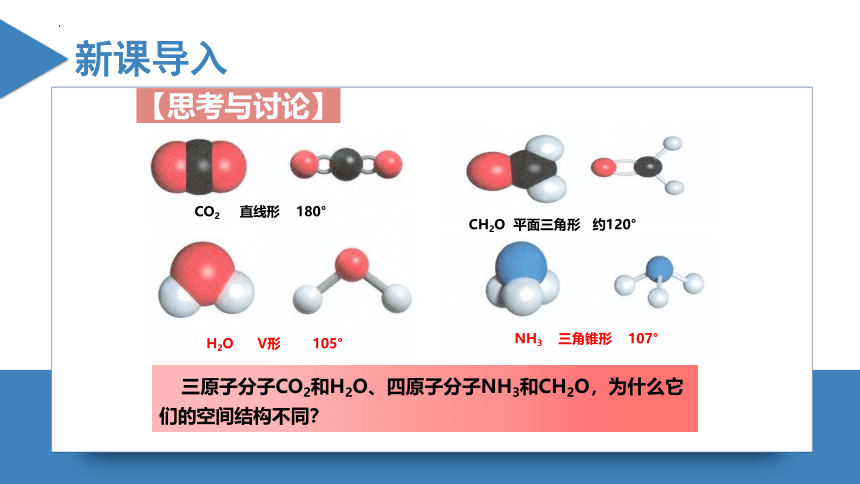
CO2 直线形 180°
H2O V形 105°
CH2O 平面三角形 约120°
NH3 三角锥形 107°
三原子分子CO2和H2O、四原子分子NH3和CH2O,为什么它们的空间结构不同?
【思考与讨论】
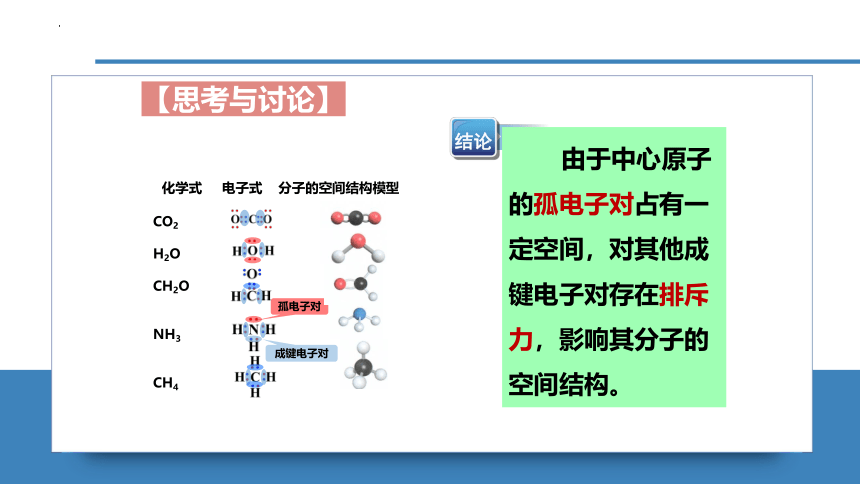
写出分子的电子式,再对照其球棍模型,运用分类、对比的方法,分析结构不同的原因。
CO2
H2O
CH2O
NH3
CH4
化学式 电子式 分子的空间结构模型
【思考与讨论】
化学式 电子式 分子的空间结构模型
CO2
H2O
CH2O
NH3
CH4
成键电子对
孤电子对
结论
由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。
【思考与讨论】
01
价层电子对互斥模型
01、价层电子对互斥模型理
价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对互斥理论的内容
分子中的价层电子对包括σ键电子对和中心原子上的孤电子对,多重键只计其中σ键的电子对,不计π键电子对。
01、价层电子对互斥模型理
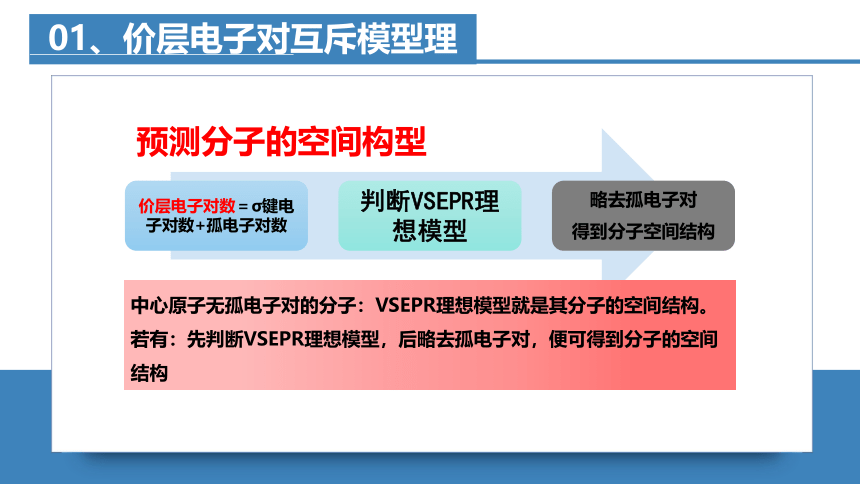
预测分子的空间构型
中心原子无孤电子对的分子:VSEPR理想模型就是其分子的空间结构。
若有:先判断VSEPR理想模型,后略去孤电子对,便可得到分子的空间结构
01、价层电子对互斥模型理
如何计算价层电子对数
01、价层电子对互斥模型理
中心原子(C原子)形成了两条σ键(两对σ键电子对),没有孤电子对,总和为2对价层电子对。为了使它们之间斥力最小,就应使夹角为180°,也就预测出了CO2不可能是直角形状,而必定是直线型。
预测分子或离子的空间构型
CO2为什么不是直角形状,而是直线型呢?
01、价层电子对互斥模型理
中心原子(C原子)形成了四条σ键(四对σ键电子对),没有孤电子对,总和为4对价层电子对。为了使它们之间斥力最小,就应使夹角为109°28’,不能是90°。也就预测出了CH4必定是正四面体。
CH4为什么不是正方形,而是正四面体结构呢?
02
σ键电子对数
02、σ键电子对数
ABn型分子,A为中心原子,B为周围与A用共价键结合的原子。n为结合的数量,也等于A与B之间结合的σ键个数,即σ键电子对的数量。即σ键电子对数=中心原子结合的原子数。
分子 中心原子 共价键 键数 键电子对数
H2O O O-H 2
NH3 N N-H 3
SO3 S S=O 3
2
3
3
03
中心原子上的孤电子对数
03、中心原子上的孤电子对数
1、a为中心原子的价电子数(对于主族元素等于原子的最外层电子数);
2、x为与中心原子结合的原子数;
3、b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子 为“8减去该原子的价电子数”,氧和氧族元素中的S、Se等均为2,卤族元素均为1
公式计算中心原子上的孤电子对数= (a-xb)
2
1
03、中心原子上的孤电子对数
对主族元素,a=最外层电子数;
对于阳离子,a=价电子数-离子电荷数;
对于阴离子,a=价电子数+|离子电荷数|。
公式计算中心原子上的孤电子对数= (a-xb)
2
1
03、中心原子上的孤电子对数
根据电子式直接确定
公式计算中心原子上的孤电子对数= (a-xb)
CH4
×(4-4×1)=0
NH3
×(5-3×1)=1
H2O
×(6-2×1)=2
2
1
2
1
2
1
2
1
03、中心原子上的孤电子对数
C原子的孤电子对为( 4 - 4×1 )÷ 2 = 0 个;
分子中一个C原子与4个H原子形成了4个σ键电子对;
则价层电子对为4。这4对价层电子对之间彼此排斥,便得到了正四面体的VSEPR模型,也就是甲烷分子的空间构型。
例:CH4:
03、中心原子上的孤电子对数
C原子的孤电子对为( 4 - 2×2 )÷ 2 = 0 个;
分子中一个C原子与2个O原子形成了2个σ键电子对;
则价层电子对为2。这2对价层电子对之间彼此排斥,便得到了直线型的VSEPR模型,也就是二氧化碳分子的空间构型。
例:CO2:
03、中心原子上的孤电子对数
分析下表中分子或离子的孤电子对数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
SO2
NH4+
CO32-
CO2
SO42-
S
N
C
C
S
0
1
4
5-1=4
1
2
2
6
4+2=6
4
6+2=8
3
2
4
2
0
0
2
2
0
= (a-xb)
03、中心原子上的孤电子对数
计算价层电子对数=中心原子的σ键电子对数+孤电子对数
代表物 电子式 中心原子结合的原子数 σ键 电子对数 孤电子数 价层电子对数
H2O
NH3
CO2
CH4
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O C O
::
::
:
:
:
:
2
3
4
2
2
2
4
3
1
4
4
0
4
2
0
2
(1)中心原子上的价电子都用于形成共价键,无孤对电子。
如CO2、CH2O、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n(价层电子对数)来预测,概括如下:
ABn 立体结构 范例
n=2 直线形 CO2、 CS2
n=3 平面三角形 CH2O、BF3
n=4 正四面体形 CH4、 CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SCl6
确定价层电子对互斥模型
中心原子上有孤电子对的分子的立体构型
化学式 路易斯结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
H2O
NH3
V形
三角锥形
化学式 路易斯结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
HCN
H3O+
SO2
直线形
三角锥形
V形
..
得到VSEPR模型以后,若分子的中心原子有孤电子对,中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。再讨论空间构型时应略去孤电子对,才是该分子的实际空间构型。
例如:CH4、NH3、H2O
中心原子都是4对价层电子对,它们相互排斥,VSEPR模型都是四面体,但CH4孤电子对为0,正四面体NH3孤电子对为1,三角锥形H2O孤电子对为2,V形
得到VSEPR模型以后,若分子的中心原子有孤电子对,中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。再讨论空间构型时应略去孤电子对,才是该分子的实际空间构型。
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
点拨
H2O、NH3的键角分别是105°、107°,请解释原因。
H2O、NH3的价层电子对均为4,H2O、NH3的的孤电子对分别为2、1,分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对 >成键电子-成键电子,故H2O、NH3的键角分别是105°、107°。
【思考与讨论】
价电子对互斥模型
σ键电子对
中心原子上的
孤对电子数目
价层电子对数
价层电子对
互斥模型
VSEPR模型
略去孤电子对
分子的立体构型
A
1.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )
A.CO2 B.NH3
C.H2O D.SO2
A
2.下列微粒的中心原子的价层电子对数正确的是A.HCHO 3
B.CS2 1
C.BCl3 2
D.SO3 2
D
3.用价层电子对互斥理论预测H2Se和NF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;平面三角形C.直线形;平面三角形 D.V形;三角锥形
A
4.下列分子或离子中,含有孤电子对的是( )A.H2O B.CH4C.SiH4 D.NH4+
C
5.下列分子的空间构型正确的是
A.PCl3平面三角形 B.H2O 直线型C.SiH4正四面体 D.N2O V型
6.运用价层电子对互斥模型推测下列分子或离子的空间结构。
(1)BeCl2 ;
(2)SCl2 ;
(3) SO32- ;
(4)PF3 。
直线形
V形
三角锥形
三角锥形
第二节 分子的空间结构
第2课时:价层电子对互斥模型
第二章 分子结构与性质
学习
目标
PART
01
PART
02
中心原子上的孤电子对数
PART
03
σ键电子对数
价层电子对互斥模型
CO2 直线形 180°
H2O V形 105°
CH2O 平面三角形 约120°
NH3 三角锥形 107°
三原子分子CO2和H2O、四原子分子NH3和CH2O,为什么它们的空间结构不同?
【思考与讨论】
写出分子的电子式,再对照其球棍模型,运用分类、对比的方法,分析结构不同的原因。
CO2
H2O
CH2O
NH3
CH4
化学式 电子式 分子的空间结构模型
【思考与讨论】
化学式 电子式 分子的空间结构模型
CO2
H2O
CH2O
NH3
CH4
成键电子对
孤电子对
结论
由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。
【思考与讨论】
01
价层电子对互斥模型
01、价层电子对互斥模型理
价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对互斥理论的内容
分子中的价层电子对包括σ键电子对和中心原子上的孤电子对,多重键只计其中σ键的电子对,不计π键电子对。
01、价层电子对互斥模型理
预测分子的空间构型
中心原子无孤电子对的分子:VSEPR理想模型就是其分子的空间结构。
若有:先判断VSEPR理想模型,后略去孤电子对,便可得到分子的空间结构
01、价层电子对互斥模型理
如何计算价层电子对数
01、价层电子对互斥模型理
中心原子(C原子)形成了两条σ键(两对σ键电子对),没有孤电子对,总和为2对价层电子对。为了使它们之间斥力最小,就应使夹角为180°,也就预测出了CO2不可能是直角形状,而必定是直线型。
预测分子或离子的空间构型
CO2为什么不是直角形状,而是直线型呢?
01、价层电子对互斥模型理
中心原子(C原子)形成了四条σ键(四对σ键电子对),没有孤电子对,总和为4对价层电子对。为了使它们之间斥力最小,就应使夹角为109°28’,不能是90°。也就预测出了CH4必定是正四面体。
CH4为什么不是正方形,而是正四面体结构呢?
02
σ键电子对数
02、σ键电子对数
ABn型分子,A为中心原子,B为周围与A用共价键结合的原子。n为结合的数量,也等于A与B之间结合的σ键个数,即σ键电子对的数量。即σ键电子对数=中心原子结合的原子数。
分子 中心原子 共价键 键数 键电子对数
H2O O O-H 2
NH3 N N-H 3
SO3 S S=O 3
2
3
3
03
中心原子上的孤电子对数
03、中心原子上的孤电子对数
1、a为中心原子的价电子数(对于主族元素等于原子的最外层电子数);
2、x为与中心原子结合的原子数;
3、b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子 为“8减去该原子的价电子数”,氧和氧族元素中的S、Se等均为2,卤族元素均为1
公式计算中心原子上的孤电子对数= (a-xb)
2
1
03、中心原子上的孤电子对数
对主族元素,a=最外层电子数;
对于阳离子,a=价电子数-离子电荷数;
对于阴离子,a=价电子数+|离子电荷数|。
公式计算中心原子上的孤电子对数= (a-xb)
2
1
03、中心原子上的孤电子对数
根据电子式直接确定
公式计算中心原子上的孤电子对数= (a-xb)
CH4
×(4-4×1)=0
NH3
×(5-3×1)=1
H2O
×(6-2×1)=2
2
1
2
1
2
1
2
1
03、中心原子上的孤电子对数
C原子的孤电子对为( 4 - 4×1 )÷ 2 = 0 个;
分子中一个C原子与4个H原子形成了4个σ键电子对;
则价层电子对为4。这4对价层电子对之间彼此排斥,便得到了正四面体的VSEPR模型,也就是甲烷分子的空间构型。
例:CH4:
03、中心原子上的孤电子对数
C原子的孤电子对为( 4 - 2×2 )÷ 2 = 0 个;
分子中一个C原子与2个O原子形成了2个σ键电子对;
则价层电子对为2。这2对价层电子对之间彼此排斥,便得到了直线型的VSEPR模型,也就是二氧化碳分子的空间构型。
例:CO2:
03、中心原子上的孤电子对数
分析下表中分子或离子的孤电子对数
分子或离子 中心原子 a x b 中心原子上的孤电子对数
SO2
NH4+
CO32-
CO2
SO42-
S
N
C
C
S
0
1
4
5-1=4
1
2
2
6
4+2=6
4
6+2=8
3
2
4
2
0
0
2
2
0
= (a-xb)
03、中心原子上的孤电子对数
计算价层电子对数=中心原子的σ键电子对数+孤电子对数
代表物 电子式 中心原子结合的原子数 σ键 电子对数 孤电子数 价层电子对数
H2O
NH3
CO2
CH4
:
:
:
H O H
:
:
:
:
H N H
:
H
:
:
:
H C H
:
H
H
O C O
::
::
:
:
:
:
2
3
4
2
2
2
4
3
1
4
4
0
4
2
0
2
(1)中心原子上的价电子都用于形成共价键,无孤对电子。
如CO2、CH2O、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n(价层电子对数)来预测,概括如下:
ABn 立体结构 范例
n=2 直线形 CO2、 CS2
n=3 平面三角形 CH2O、BF3
n=4 正四面体形 CH4、 CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SCl6
确定价层电子对互斥模型
中心原子上有孤电子对的分子的立体构型
化学式 路易斯结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
H2O
NH3
V形
三角锥形
化学式 路易斯结构式 含孤电子对的VSEPR模型 分子或离子的立体构型 分子或离子的立体构型名称
HCN
H3O+
SO2
直线形
三角锥形
V形
..
得到VSEPR模型以后,若分子的中心原子有孤电子对,中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。再讨论空间构型时应略去孤电子对,才是该分子的实际空间构型。
例如:CH4、NH3、H2O
中心原子都是4对价层电子对,它们相互排斥,VSEPR模型都是四面体,但CH4孤电子对为0,正四面体NH3孤电子对为1,三角锥形H2O孤电子对为2,V形
得到VSEPR模型以后,若分子的中心原子有孤电子对,中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。再讨论空间构型时应略去孤电子对,才是该分子的实际空间构型。
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
随着孤电子对数目的增多,孤电子对与成键电子对之间的斥力增大,键角减小。
点拨
H2O、NH3的键角分别是105°、107°,请解释原因。
H2O、NH3的价层电子对均为4,H2O、NH3的的孤电子对分别为2、1,分子中电子对之间的斥力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对 >成键电子-成键电子,故H2O、NH3的键角分别是105°、107°。
【思考与讨论】
价电子对互斥模型
σ键电子对
中心原子上的
孤对电子数目
价层电子对数
价层电子对
互斥模型
VSEPR模型
略去孤电子对
分子的立体构型
A
1.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )
A.CO2 B.NH3
C.H2O D.SO2
A
2.下列微粒的中心原子的价层电子对数正确的是A.HCHO 3
B.CS2 1
C.BCl3 2
D.SO3 2
D
3.用价层电子对互斥理论预测H2Se和NF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;平面三角形C.直线形;平面三角形 D.V形;三角锥形
A
4.下列分子或离子中,含有孤电子对的是( )A.H2O B.CH4C.SiH4 D.NH4+
C
5.下列分子的空间构型正确的是
A.PCl3平面三角形 B.H2O 直线型C.SiH4正四面体 D.N2O V型
6.运用价层电子对互斥模型推测下列分子或离子的空间结构。
(1)BeCl2 ;
(2)SCl2 ;
(3) SO32- ;
(4)PF3 。
直线形
V形
三角锥形
三角锥形
