仁爱版初中化学九下 8.2 金属的化学性质 教案(表格式)
文档属性
| 名称 | 仁爱版初中化学九下 8.2 金属的化学性质 教案(表格式) |

|
|
| 格式 | doc | ||
| 文件大小 | 78.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-15 00:00:00 | ||
图片预览


文档简介
《金属的化学性质》教学设计 第1课时
教学目标分析
知识与技能:
(1)知道镁、铁、铝、铜等常见金属与氧气的反应。
(2)初步认识常见金属与盐酸、硫酸的反应,能根据金属和酸反应的剧烈程度判断他们的活泼性。并掌握置换反应的概念。
过程与方法:
(1) 通过对镁、铁、铝、铜等常见金属在空气中和氧气中燃烧的实验探究,体验和学习利用控制实验条件进行科学探究的方法,学会运用控制实验条件探究金属活动性顺序。
(2) 通过对常见金属与盐酸、硫酸的反应的剧烈程度判断他们的活泼性。学习对实验现象进行筛选、对比、归纳、分析、进行信息处理,获取科学结论的科学方法。
情感态度与价值观:
(1) 通过对五彩纷呈的化学现象的观察,激发学生的好奇心和求知欲,发展学习化学的兴趣。
(2)培养学生的合作意识以及勤于思考、勇于创新实践、严谨求实的科学精神。
教学重难点:
重点:掌握置换反应
难点:金属活动性顺序的理解和应用
教学方法分析:
实验探究法;多媒体辅助教学法;小组合作交流、讨论、归纳相结合的教学方法。
教学准备:
多媒体课件、试管、镊子、酒精灯、坩埚钳、镁条、铝丝、锌粒、铜片、稀盐酸、稀硫酸
教学过程设计:(第一课时)
流 程 教师活动 学生活动 设计意图
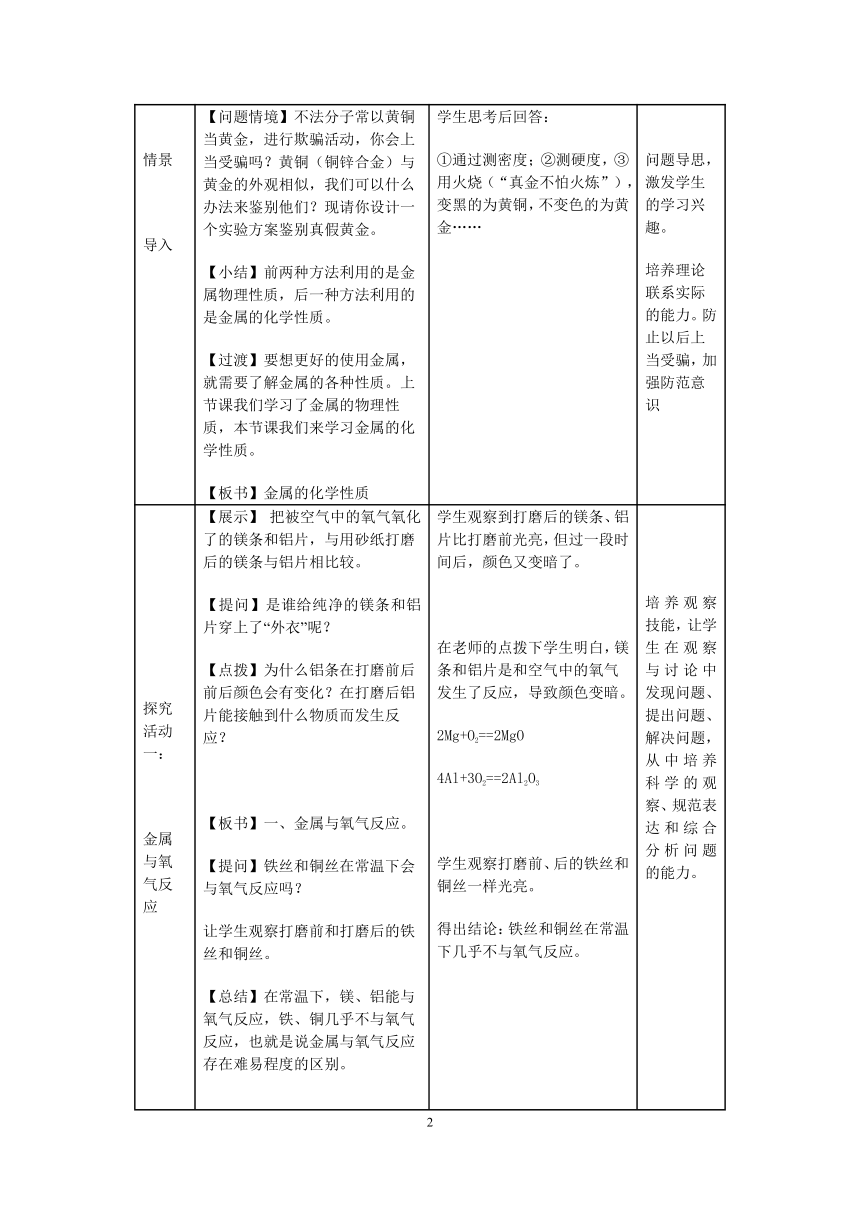
问题 情景 导入 多媒体展示:金镯子【问题情境】不法分子常以黄铜当黄金,进行欺骗活动,你会上当受骗吗?黄铜(铜锌合金)与黄金的外观相似,我们可以什么办法来鉴别他们?现请你设计一个实验方案鉴别真假黄金。【小结】前两种方法利用的是金属物理性质,后一种方法利用的是金属的化学性质。【过渡】要想更好的使用金属,就需要了解金属的各种性质。上节课我们学习了金属的物理性质,本节课我们来学习金属的化学性质。【板书】金属的化学性质 学生思考后回答:①通过测密度;②测硬度,③用火烧(“真金不怕火炼”),变黑的为黄铜,不变色的为黄金…… 问题导思,激发学生的学习兴趣。培养理论联系实际的能力。防止以后上当受骗,加强防范意识
探究活动一: 金属与氧气反应 【展示】 把被空气中的氧气氧化了的镁条和铝片,与用砂纸打磨后的镁条与铝片相比较。【提问】是谁给纯净的镁条和铝片穿上了“外衣”呢?【点拨】为什么铝条在打磨前后前后颜色会有变化?在打磨后铝片能接触到什么物质而发生反应?【板书】一、金属与氧气反应。【提问】铁丝和铜丝在常温下会与氧气反应吗?让学生观察打磨前和打磨后的铁丝和铜丝。【总结】在常温下,镁、铝能与氧气反应,铁、铜几乎不与氧气反应,也就是说金属与氧气反应存在难易程度的区别。【提问】在常温下,金属和氧气的反应难易程度不同,那在高温下,镁、铁、铝、铜和氧气反应又有什么不同呢?知识回顾:(1)镁条在空气中燃烧(2)铁丝在空气中和在纯氧中燃烧。实验探究铝丝和铜丝分别在空气中和在纯氧中燃烧。【总结】在高温下,金属与氧气反应剧烈程度也不同,反应剧烈程度由大到小:镁,铝,铁,铜。 学生观察到打磨后的镁条、铝片比打磨前光亮,但过一段时间后,颜色又变暗了。在老师的点拨下学生明白,镁条和铝片是和空气中的氧气发生了反应,导致颜色变暗。2Mg+O2==2MgO4Al+3O2==2Al2O3学生观察打磨前、后的铁丝和铜丝一样光亮。得出结论:铁丝和铜丝在常温下几乎不与氧气反应。学生回顾:(1)镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体。(2)铁丝在空气中只是发红。但在氧气中能剧烈燃烧,火星四射,生成黑色固体。3Fe+2O2Fe3O42Mg + O2 2MgO学生观察实验:铝丝在空气中点燃铝条变软,不能燃烧,但在氧气中也能剧烈燃烧,发出白光。铜丝在空气中和氧气中都不能燃烧,但加热后,铜丝变黑。2Cu + O22CuO4Al + 3O2 2 Al2O3 培养观察技能,让学生在观察与讨论中发现问题、提出问题、解决问题,从中培养科学的观察、规范表达和综合分析问题的能力。 培养对比能力,证明镁、铝较活泼,铁、铜次之,金最不活泼。
设问 小结 【提问】“真金不怕火炼”说明了什么?【总结】实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。如镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应。在高温时大多金属都能与氧气反应,但剧烈程度不同。“真金不怕火炼”说明金即使在高温时也不与氧气反应,根据上述事实,我们可判断出这些金属的活泼程度,即金属活动性。【板书】金属的活动性顺序:Mg>Al>Fe>Cu>Au 学生讨论得出:金那怕在高温下也不与氧气反应。 金属的活动性顺序: Mg>Al>Fe>Cu>Au 通过对比突破难点,并为金属活动性顺序做铺垫。
理论联系实际 【思考】铝的化学性质比铁活泼,为什么我们通常看见铁生锈而没有看到铝生锈?在清洗铝制品时应注意些什么? 学生思考,看书后得出答案:铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。清洁时不要破坏铝制品表面的保护膜。 联系生活,从学生熟悉的生活经验出发,问题导思,激发兴趣,培养理论联系实际、和综合分析问题的能力。
探究活动二:金属与稀酸的反应 【设问】金属与氧气存在难易程度与剧烈程度的区别,与酸反应是否也会存在差别呢?【板书】二、金属与酸反应。活动与探究:将学生分成A、B两大组:A组:在四支试管中分别放入一小块打磨光洁的镁条、锌粒、铁片、铜片,各加入约5 mL稀盐酸,观察现象,比较反应的剧烈程度;用燃着的木条放在试管口,观察并记录实验现象。B组:用稀硫酸代替稀盐酸进行实验,并比较发生的现象。探究参考:填写表格【学生活动,请两位同学上黑板书写上述反应的化学方程式,现象由学生口述】 学生分组实验并仔细观察实验现象,记录并通过比较、分析,得出结论。A组:金属与稀盐酸的反应金属是否有气体产生,速度如何化学方程式Mg Zn Fe Cu B组:金属与稀硫酸的反应金属是否有气体产生,速度如何化学方程式Mg Zn Fe Cu 【学生板书】A组:Mg+2HCl==MgCl2+H2↑Zn+2HCl == ZnCl2+H2↑Fe+2HCl==FeCl2+ H2↑B组:Mg+H2SO4==MgSO4+H2↑Zn +H2SO4== ZnSO4+ H2↑Fe+ H2SO4==FeSO4 + H2↑回答:(1)镁、锌、铁可与盐酸或稀硫酸反应生成氢气,铜不能与盐酸或稀硫酸反应。(2)镁、锌、铁与盐酸或稀硫酸反应时的剧烈程度不同。镁反应最剧烈,其次是锌,然后是铁。(3)与酸反应时,能生成氢气的金属活动性强;否则,就较弱。(4)镁、锌、铁、铜的金属活动性由强到弱。 培养实验操作能力、观察能力、思维推理能力和同学间的合作学习,学生自己总结出金属活动性顺序,让学生既有所获,又体验了成功的快感。 获得科学探究方法:控制变量法,对比实验法
讨论 小结 【提问】1.在镁、锌、铁、铜几种金属中,哪些金属能与盐酸、稀硫酸发生反应?哪些金属不能与盐酸、稀硫酸发生反应?由此你能把金属分为哪两类?哪类金属活泼些 2.通过以上实验,你得出的结论是什么?学生讨论并回答。 学生进行讨论、交流。思考、讨论并得出结论。 结论:可分为能与盐酸、稀硫酸发生反应的金属和不能与盐酸、稀硫酸发生反应的金属这两类(2)镁、锌、铁、铜的金属活动性由强到弱依次为Mg>Zn>Fe>Cu 为后面学习金属活动顺序时,为什么会出现氢元素打下基础。
投影 [过渡]大家观察这几个化学方程式Mg+2HCl==MgCl2+H2↑Zn+H2SO4==ZnSO4+H2↑Fe+H2SO4==FeSO4+H2↑请大家从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?它与我们学过的化合反应和分解反应的特点是否相同?【引出置换反应的概念】:置换反应:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫做置换反应。A + BC →AC+B 思考,回答:这些反应的特点是: 由一种单质跟一种化合物起反应生成另一种单质和另一种化合物。其特点不同于化合反应和分解反应。 化合反应:A + B + … → AB…(多变一)分解反应:AB… →A + B + … (一变多)置换反应:A +BC →AC + B 培养学生分析问题能力和实事求是的科学态度。 使学生在交流中互相启发,相互激励,发展和完善自我
小结 ①通过本节课的学习,你知道了金属的哪些化学性质?②你还有哪些收获或疑惑不解的地方? 学生自主总结本节课的主要内容。评价自己在本节课的启示和收获。 为下节课进一步得出金属活动性顺序搭台阶
板书设计
金属的化学性质
一、 金属与氧气反应
2Mg + O22MgO 3Fe + 2O2Fe3O4
4Al + 3O22Al2O3 2Cu + O22CuO
金属的活动性顺序:Mg>Al>Fe>Cu>Au
二、金属与酸反应
Mg+2HCl==MgCl2+H2↑ Mg+H2SO4==MgSO4+H2↑
Fe+2HCl==FeCl2+ H2↑ Fe+ H2SO4==FeSO4 + H2↑
Zn+2HCl == ZnCl2+H2↑ Zn +H2SO4== ZnSO4+ H2↑
金属的活动性顺序:Mg>Zn>Fe>Cu
置换反应: A + BC → AC + B
单质 化合物 化合物 单质
7
教学目标分析
知识与技能:
(1)知道镁、铁、铝、铜等常见金属与氧气的反应。
(2)初步认识常见金属与盐酸、硫酸的反应,能根据金属和酸反应的剧烈程度判断他们的活泼性。并掌握置换反应的概念。
过程与方法:
(1) 通过对镁、铁、铝、铜等常见金属在空气中和氧气中燃烧的实验探究,体验和学习利用控制实验条件进行科学探究的方法,学会运用控制实验条件探究金属活动性顺序。
(2) 通过对常见金属与盐酸、硫酸的反应的剧烈程度判断他们的活泼性。学习对实验现象进行筛选、对比、归纳、分析、进行信息处理,获取科学结论的科学方法。
情感态度与价值观:
(1) 通过对五彩纷呈的化学现象的观察,激发学生的好奇心和求知欲,发展学习化学的兴趣。
(2)培养学生的合作意识以及勤于思考、勇于创新实践、严谨求实的科学精神。
教学重难点:
重点:掌握置换反应
难点:金属活动性顺序的理解和应用
教学方法分析:
实验探究法;多媒体辅助教学法;小组合作交流、讨论、归纳相结合的教学方法。
教学准备:
多媒体课件、试管、镊子、酒精灯、坩埚钳、镁条、铝丝、锌粒、铜片、稀盐酸、稀硫酸
教学过程设计:(第一课时)
流 程 教师活动 学生活动 设计意图
问题 情景 导入 多媒体展示:金镯子【问题情境】不法分子常以黄铜当黄金,进行欺骗活动,你会上当受骗吗?黄铜(铜锌合金)与黄金的外观相似,我们可以什么办法来鉴别他们?现请你设计一个实验方案鉴别真假黄金。【小结】前两种方法利用的是金属物理性质,后一种方法利用的是金属的化学性质。【过渡】要想更好的使用金属,就需要了解金属的各种性质。上节课我们学习了金属的物理性质,本节课我们来学习金属的化学性质。【板书】金属的化学性质 学生思考后回答:①通过测密度;②测硬度,③用火烧(“真金不怕火炼”),变黑的为黄铜,不变色的为黄金…… 问题导思,激发学生的学习兴趣。培养理论联系实际的能力。防止以后上当受骗,加强防范意识
探究活动一: 金属与氧气反应 【展示】 把被空气中的氧气氧化了的镁条和铝片,与用砂纸打磨后的镁条与铝片相比较。【提问】是谁给纯净的镁条和铝片穿上了“外衣”呢?【点拨】为什么铝条在打磨前后前后颜色会有变化?在打磨后铝片能接触到什么物质而发生反应?【板书】一、金属与氧气反应。【提问】铁丝和铜丝在常温下会与氧气反应吗?让学生观察打磨前和打磨后的铁丝和铜丝。【总结】在常温下,镁、铝能与氧气反应,铁、铜几乎不与氧气反应,也就是说金属与氧气反应存在难易程度的区别。【提问】在常温下,金属和氧气的反应难易程度不同,那在高温下,镁、铁、铝、铜和氧气反应又有什么不同呢?知识回顾:(1)镁条在空气中燃烧(2)铁丝在空气中和在纯氧中燃烧。实验探究铝丝和铜丝分别在空气中和在纯氧中燃烧。【总结】在高温下,金属与氧气反应剧烈程度也不同,反应剧烈程度由大到小:镁,铝,铁,铜。 学生观察到打磨后的镁条、铝片比打磨前光亮,但过一段时间后,颜色又变暗了。在老师的点拨下学生明白,镁条和铝片是和空气中的氧气发生了反应,导致颜色变暗。2Mg+O2==2MgO4Al+3O2==2Al2O3学生观察打磨前、后的铁丝和铜丝一样光亮。得出结论:铁丝和铜丝在常温下几乎不与氧气反应。学生回顾:(1)镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体。(2)铁丝在空气中只是发红。但在氧气中能剧烈燃烧,火星四射,生成黑色固体。3Fe+2O2Fe3O42Mg + O2 2MgO学生观察实验:铝丝在空气中点燃铝条变软,不能燃烧,但在氧气中也能剧烈燃烧,发出白光。铜丝在空气中和氧气中都不能燃烧,但加热后,铜丝变黑。2Cu + O22CuO4Al + 3O2 2 Al2O3 培养观察技能,让学生在观察与讨论中发现问题、提出问题、解决问题,从中培养科学的观察、规范表达和综合分析问题的能力。 培养对比能力,证明镁、铝较活泼,铁、铜次之,金最不活泼。
设问 小结 【提问】“真金不怕火炼”说明了什么?【总结】实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。如镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应。在高温时大多金属都能与氧气反应,但剧烈程度不同。“真金不怕火炼”说明金即使在高温时也不与氧气反应,根据上述事实,我们可判断出这些金属的活泼程度,即金属活动性。【板书】金属的活动性顺序:Mg>Al>Fe>Cu>Au 学生讨论得出:金那怕在高温下也不与氧气反应。 金属的活动性顺序: Mg>Al>Fe>Cu>Au 通过对比突破难点,并为金属活动性顺序做铺垫。
理论联系实际 【思考】铝的化学性质比铁活泼,为什么我们通常看见铁生锈而没有看到铝生锈?在清洗铝制品时应注意些什么? 学生思考,看书后得出答案:铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。清洁时不要破坏铝制品表面的保护膜。 联系生活,从学生熟悉的生活经验出发,问题导思,激发兴趣,培养理论联系实际、和综合分析问题的能力。
探究活动二:金属与稀酸的反应 【设问】金属与氧气存在难易程度与剧烈程度的区别,与酸反应是否也会存在差别呢?【板书】二、金属与酸反应。活动与探究:将学生分成A、B两大组:A组:在四支试管中分别放入一小块打磨光洁的镁条、锌粒、铁片、铜片,各加入约5 mL稀盐酸,观察现象,比较反应的剧烈程度;用燃着的木条放在试管口,观察并记录实验现象。B组:用稀硫酸代替稀盐酸进行实验,并比较发生的现象。探究参考:填写表格【学生活动,请两位同学上黑板书写上述反应的化学方程式,现象由学生口述】 学生分组实验并仔细观察实验现象,记录并通过比较、分析,得出结论。A组:金属与稀盐酸的反应金属是否有气体产生,速度如何化学方程式Mg Zn Fe Cu B组:金属与稀硫酸的反应金属是否有气体产生,速度如何化学方程式Mg Zn Fe Cu 【学生板书】A组:Mg+2HCl==MgCl2+H2↑Zn+2HCl == ZnCl2+H2↑Fe+2HCl==FeCl2+ H2↑B组:Mg+H2SO4==MgSO4+H2↑Zn +H2SO4== ZnSO4+ H2↑Fe+ H2SO4==FeSO4 + H2↑回答:(1)镁、锌、铁可与盐酸或稀硫酸反应生成氢气,铜不能与盐酸或稀硫酸反应。(2)镁、锌、铁与盐酸或稀硫酸反应时的剧烈程度不同。镁反应最剧烈,其次是锌,然后是铁。(3)与酸反应时,能生成氢气的金属活动性强;否则,就较弱。(4)镁、锌、铁、铜的金属活动性由强到弱。 培养实验操作能力、观察能力、思维推理能力和同学间的合作学习,学生自己总结出金属活动性顺序,让学生既有所获,又体验了成功的快感。 获得科学探究方法:控制变量法,对比实验法
讨论 小结 【提问】1.在镁、锌、铁、铜几种金属中,哪些金属能与盐酸、稀硫酸发生反应?哪些金属不能与盐酸、稀硫酸发生反应?由此你能把金属分为哪两类?哪类金属活泼些 2.通过以上实验,你得出的结论是什么?学生讨论并回答。 学生进行讨论、交流。思考、讨论并得出结论。 结论:可分为能与盐酸、稀硫酸发生反应的金属和不能与盐酸、稀硫酸发生反应的金属这两类(2)镁、锌、铁、铜的金属活动性由强到弱依次为Mg>Zn>Fe>Cu 为后面学习金属活动顺序时,为什么会出现氢元素打下基础。
投影 [过渡]大家观察这几个化学方程式Mg+2HCl==MgCl2+H2↑Zn+H2SO4==ZnSO4+H2↑Fe+H2SO4==FeSO4+H2↑请大家从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?它与我们学过的化合反应和分解反应的特点是否相同?【引出置换反应的概念】:置换反应:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫做置换反应。A + BC →AC+B 思考,回答:这些反应的特点是: 由一种单质跟一种化合物起反应生成另一种单质和另一种化合物。其特点不同于化合反应和分解反应。 化合反应:A + B + … → AB…(多变一)分解反应:AB… →A + B + … (一变多)置换反应:A +BC →AC + B 培养学生分析问题能力和实事求是的科学态度。 使学生在交流中互相启发,相互激励,发展和完善自我
小结 ①通过本节课的学习,你知道了金属的哪些化学性质?②你还有哪些收获或疑惑不解的地方? 学生自主总结本节课的主要内容。评价自己在本节课的启示和收获。 为下节课进一步得出金属活动性顺序搭台阶
板书设计
金属的化学性质
一、 金属与氧气反应
2Mg + O22MgO 3Fe + 2O2Fe3O4
4Al + 3O22Al2O3 2Cu + O22CuO
金属的活动性顺序:Mg>Al>Fe>Cu>Au
二、金属与酸反应
Mg+2HCl==MgCl2+H2↑ Mg+H2SO4==MgSO4+H2↑
Fe+2HCl==FeCl2+ H2↑ Fe+ H2SO4==FeSO4 + H2↑
Zn+2HCl == ZnCl2+H2↑ Zn +H2SO4== ZnSO4+ H2↑
金属的活动性顺序:Mg>Zn>Fe>Cu
置换反应: A + BC → AC + B
单质 化合物 化合物 单质
7
