仁爱版初中化学九下 7.2 常见的酸和碱 课件(共16张PPT)
文档属性
| 名称 | 仁爱版初中化学九下 7.2 常见的酸和碱 课件(共16张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 404.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-15 00:00:00 | ||
图片预览





文档简介
(共16张PPT)
常见的酸和碱
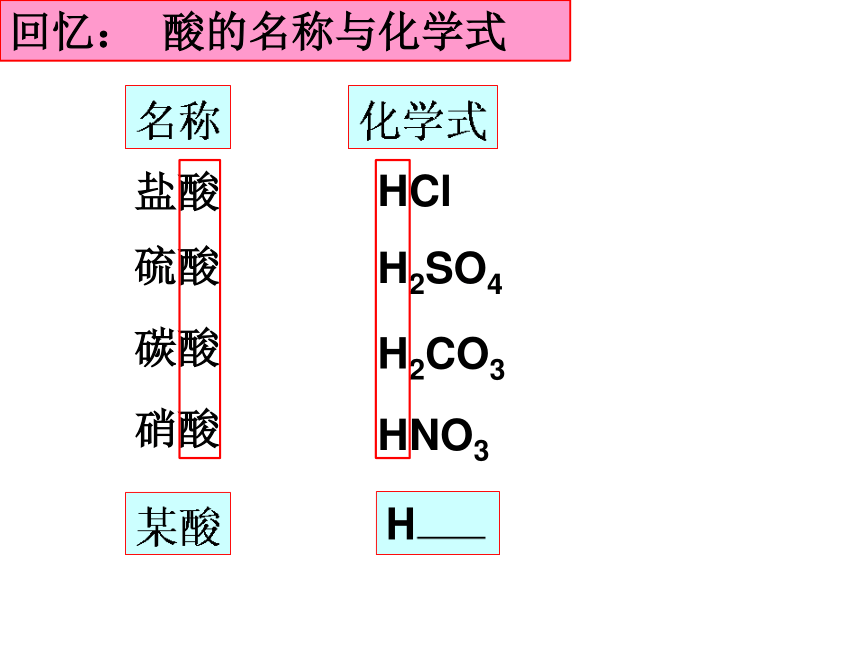
回忆: 酸的名称与化学式
盐酸
硫酸
碳酸
硝酸
HCl
H2SO4
H2CO3
HNO3
1、有三瓶未贴标签的稀盐酸、稀硫酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出酸的溶液?
2、你提出的这些方案的依据什么?
你的方案一:用紫色石蕊溶液
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
紫色石蕊溶液变红色
紫色石蕊溶液变红色
无色酚酞溶液不变色
无色酚酞溶液不变色
依据:紫色石蕊遇酸性溶液变红色
结论:酸能与指示剂反应
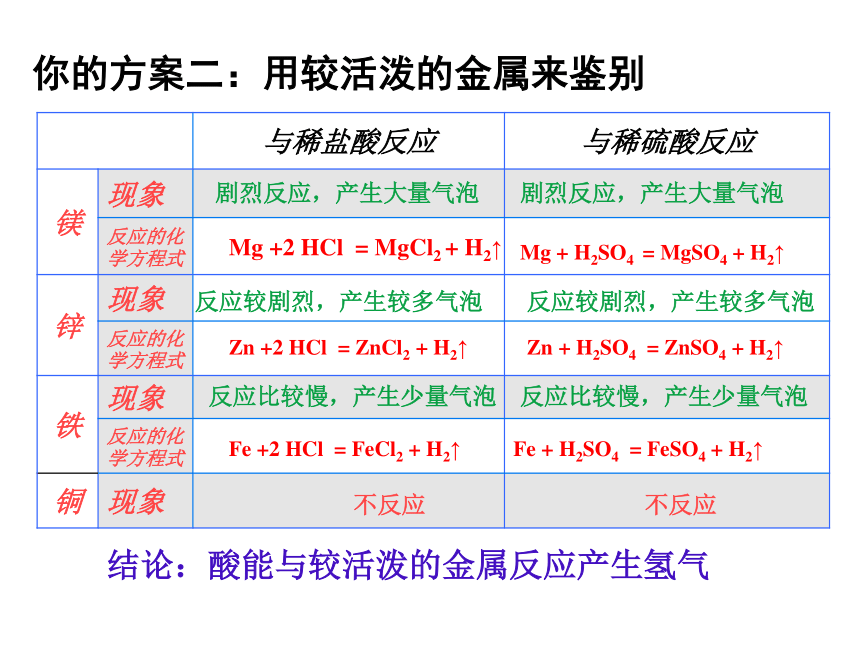
你的方案二:用较活泼的金属来鉴别
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
结论:酸能与较活泼的金属反应产生氢气
不反应
不反应
剧烈反应,产生大量气泡
剧烈反应,产生大量气泡
反应较剧烈,产生较多气泡
反应比较慢,产生少量气泡
反应比较慢,产生少量气泡
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
反应较剧烈,产生较多气泡
写出铝与盐酸和稀硫酸反应的方程式
我能写
你还知道方案三吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
⒊ 酸溶液能与金属氧化物反应:
现 象 化学方程式
铁锈+盐酸 铁锈逐渐消失,溶液由无色变为黄色 。 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+硫酸 铁锈逐渐消失,溶液由无色变为黄色 。 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:
课本P54
⒊ 酸溶液能与金属氧化物反应:
Fe2O3 + 6HCl=2 FeCl3 +3H2O
Fe2O3 +3 H2SO4= Fe2 (SO4) 3 +3H2 O
思考:除去铁锈时能否将铁制品长时间浸在酸中,为什么?
不能长时间浸在酸中,因为酸会继续反应,造成金属制品的腐蚀
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式,并回答方案三的内容及酸的性质。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
结论:酸能与金属氧化物反应有水生成
酸具有的一些相似性质:
(1)能使酸碱指示剂显示不同的颜色
(2)能与多种活泼金属反应,生成 和氢气 Zn + 2HCl = ZnCl2 + H2↑
(3)酸能与某些金属氧化物反应,生成
和水
Fe2O3 + 6HCl = 2FeCl3 + H2O↑
溶液的颜色
含Fe3+的溶液是黄色
含Fe2+的溶液是浅绿色
含Cu2+的溶液蓝色
小试身手(我会选择)
1、 下列物质放入或通入水中能使紫色石蕊试液变红的是( )
A. Cu(OH)2 B. NaOH
C. CO2 D . NaCl
2、 下列金属与盐酸反应,剧烈程度排列顺序正确的是( )
A. Fe Al Mg Zn B. Mg Al Zn Fe
C. Mg Fe Al Zn D. Zn Fe Mg Al
C
B
3、某无色溶液滴加紫色石蕊试溶液变为红色,则不可能是( )
A. HCl B. H2SO4
C. Na Cl D. CH3COOH
不能用金属和酸直接反应得到的物质是( )
A. MgCl2 B. FeCl3
C. ZnSO4 D. FeCl2
C
B
我会填空
5、MgO与稀盐酸反应的化学方程式:
Al2O3与稀盐酸反应的化学方程式:
Mg+2HCl=MgCl2+H2O
Al2O3+6HCl=2AlCl3+3H2O
6、 盐酸是氯化氢气体溶于水形成的,打开盛有浓盐酸的瓶盖,可看到瓶口有 ,说明盐酸具有 性,把浓盐酸敞口放在空气中,质量会 ,浓硫酸敞口放在空气中质量会 ,这是因为浓硫酸具有 性,溶液的质量分数会 。
白雾
挥发
减少
增加
吸水
减小
盘点收获
酸的化学性质
1、酸与指示剂的作用
紫色石蕊溶液遇酸溶液变红
无色酚酞溶液遇酸溶液不变色
2、活泼金属+酸→盐+氢气
3、金属氧化物+酸→盐+水
常见的酸和碱
回忆: 酸的名称与化学式
盐酸
硫酸
碳酸
硝酸
HCl
H2SO4
H2CO3
HNO3
1、有三瓶未贴标签的稀盐酸、稀硫酸和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出酸的溶液?
2、你提出的这些方案的依据什么?
你的方案一:用紫色石蕊溶液
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
紫色石蕊溶液变红色
紫色石蕊溶液变红色
无色酚酞溶液不变色
无色酚酞溶液不变色
依据:紫色石蕊遇酸性溶液变红色
结论:酸能与指示剂反应
你的方案二:用较活泼的金属来鉴别
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
结论:酸能与较活泼的金属反应产生氢气
不反应
不反应
剧烈反应,产生大量气泡
剧烈反应,产生大量气泡
反应较剧烈,产生较多气泡
反应比较慢,产生少量气泡
反应比较慢,产生少量气泡
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
反应较剧烈,产生较多气泡
写出铝与盐酸和稀硫酸反应的方程式
我能写
你还知道方案三吗?
2Al + 6HCl = 2AlCl3 + 3H2 ↑
2Al + 3H2SO4 = Al2(SO4 )3+ 3H2↑
⒊ 酸溶液能与金属氧化物反应:
现 象 化学方程式
铁锈+盐酸 铁锈逐渐消失,溶液由无色变为黄色 。 Fe2O3+6HCl=2FeCl3+3H2O
铁锈+硫酸 铁锈逐渐消失,溶液由无色变为黄色 。 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:
课本P54
⒊ 酸溶液能与金属氧化物反应:
Fe2O3 + 6HCl=2 FeCl3 +3H2O
Fe2O3 +3 H2SO4= Fe2 (SO4) 3 +3H2 O
思考:除去铁锈时能否将铁制品长时间浸在酸中,为什么?
不能长时间浸在酸中,因为酸会继续反应,造成金属制品的腐蚀
根据上面的化学方程式特点,请你写出氧化铜与盐酸或硫酸反应的化学方程式,并回答方案三的内容及酸的性质。
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
结论:酸能与金属氧化物反应有水生成
酸具有的一些相似性质:
(1)能使酸碱指示剂显示不同的颜色
(2)能与多种活泼金属反应,生成 和氢气 Zn + 2HCl = ZnCl2 + H2↑
(3)酸能与某些金属氧化物反应,生成
和水
Fe2O3 + 6HCl = 2FeCl3 + H2O↑
溶液的颜色
含Fe3+的溶液是黄色
含Fe2+的溶液是浅绿色
含Cu2+的溶液蓝色
小试身手(我会选择)
1、 下列物质放入或通入水中能使紫色石蕊试液变红的是( )
A. Cu(OH)2 B. NaOH
C. CO2 D . NaCl
2、 下列金属与盐酸反应,剧烈程度排列顺序正确的是( )
A. Fe Al Mg Zn B. Mg Al Zn Fe
C. Mg Fe Al Zn D. Zn Fe Mg Al
C
B
3、某无色溶液滴加紫色石蕊试溶液变为红色,则不可能是( )
A. HCl B. H2SO4
C. Na Cl D. CH3COOH
不能用金属和酸直接反应得到的物质是( )
A. MgCl2 B. FeCl3
C. ZnSO4 D. FeCl2
C
B
我会填空
5、MgO与稀盐酸反应的化学方程式:
Al2O3与稀盐酸反应的化学方程式:
Mg+2HCl=MgCl2+H2O
Al2O3+6HCl=2AlCl3+3H2O
6、 盐酸是氯化氢气体溶于水形成的,打开盛有浓盐酸的瓶盖,可看到瓶口有 ,说明盐酸具有 性,把浓盐酸敞口放在空气中,质量会 ,浓硫酸敞口放在空气中质量会 ,这是因为浓硫酸具有 性,溶液的质量分数会 。
白雾
挥发
减少
增加
吸水
减小
盘点收获
酸的化学性质
1、酸与指示剂的作用
紫色石蕊溶液遇酸溶液变红
无色酚酞溶液遇酸溶液不变色
2、活泼金属+酸→盐+氢气
3、金属氧化物+酸→盐+水
