第2章微粒间相互作用与物质性质随堂检测高二下学期化学鲁科版(2019)选择性必修2(含解析)
文档属性
| 名称 | 第2章微粒间相互作用与物质性质随堂检测高二下学期化学鲁科版(2019)选择性必修2(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 597.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 00:00:00 | ||
图片预览



文档简介
第2章《微粒间相互作用与物质性质》随堂检测
一、单选题
1.下列关于化学键的说法中正确的是( )
A.中既有极性键又有非极性键
B.凡是有化学键断裂的过程一定发生了化学反应
C.非金属元素之间只能形成共价化合物
D.所有盐、碱和金属氧化物中都含有离子键
2.短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是由前三种元素组成的二元化合物,s是元素Z的单质,溶液的为1.86,上述物质的转化关系如图所示。下列说法错误的是
A.简单离子半径:
B.简单氢化物水溶液的酸性:
C.同周期中第一电离能大于Y的元素有3种
D.Y、Z最高价氧化物对应的水化物中心原子的杂化方式不同
3.下列事实不能用氢键来解释的是
A.密度:冰<水 B.沸点:邻羟基苯甲醛<对羟基苯甲醛
C.稳定性:NH3>PH3 D.浓的氢氟酸溶液中存在HF和H2F
4.有机化合物M的结构简式如右图所示,其组成元素X、Y、Z、W、Q为原子序数依次增大的短周期元素。只有Y、Z、W为同周期相邻元素,Z的原子序数与Q的最外层电子数相同。下列说法正确的是
A.简单氢化物的沸点由高到低顺序为
B.含氧酸的酸性强弱顺序为
C.元素第一电离能由小到大的顺序为
D.元素X、Z、W形成的离子化合物中含有正四面体结构
5.在新型催化剂作用下,氧化可获得,反应为 。下列说法正确的是
A.该反应中反应物键能总和大于生成物键能总和
B.反应中和的总能量大于的总能量
C.上述反应过程中有极性键和非极性键的断裂和形成
D.的使用能降低该反应的焓变
6.短周期主族元素W、X、Y、Z的原子序数依次增大,基态W的原子2p轨道处于半充满状态,基态X的原子的2p能级上只有一对成对电子,基态Y的原子的最外层电子运动状态只有1种,元素Z与X同主族。下列说法错误的是
A.第一电离能:W>X>Y B.电负性:Y>W>Z
C.简单离子半径:Z>X>Y D.最简单氢化物的沸点:X>W>Z
7.碳原子的杂化轨道中s成分的含量越多,则该碳原子形成的键键长会短一些。下列化合物中,编号所指三根键的键长正确的顺序是
A.①>②>③ B.①>③>② C.②>③>① D.②>①>③
8.某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述错误的是
A.第一电离能:Z>Q>W
B.简单离子半径:Z>Q>W
C.该化合物中Z和Y原子的杂化方式都相同
D.Y的氢化物的沸点可能大于Q的氢化物的沸点
9.下列说法正确的是
A.极性溶质一定易溶于极性溶剂,非极性溶质一定易溶于非极性溶剂
B.和均是极性分子,是非极性分子,所以难溶于而易溶于
C.和白磷均是非极性分子,是极性分子,所以白磷难溶于而易溶于
D.是极性分子,可溶于,因此是极性分子
10.下列说法正确的是
A.硫难溶于水,微溶于酒精,易溶于CS2,说明极性:H2O>C2H5OH>CS2
B.BF3、CCl4中每个原子都满足8电子稳定结构
C.分子晶体中一定存在共价键
D.I2低温下就能升华,说明碘原子间的共价键较弱
11.H2O分子中每个O原子结合2个H原子的根本原因是( )
A.共价键的方向性 B.共价键的饱和性
C.共价键的键角 D.共价键的键长
12.下列叙述不正确的是
A.HF、HCl、HBr、HI的沸点逐渐增大
B.在周期表中金属与非金属的分界处,可以找到半导体材料
C.Li、Na、K原子的电子层数依次增多
D.X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为H3X
13.下列物质中有氧离子存在的是
A.CaO B.H2O C.KClO3 D.KOH
二、填空题
14.根据所学知识填空:
(1)三原子分子常见的空间结构有__________形(如)和__________形(如)。
(2)四原子分子常见的空间结构有___________形和___________形,如甲醛()分子呈___________形,键角约为___________;氨分子呈___________形,键角为___________;需要注意的是白磷分子呈___________形,键角为___________。
(3)五原子分子最常见的空间结构为___________形,如常见的键角是___________。
15.二氧化钛、四氯化钛、钛酸钡等钛及其化合物在人们的生活中起着十分重要的作用,应用极广。回答下列问题:
(1)基态钛原子的价电子排布式为_______,基态中的核外电子有_______个空间运动状态。
(2)是一种储氢材料,可由和反应制得。
①由和构成,的空间构型是_______,B原子的杂化轨道类型是_______,中各元素的电负性大小顺序为_______。
②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是_______填元素符号。
元素 M
电离能(kJ/mol) 738
1451
7733
10540
13630
16.三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是_______,中心离子的配位数为_______。
17.回答下列问题:
(1)四种有机物的相关数据如下表:
物质
相对分子质量 72 72 114 114
熔点/°C - 129.8 - 16.8 - 56.8 97
①总结烷烃同分异构体熔点高低的规律 ___________;
②根据上述规律预测熔点___________ (填“>”或“<”)。
(2)两种无机物的相关数据如下表:
物质 (HF)n 冰
氢键形式 F—H…F O—H…O
氢键键能/kJ·mol-1 28 19
沸点/°C 20 100
(HF)n中氢键键能大于冰,但(HF)n沸点却低于冰,原因是 ___________。
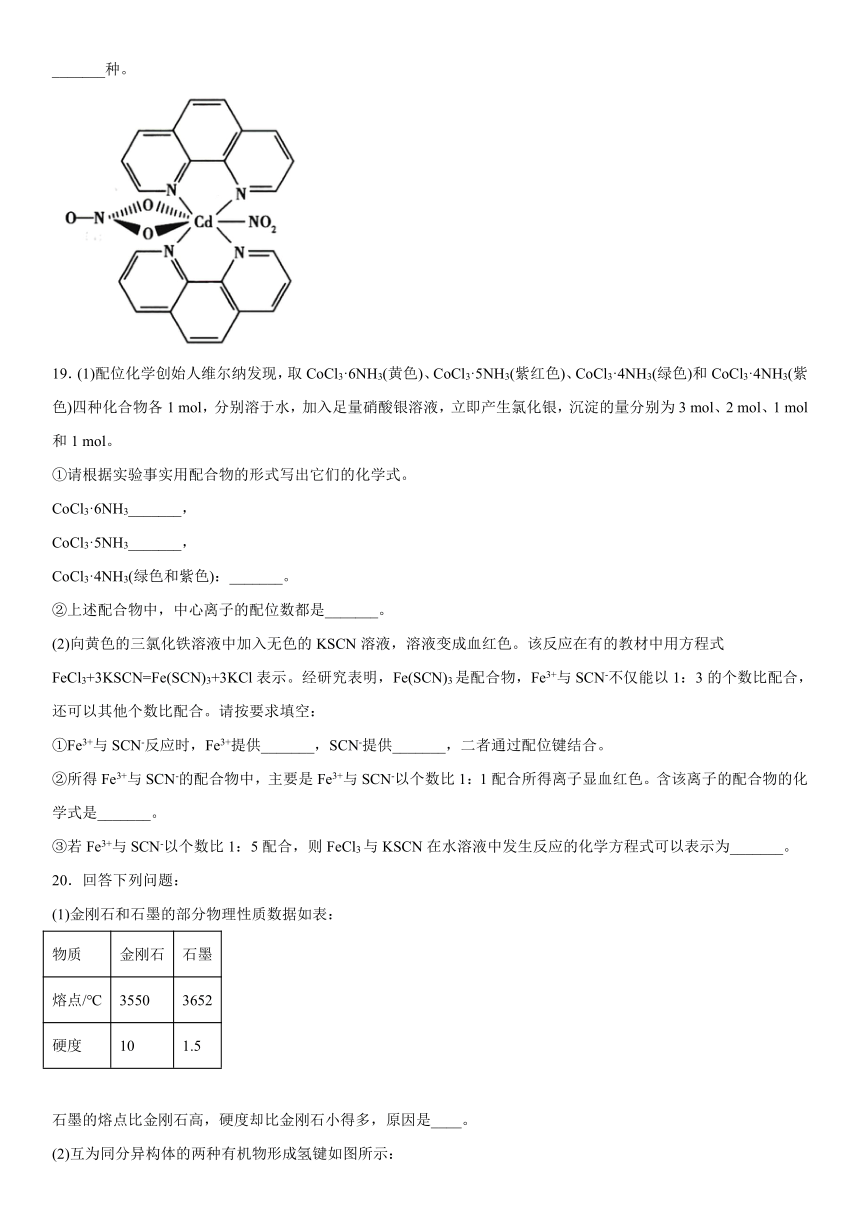
18.含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种配合物的结构如下图所示,该配合物中通过螯合作用形成的配位键有_______,该螯合物中N的杂化方式有_______种。
19.(1)配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3_______,
CoCl3·5NH3_______,
CoCl3·4NH3(绿色和紫色):_______。
②上述配合物中,中心离子的配位数都是_______。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供_______,SCN-提供_______,二者通过配位键结合。
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。含该离子的配合物的化学式是_______。
③若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_______。
20.回答下列问题:
(1)金刚石和石墨的部分物理性质数据如表:
物质 金刚石 石墨
熔点/℃ 3550 3652
硬度 10 1.5
石墨的熔点比金刚石高,硬度却比金刚石小得多,原因是____。
(2)互为同分异构体的两种有机物形成氢键如图所示:
沸点:邻羟基苯甲醛____对羟基苯甲醛(填“>”、“=”或“<”),主要原因是____。
21.元素As与N同族。预测As的氢化物分子的立体结构为___________,其沸点比NH3的___________(填“高”或“低”),其判断理由是___________。
22.峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是 PH3(膦),其结构式为 __________ ,下列有关 PH3 的说法错误的是___________ 。
a.PH3 分子是极性分子
b.PH3 分子稳定性低于 NH3 分子,因为 N-H 键键能高
c.一个 PH3 分子中,P 原子核外有一对孤电子对
d.PH3 沸点低于 NH3 沸点,因为 P-H 键键能低
(2)PH3 的沸点比 NH3______填“高”或“低”) NH3 的水溶液碱性_____PH3 的水溶液碱性(填“大于”或“小于”);氯化鏻(PH4C1)与碱反应生成膦的离子方程式为 _______________________ 。
(3)PH3 是一种还原剂,其还原能力比 NH3 强,通常情况下能从Cu2+、Ag+、Hg2+等盐溶液中还原出金属, 而本身被氧化为最高氧化态。PH3 与 CuSO4 溶液反应的化学方程式为 ______________。
(4)“荧光”产生的原理是Ca3P2 在潮湿的空气中剧烈反应,写出该反应的化学方程式__________________。
(5)PH3 有毒,白磷工厂常用 Cu2+、Pd2+液相脱除 PH3:PH3+2O2H3PO4,其他条件相同时, 溶解在溶液中O2 的体积分数与 PH3 的净化效率与时间的关系如图所示,回答下列问题:
①由图可知,富氧有利于______(选填“延长”或“缩短”)催化作用的持续时间。
②随着反应进行,PH3 的净化效率急剧降低的原因可能为 _________________ 。
23.原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。请回答下列问题:
(1)分子的空间结构为___________,分子的空间结构为___________。
(2)碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,碳原子采取sp杂化的分子是___________(写结构简式,下同),采取杂化的分子是___________,采取杂化的分子是___________。
(3)已知、、三种分子中,键角由大到小的顺序是,请分析可能的原因是___________。
参考答案:
1.A
【详解】A.中氢原子与氧原子之间形成极性键,氧原子与氧原子之间形成非极性键,A正确;
B.有化学键断裂的过程不一定发生化学反应,如熔化过程离子键断裂,B错误;
C.非金属元素之间也可形成离子化合物,如铵盐,C错误;
D.不是全部盐、碱、金属氧化物中都含有离子键,如氯化铝是共价化合物,不含离子键,D错误;
答案选A。
2.D
【分析】短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是由前三种元素组成的二元化合物,s是元素Z的单质,溶液的为1.86,说明q为二元酸,则q为硫酸;二氧化硫和双氧水反应生成硫酸,二氧化硫、水和氯气反应生成硫酸和盐酸,因此W、X、Y、Z分别为H、O、S、Cl。
【详解】A.简单离子半径:,故A正确;
B.简单氢化物水溶液的酸性:,故B正确;
C.同周期中第一电离能大于S的元素有P、Cl、Ar等3种,故C正确;
D.Y、Z最高价氧化物对应的水化物分别为硫酸和高氯酸,其中心原子价层电子对数分别为4、4,其杂化方式相同,故D错误;
综上所述,答案为D。
3.C
【详解】A.冰中分子间氢键较多,起到“支撑”作用,体积膨胀,密度:冰<水,A不符合题意,
B.邻羟基苯甲醛形成分子内氢键,分子间作用力减弱,沸点降低,对羟基苯甲醛形成分子间氢键,分子间作用力增强,沸点升高,故沸点:邻羟基苯甲醛<对羟基苯甲醛,B不符合题意;
C.N的非金属性比P强,与H形成共价键的键能比P大,N-H键较P-H难断裂,故稳定性:NH3>PH3,不能用氢键来解释,C符合题意;
D.氟化氢分子间易形成氢键,同时氢氟酸也会发生自耦电离,导致浓的氢氟酸溶液中存在HF和H2F,D不符合题意;
故选C。
4.D
【分析】Z的原子序数与Q的最外层电子数相同,说明Z为第二周期,Q为第三周期元素,依据有机物结构简式可知,元素Y形成四个键,应为C元素,则Z、W依次为N、O元素,Q则为Cl元素,X为H元素。
【详解】A.W、Q的简单氢化物依次为、HCl,其沸点由高到低顺序为,A错误;
B.Q、Y、Z对应最高价含氧酸分别为、、,满足酸性强弱顺序为,但含氧酸则不正确,如HClO酸性弱于,B错误;
C.N元素2p轨道半充满,较为稳定,元素第一电离能最大,即顺序应为,C错误;
D.元素X、Z、W形成的离子化合物中含有的为正四面体结构离子,D正确。
故选D。
5.C
【详解】A.该反应的ΔH<0,说明是放热反应,反应物的键能总和小于生成物的键能总和,A错误;
B.该反应的ΔH<0,说明反应中和的总能量大于和的总能量,B错误;
C.Cl2中含有非极性共价键,H2O中含有极性共价键,O2中含有非极性共价键,HCl中含有极性共价键,则反应有极性共价键、非极性共价键的断裂和形成,C正确;
D.RuO2是该反应的催化剂,催化剂能改变反应途径,降低反应的活化能,但不能改变反应的ΔH,D错误;
故选C。
6.B
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,基态W的原子2p轨道处于半充满状态,则W核外电子排布是1s22s22p3,W是N元素;基态X的原子的2p能级上只有一对成对电子,则X核外电子排布式是1s22s22p4,X是O元素;基态Y的原子的最外层电子运动状态只有1种,Y核外电子排布式是1s22s22p63s1,Y是Na元素,元素Z与X同主族,则Z是P元素,然后根据问题分析解答。
【详解】根据上述分析可知:W是N,X是O,Y是Na,Z是P元素。
A.非金属元素第一电离能大于金属元素;同一周期元素的第一电离能呈增大趋势,但第IIA、第VA元素处于轨道的全满、半满的稳定状态,第一电离能大于相邻元素,则这三种元素的第一电离能由大到小的顺序为:N>O>Na,即W>X>Y,选项A正确;
B.同一周期元素随原子序数的增大,元素电负性逐渐增大;同一主族元素,原子核外电子层数越多,元素电负性越小,所以电负性:N>P>Na,即W>Z>Y,选项B错误;
C.离子核外电子层数越多,离子半径越大;当离子核外电子排布相同时,离子的核电荷数越大,离子半径越小。O2-、Na+核外电子排布都是2、8,有2个电子层;P3-核外电子排布是2、8、8,有3个电子层,所以简单离子半径:P3->O2->Na+,即离子半径:Z>X>Y ,选项C正确;
D.元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:O>N>P,所以最简单氢化物的沸点:H2O>NH3>PH3,即氢化物的稳定性:X>W>Z,选项D正确;
答案选B。
7.D
【详解】由图中C原子的空间构型可知:①号C原子采用sp2杂化,②号C原子采用sp3杂化,③号C原子采用sp杂化。碳原子的杂化轨道中s成分的含量越多,即p成分越少,该碳原子的形成的C一H键键长越短,而sp杂化时p成分少,碳原子的形成的C一H键键长短,sp3杂化时p成分多,碳原子的形成的C一H键键长长,所以编号所指三根C-H键的键长正确顺序为②>①>③,故选:D。
8.C
【分析】X的原子半径是元素周期表中最小的,则X为H元素,由该化合物的结构图可知,Y为第ⅣA族元素,Q为ⅥA族元素,W为第IA族元素,又X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,则Y为C元素,Q为O元素,W为Na元素,Z为N元素,据此分析解答。
【详解】A. 同周期元素从左至右第一电离能总体呈增大趋势,但是第VA族元素的价电子处于半充满的稳定状态,较难失电子,则其第一电离能比同周期第ⅥA族元素的第一电离能大,故第第一电离能:N>O>C,故A正确;
B. N3-、O2-、Na+的核外电子排布相同,核电荷数越大,离子半径越小,则简单离子半径:N3->O2->Na+,故B正确;
C. 该化合物中N原子形成3根σ键和1对孤电子对,故其杂化方式为sp3,饱和C原子采取sp3杂化,形成双键的C原子采取sp2杂化,故C错误;
D. C的氢化物为烃,常温下,含C原子数较多的烃可以呈固态,O的氢化物为水、过氧化氢,常温下为液态,故D正确;
故选C。
9.C
【详解】A.“相似相溶”规律是经验规律,存在特殊情况,部分有机物分子是极性分子,但因为极性很弱,所以大部分难溶于水,故A不正确;
B.是非极性分子,是极性分子,是非极性分子,根据“相似相溶”,难溶于而易溶于,故B不正确;
C.和白磷均是非极性分子,是极性分子,所以白磷难溶于而易溶于,故C正确;
D.是非极性分子,溶于时,部分与反应生成,故D不正确;
答案选C。
10.A
【详解】A.硫单质为非极性分子,由硫单质的物理性质,根据相似相溶原理,可知极性:H2O>C2H5OH>CS2,故A正确;
B.BF3中B原子最外层为6电子结构,故B错误;
C.稀有气体的形成的晶体为分子晶体,不存在化学键,故C错误;
D.I2低温下就能升华,说明碘分子间的分子间作用力较弱,与共价键强弱无关,故D错误;
故选:A。
11.B
【详解】O原子最外层有6个电子,可得到2个电子形成8电子稳定结构;H原子最外层1个电子,只能形成2电子稳定结构,则每个O原子结合2个H原子与共价键的饱和性有关,答案选B。
12.A
【详解】A.氟化氢分子间能够形成氢键,分子间的作用力大于同主族其他氢化物,氟化氢的沸点最高,故A错误;
B.在金属元素和非金属元素的分界处的元素通常既具有金属性又具有非金属性,可以用来做良好的半导体材料,如硅等,故B正确;
C.Li、Na、K都为ⅠA族元素,随着核电荷数增大,原子核外的电子层数依次增多,故C正确;
D.由X元素最高价氧化物对应的水化物为HXO3可知,X元素的最高正化合价为+5价,由非金属元素的最高正化合价和负化合价的绝对值之和为8可得,X元素的负化合价为—3价,则X元素的气态氢化物为H3X,故D正确;
故选A。
13.A
【详解】A.CaO中含有离子键,为离子化合物,含有氧离子和钙离子,A正确;
B.H2O中存在O的共价键,是共价化合物,不存在氧离子,B错误;
C.KClO3中存在钾离子和氯酸根离子,有离子键,不存在氧离子,C错误;
D.KOH中存在钾离子和氢氧根离子,有离子键,不存在氧离子,D错误;
故选A。
14.(1) 直线
(2) 平面三角 三角锥 平面三角 三角锥 正四面体
(3) 四面体
【分析】中心原子价层电子对个数=σ键个数+孤电子对个数;σ键个数=配原子个数,孤电子对个数=,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;据此确定VSEPR模型,实际空间构型要去掉孤电子对。
(1)
三原子分子常见的空间结构有V形或直线形。分子中,中心原子孤电子对数、价电子对数2+0=2,则其空间构型为直线形,H2O分子中,中心原子孤电子对数=、价层电子对数=2+2=4,故空间构型为V形。
(2)
四原子分子常见的空间结构有平面三角形和三角锥形,如甲醛分子呈平面三角形,键角约为120°;氨分子呈三角锥形,键角为107°;需要注意的是白磷分子呈正四面体形形,键角为60°。
(3)
五原子分子最常见的空间结构为四面体形,如常见的呈正四面体、键角是。
15.(1) 9
(2) 正四面体形 Mg
【解析】(1)
钛原子为22号元素,其基态原子的核外电子排布式为[Ar]3d24s2,则钛原子的价电子排布式为3d24s2;Ti失去4个电子得到Ti4+,则基态Ti4+中的核外电子排布为1s22s22p63s23p6;s能级有一个原子轨道,p能级有3个原子轨道,因此Ti4+中的核外电子占据的原子轨道数为1+1+3+1+3=9,占据几个轨道就有多少种空间运动状态,则基态中的核外电子有9个空间运动状态;
(2)
①中有4个σ键,无孤电子对,的空间构性为正四面体;杂化轨道数等于价层电子对数,即中B的杂化类型为sp3;中H显-1价,B显+3价,则H的电负性大于B,Ti为金属,Ti的电负性小于B,电负性大小顺序是H>B>Ti;
②根据电离能的概念,从表中数据得知,I3>>I2,从而推出该元素最外层有2个电子,M是第三周期金属元素,因此推出M为Mg。
16. N、O、Cl 6
【详解】根据该配离子的结构可知,NH3、H2O、Cl-均为配体,其中N、O、Cl均含有孤电子对,提高孤电子对;3个NH3、2个H2O和1个Cl-配位,所以配位数为3+2+1=6。
17.(1) 分子对称性越高,熔点越高 小于
(2)冰中氢键数目比(HF)n中多
【详解】(1)①根据表格数据,同分异构体分子对称性越高,熔点越高。
②的对称性比差,分子对称性越高,熔点越高,所以熔点:小于;
(2)1molHF只能形成1mol氢键,1molH2O能形成2mol氢键,由于冰中氢键数目比(HF)n中多,所以 (HF)n沸点低于冰。
18. 6 1
【详解】由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知中的2个O原子和C、N杂环上的4个N原子通过螯合作用与形成配位键,故该配合物中通过螯合作用形成配位键;中N原子价电子对数为3+0=3,中N原子价电子对数为2+1=3,C、N杂环上的4个N原子价电子对数为3,故该配合物中N原子均采取杂化,即N的杂化方式有1种。
故答案为:6;1。
19. [Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl 6 空轨道 孤电子对 [Fe(SCN)]Cl2 FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl
【详解】(1) ①由题意知,四种络合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl。
②1mol CoCl3·6NH3只生成3mol氯化银,则有3mol氯离子为外界离子,钴的配位数为6;
1mol CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)都只生成1mol氯化银,则有1mol氯离子为外界离子,钴的配位数为6。
(2)①Fe3+与SCN-反应生成的配合物中, Fe3+提供空轨道, SCN-提供孤对电子。
②Fe3+与SCN-以个数比1 : 1配合所得离子为[Fe ( SCN)]2+ ,故FeCl3与KSCN在水溶液中反应生成[Fe ( SCN ) ]Cl2与KCl。
③国Fe3+与SCN-以个数比1 : 5配合所得高子为[Fe (SCN) 5]2-,故FeCl3与KSCN在水溶液中反应生成K2[Fe (SCN)5]2-与KCI,所以反应方程式为: FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl。
20.(1)石墨晶体中C-C的键能大于金刚石晶体中的C-C的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多
(2) < 邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键
【详解】(1)石墨晶体中C-C的键能大于金刚石晶体中的C-C的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多,故答案为:石墨晶体中C-C的键能大于金刚石晶体中的C-C的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多;
(2)分子内生成氢键,熔、沸点常降低,分子间有氢键的物质熔,熔、沸点常升高,因为邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键,则沸点:邻羟基苯甲醛<对羟基苯甲醛,故答案为:<;邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键。
21. 三角锥形 低 NH3分子间存在氢键
【详解】As的氢化物同NH3分子,中心原子sp3杂化,一对孤电子对,故为三角锥形;因NH3中存在分子间氢键,故沸点比AsH3高。
22. cd 低 大于 PH4++OH-=PH3↑+H2O 4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4 Ca3P2+6H2O=3Ca(OH)2+2PH3↑ 延长 生成的磷酸能和金属阳离子Cu2+、Pd2+反应,使催化效率降低
【分析】(1)PH3分子中P原子和每个H原子形成1个共价键,且P原子最外层还有一个孤电子对;
a.正负电荷中心不重合的分子为极性分子;
b.存在的化学键键能越大分子越稳定;
c.一个PH3分子中,P原子最外层有一对孤电子对;
d.含有氢键的氢化物熔沸点较高;
(2)因为NH3分子间存在氢键,沸点反常;因为氮的非金属性比磷的非金属性强,氮的电负性比磷的电负性强,在溶于水形成溶液时,一水合氨中的氮原子更容易吸引水中的氢离子而电离产生氢氧根使溶液碱性更强;氯化鏻(PH4C1)与碱反应生成膦的反应原理类似氯化铵与碱的反应;
(3)根据题意提示,PH3是一种还原剂, 可将Cu2+盐溶液还原生成金属铜,而本身被氧化为最高氧化态H3PO4,据此写出化学方程式;
(4)Ca3P2在潮湿的空气中剧烈反应生成氢氧化钙和PH3;
(5)①根据图知,氧气溶解分数越小,反应速率越快;
②生成的磷酸能和金属阳离子反应。
【详解】(1)PH3分子中P原子通过3个共价键与3个H原子相结合,其结构式为;
a.PH3分子是三角锥型分子,正负电荷中心不重合的分子为极性分子,故a正确;
b.P原子的原子半径大于N,形成磷氢键键能小于氮氢键键能,所以PH3分子稳定性低于 NH3分子,故b正确;
c.一个 PH3分子中,P原子核外最外层有一对孤电子对,故c错误;
d.因为NH3分子间存在氢键,所以PH3 沸点低于NH3沸点,与键能无关,故d错误;
答案为:;cd;
(2)因为NH3分子间存在氢键,所以PH3 沸点低于 NH3沸点;因为氮的非金属性比磷的非金属性强,氮的电负性比磷的电负性强,在溶于水形成溶液时,一水合氨中的氮原子更容易吸引水中的氢离子而电离产生氢氧根使溶液碱性更强,所以NH3 的水溶液碱性大于PH3的水溶液碱性;氯化鏻(PH4C1)与碱反应生成膦的反应原理类似氯化铵与碱的反应,其离子方程式为PH4++OH-=PH3↑+H2O;
综上所述,故答案为:低;大于;PH4++OH-=PH3↑+H2O;
(3)根据题意提示,PH3是一种还原剂, 可将Cu2+盐溶液还原生成金属铜, 而本身被氧化为最高氧化态H3PO4,所以PH3与 CuSO4 溶液反应的化学方程式为4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4;
故答案为:4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4;
(4)Ca3P2类似于电石(CaC2),电石与水能发生类似水解的反应生成氢氧化钙和乙炔,所以在潮湿的空气中Ca3P2与水反应反应的方程式为Ca3P2+6H2O=3Ca(OH)2+2PH3↑;
故答案为:Ca3P2+6H2O=3Ca(OH)2+2PH3↑;
(5)①由图可知,氧气的体积分数越大,PH3高净化率持续时间长,所以富氧有利于延长催化作用的持续时间;
故答案为:延长;
②由于随着反应的进行,反应生成H3PO4与催化剂Cu2+、Pd2+反应,使催化效率降低,所以PH3 的净化效率急剧降低;
故答案为:生成的磷酸能和金属阳离子Cu2+、Pd2+反应,使催化效率降低。
【点睛】氨气、PH3溶于水时,氮原子、磷原子因为具有较强电负性,并且具有一个孤电子对,会与水电离产生的氢离子形成配位键,使水更容易电离产生氢氧根,所以溶液显碱性,但因为氮元素的电负性比磷元素的电负性强,由此可以推出氨水溶液比PH3水溶液的碱性强。
23. 平面三角形 三角锥形 、 分子中的C原子上没有孤电子对,分子中N原子上有1个孤电子对,分子中O原子上有2个孤电子对,中心原子上孤电子对数越多,对成键电子对的排斥作用越大,则键角越小
【详解】(1)分子中的B原子采取杂化,所以其分子的空间结构为平面三角形;分子中的N原子采取杂化,存在一个孤电子对,所以其分子的空间结构为三角锥形,故填平面三角形、三角锥形;
(2)乙烷分子中的碳原子采取杂化,乙烯和苯分子中的碳原子均采取杂化,乙炔分子中的碳原子采取杂化,故填、和、;
(3)、、分子中的O、N、C原子均采取杂化,而在O原子上有2个孤电子对,对成键电子对的排斥作用最大,键角最小;N原子上有1个孤电子对,对成键电子对的排斥作用没有水分子的大;C原子上无孤电子对,键角最大,故填分子中的C原子上没有孤电子对,分子中N原子上有1个孤电子对,分子中O原子上有2个孤电子对,中心原子上孤电子对数越多,对成键电子对的排斥作用越大,则键角越小。
一、单选题
1.下列关于化学键的说法中正确的是( )
A.中既有极性键又有非极性键
B.凡是有化学键断裂的过程一定发生了化学反应
C.非金属元素之间只能形成共价化合物
D.所有盐、碱和金属氧化物中都含有离子键
2.短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是由前三种元素组成的二元化合物,s是元素Z的单质,溶液的为1.86,上述物质的转化关系如图所示。下列说法错误的是
A.简单离子半径:
B.简单氢化物水溶液的酸性:
C.同周期中第一电离能大于Y的元素有3种
D.Y、Z最高价氧化物对应的水化物中心原子的杂化方式不同
3.下列事实不能用氢键来解释的是
A.密度:冰<水 B.沸点:邻羟基苯甲醛<对羟基苯甲醛
C.稳定性:NH3>PH3 D.浓的氢氟酸溶液中存在HF和H2F
4.有机化合物M的结构简式如右图所示,其组成元素X、Y、Z、W、Q为原子序数依次增大的短周期元素。只有Y、Z、W为同周期相邻元素,Z的原子序数与Q的最外层电子数相同。下列说法正确的是
A.简单氢化物的沸点由高到低顺序为
B.含氧酸的酸性强弱顺序为
C.元素第一电离能由小到大的顺序为
D.元素X、Z、W形成的离子化合物中含有正四面体结构
5.在新型催化剂作用下,氧化可获得,反应为 。下列说法正确的是
A.该反应中反应物键能总和大于生成物键能总和
B.反应中和的总能量大于的总能量
C.上述反应过程中有极性键和非极性键的断裂和形成
D.的使用能降低该反应的焓变
6.短周期主族元素W、X、Y、Z的原子序数依次增大,基态W的原子2p轨道处于半充满状态,基态X的原子的2p能级上只有一对成对电子,基态Y的原子的最外层电子运动状态只有1种,元素Z与X同主族。下列说法错误的是
A.第一电离能:W>X>Y B.电负性:Y>W>Z
C.简单离子半径:Z>X>Y D.最简单氢化物的沸点:X>W>Z
7.碳原子的杂化轨道中s成分的含量越多,则该碳原子形成的键键长会短一些。下列化合物中,编号所指三根键的键长正确的顺序是
A.①>②>③ B.①>③>② C.②>③>① D.②>①>③
8.某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述错误的是
A.第一电离能:Z>Q>W
B.简单离子半径:Z>Q>W
C.该化合物中Z和Y原子的杂化方式都相同
D.Y的氢化物的沸点可能大于Q的氢化物的沸点
9.下列说法正确的是
A.极性溶质一定易溶于极性溶剂,非极性溶质一定易溶于非极性溶剂
B.和均是极性分子,是非极性分子,所以难溶于而易溶于
C.和白磷均是非极性分子,是极性分子,所以白磷难溶于而易溶于
D.是极性分子,可溶于,因此是极性分子
10.下列说法正确的是
A.硫难溶于水,微溶于酒精,易溶于CS2,说明极性:H2O>C2H5OH>CS2
B.BF3、CCl4中每个原子都满足8电子稳定结构
C.分子晶体中一定存在共价键
D.I2低温下就能升华,说明碘原子间的共价键较弱
11.H2O分子中每个O原子结合2个H原子的根本原因是( )
A.共价键的方向性 B.共价键的饱和性
C.共价键的键角 D.共价键的键长
12.下列叙述不正确的是
A.HF、HCl、HBr、HI的沸点逐渐增大
B.在周期表中金属与非金属的分界处,可以找到半导体材料
C.Li、Na、K原子的电子层数依次增多
D.X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为H3X
13.下列物质中有氧离子存在的是
A.CaO B.H2O C.KClO3 D.KOH
二、填空题
14.根据所学知识填空:
(1)三原子分子常见的空间结构有__________形(如)和__________形(如)。
(2)四原子分子常见的空间结构有___________形和___________形,如甲醛()分子呈___________形,键角约为___________;氨分子呈___________形,键角为___________;需要注意的是白磷分子呈___________形,键角为___________。
(3)五原子分子最常见的空间结构为___________形,如常见的键角是___________。
15.二氧化钛、四氯化钛、钛酸钡等钛及其化合物在人们的生活中起着十分重要的作用,应用极广。回答下列问题:
(1)基态钛原子的价电子排布式为_______,基态中的核外电子有_______个空间运动状态。
(2)是一种储氢材料,可由和反应制得。
①由和构成,的空间构型是_______,B原子的杂化轨道类型是_______,中各元素的电负性大小顺序为_______。
②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是_______填元素符号。
元素 M
电离能(kJ/mol) 738
1451
7733
10540
13630
16.三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是_______,中心离子的配位数为_______。
17.回答下列问题:
(1)四种有机物的相关数据如下表:
物质
相对分子质量 72 72 114 114
熔点/°C - 129.8 - 16.8 - 56.8 97
①总结烷烃同分异构体熔点高低的规律 ___________;
②根据上述规律预测熔点___________ (填“>”或“<”)。
(2)两种无机物的相关数据如下表:
物质 (HF)n 冰
氢键形式 F—H…F O—H…O
氢键键能/kJ·mol-1 28 19
沸点/°C 20 100
(HF)n中氢键键能大于冰,但(HF)n沸点却低于冰,原因是 ___________。
18.含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种配合物的结构如下图所示,该配合物中通过螯合作用形成的配位键有_______,该螯合物中N的杂化方式有_______种。
19.(1)配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 mol、2 mol、1 mol和1 mol。
①请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3_______,
CoCl3·5NH3_______,
CoCl3·4NH3(绿色和紫色):_______。
②上述配合物中,中心离子的配位数都是_______。
(2)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供_______,SCN-提供_______,二者通过配位键结合。
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。含该离子的配合物的化学式是_______。
③若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_______。
20.回答下列问题:
(1)金刚石和石墨的部分物理性质数据如表:
物质 金刚石 石墨
熔点/℃ 3550 3652
硬度 10 1.5
石墨的熔点比金刚石高,硬度却比金刚石小得多,原因是____。
(2)互为同分异构体的两种有机物形成氢键如图所示:
沸点:邻羟基苯甲醛____对羟基苯甲醛(填“>”、“=”或“<”),主要原因是____。
21.元素As与N同族。预测As的氢化物分子的立体结构为___________,其沸点比NH3的___________(填“高”或“低”),其判断理由是___________。
22.峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是 PH3(膦),其结构式为 __________ ,下列有关 PH3 的说法错误的是___________ 。
a.PH3 分子是极性分子
b.PH3 分子稳定性低于 NH3 分子,因为 N-H 键键能高
c.一个 PH3 分子中,P 原子核外有一对孤电子对
d.PH3 沸点低于 NH3 沸点,因为 P-H 键键能低
(2)PH3 的沸点比 NH3______填“高”或“低”) NH3 的水溶液碱性_____PH3 的水溶液碱性(填“大于”或“小于”);氯化鏻(PH4C1)与碱反应生成膦的离子方程式为 _______________________ 。
(3)PH3 是一种还原剂,其还原能力比 NH3 强,通常情况下能从Cu2+、Ag+、Hg2+等盐溶液中还原出金属, 而本身被氧化为最高氧化态。PH3 与 CuSO4 溶液反应的化学方程式为 ______________。
(4)“荧光”产生的原理是Ca3P2 在潮湿的空气中剧烈反应,写出该反应的化学方程式__________________。
(5)PH3 有毒,白磷工厂常用 Cu2+、Pd2+液相脱除 PH3:PH3+2O2H3PO4,其他条件相同时, 溶解在溶液中O2 的体积分数与 PH3 的净化效率与时间的关系如图所示,回答下列问题:
①由图可知,富氧有利于______(选填“延长”或“缩短”)催化作用的持续时间。
②随着反应进行,PH3 的净化效率急剧降低的原因可能为 _________________ 。
23.原子形成化合物时,电子云间的相互作用对物质的结构和性质会产生影响。请回答下列问题:
(1)分子的空间结构为___________,分子的空间结构为___________。
(2)碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,碳原子采取sp杂化的分子是___________(写结构简式,下同),采取杂化的分子是___________,采取杂化的分子是___________。
(3)已知、、三种分子中,键角由大到小的顺序是,请分析可能的原因是___________。
参考答案:
1.A
【详解】A.中氢原子与氧原子之间形成极性键,氧原子与氧原子之间形成非极性键,A正确;
B.有化学键断裂的过程不一定发生化学反应,如熔化过程离子键断裂,B错误;
C.非金属元素之间也可形成离子化合物,如铵盐,C错误;
D.不是全部盐、碱、金属氧化物中都含有离子键,如氯化铝是共价化合物,不含离子键,D错误;
答案选A。
2.D
【分析】短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是由前三种元素组成的二元化合物,s是元素Z的单质,溶液的为1.86,说明q为二元酸,则q为硫酸;二氧化硫和双氧水反应生成硫酸,二氧化硫、水和氯气反应生成硫酸和盐酸,因此W、X、Y、Z分别为H、O、S、Cl。
【详解】A.简单离子半径:,故A正确;
B.简单氢化物水溶液的酸性:,故B正确;
C.同周期中第一电离能大于S的元素有P、Cl、Ar等3种,故C正确;
D.Y、Z最高价氧化物对应的水化物分别为硫酸和高氯酸,其中心原子价层电子对数分别为4、4,其杂化方式相同,故D错误;
综上所述,答案为D。
3.C
【详解】A.冰中分子间氢键较多,起到“支撑”作用,体积膨胀,密度:冰<水,A不符合题意,
B.邻羟基苯甲醛形成分子内氢键,分子间作用力减弱,沸点降低,对羟基苯甲醛形成分子间氢键,分子间作用力增强,沸点升高,故沸点:邻羟基苯甲醛<对羟基苯甲醛,B不符合题意;
C.N的非金属性比P强,与H形成共价键的键能比P大,N-H键较P-H难断裂,故稳定性:NH3>PH3,不能用氢键来解释,C符合题意;
D.氟化氢分子间易形成氢键,同时氢氟酸也会发生自耦电离,导致浓的氢氟酸溶液中存在HF和H2F,D不符合题意;
故选C。
4.D
【分析】Z的原子序数与Q的最外层电子数相同,说明Z为第二周期,Q为第三周期元素,依据有机物结构简式可知,元素Y形成四个键,应为C元素,则Z、W依次为N、O元素,Q则为Cl元素,X为H元素。
【详解】A.W、Q的简单氢化物依次为、HCl,其沸点由高到低顺序为,A错误;
B.Q、Y、Z对应最高价含氧酸分别为、、,满足酸性强弱顺序为,但含氧酸则不正确,如HClO酸性弱于,B错误;
C.N元素2p轨道半充满,较为稳定,元素第一电离能最大,即顺序应为,C错误;
D.元素X、Z、W形成的离子化合物中含有的为正四面体结构离子,D正确。
故选D。
5.C
【详解】A.该反应的ΔH<0,说明是放热反应,反应物的键能总和小于生成物的键能总和,A错误;
B.该反应的ΔH<0,说明反应中和的总能量大于和的总能量,B错误;
C.Cl2中含有非极性共价键,H2O中含有极性共价键,O2中含有非极性共价键,HCl中含有极性共价键,则反应有极性共价键、非极性共价键的断裂和形成,C正确;
D.RuO2是该反应的催化剂,催化剂能改变反应途径,降低反应的活化能,但不能改变反应的ΔH,D错误;
故选C。
6.B
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,基态W的原子2p轨道处于半充满状态,则W核外电子排布是1s22s22p3,W是N元素;基态X的原子的2p能级上只有一对成对电子,则X核外电子排布式是1s22s22p4,X是O元素;基态Y的原子的最外层电子运动状态只有1种,Y核外电子排布式是1s22s22p63s1,Y是Na元素,元素Z与X同主族,则Z是P元素,然后根据问题分析解答。
【详解】根据上述分析可知:W是N,X是O,Y是Na,Z是P元素。
A.非金属元素第一电离能大于金属元素;同一周期元素的第一电离能呈增大趋势,但第IIA、第VA元素处于轨道的全满、半满的稳定状态,第一电离能大于相邻元素,则这三种元素的第一电离能由大到小的顺序为:N>O>Na,即W>X>Y,选项A正确;
B.同一周期元素随原子序数的增大,元素电负性逐渐增大;同一主族元素,原子核外电子层数越多,元素电负性越小,所以电负性:N>P>Na,即W>Z>Y,选项B错误;
C.离子核外电子层数越多,离子半径越大;当离子核外电子排布相同时,离子的核电荷数越大,离子半径越小。O2-、Na+核外电子排布都是2、8,有2个电子层;P3-核外电子排布是2、8、8,有3个电子层,所以简单离子半径:P3->O2->Na+,即离子半径:Z>X>Y ,选项C正确;
D.元素的非金属性越强,其简单氢化物的稳定性就越强。元素的非金属性:O>N>P,所以最简单氢化物的沸点:H2O>NH3>PH3,即氢化物的稳定性:X>W>Z,选项D正确;
答案选B。
7.D
【详解】由图中C原子的空间构型可知:①号C原子采用sp2杂化,②号C原子采用sp3杂化,③号C原子采用sp杂化。碳原子的杂化轨道中s成分的含量越多,即p成分越少,该碳原子的形成的C一H键键长越短,而sp杂化时p成分少,碳原子的形成的C一H键键长短,sp3杂化时p成分多,碳原子的形成的C一H键键长长,所以编号所指三根C-H键的键长正确顺序为②>①>③,故选:D。
8.C
【分析】X的原子半径是元素周期表中最小的,则X为H元素,由该化合物的结构图可知,Y为第ⅣA族元素,Q为ⅥA族元素,W为第IA族元素,又X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,则Y为C元素,Q为O元素,W为Na元素,Z为N元素,据此分析解答。
【详解】A. 同周期元素从左至右第一电离能总体呈增大趋势,但是第VA族元素的价电子处于半充满的稳定状态,较难失电子,则其第一电离能比同周期第ⅥA族元素的第一电离能大,故第第一电离能:N>O>C,故A正确;
B. N3-、O2-、Na+的核外电子排布相同,核电荷数越大,离子半径越小,则简单离子半径:N3->O2->Na+,故B正确;
C. 该化合物中N原子形成3根σ键和1对孤电子对,故其杂化方式为sp3,饱和C原子采取sp3杂化,形成双键的C原子采取sp2杂化,故C错误;
D. C的氢化物为烃,常温下,含C原子数较多的烃可以呈固态,O的氢化物为水、过氧化氢,常温下为液态,故D正确;
故选C。
9.C
【详解】A.“相似相溶”规律是经验规律,存在特殊情况,部分有机物分子是极性分子,但因为极性很弱,所以大部分难溶于水,故A不正确;
B.是非极性分子,是极性分子,是非极性分子,根据“相似相溶”,难溶于而易溶于,故B不正确;
C.和白磷均是非极性分子,是极性分子,所以白磷难溶于而易溶于,故C正确;
D.是非极性分子,溶于时,部分与反应生成,故D不正确;
答案选C。
10.A
【详解】A.硫单质为非极性分子,由硫单质的物理性质,根据相似相溶原理,可知极性:H2O>C2H5OH>CS2,故A正确;
B.BF3中B原子最外层为6电子结构,故B错误;
C.稀有气体的形成的晶体为分子晶体,不存在化学键,故C错误;
D.I2低温下就能升华,说明碘分子间的分子间作用力较弱,与共价键强弱无关,故D错误;
故选:A。
11.B
【详解】O原子最外层有6个电子,可得到2个电子形成8电子稳定结构;H原子最外层1个电子,只能形成2电子稳定结构,则每个O原子结合2个H原子与共价键的饱和性有关,答案选B。
12.A
【详解】A.氟化氢分子间能够形成氢键,分子间的作用力大于同主族其他氢化物,氟化氢的沸点最高,故A错误;
B.在金属元素和非金属元素的分界处的元素通常既具有金属性又具有非金属性,可以用来做良好的半导体材料,如硅等,故B正确;
C.Li、Na、K都为ⅠA族元素,随着核电荷数增大,原子核外的电子层数依次增多,故C正确;
D.由X元素最高价氧化物对应的水化物为HXO3可知,X元素的最高正化合价为+5价,由非金属元素的最高正化合价和负化合价的绝对值之和为8可得,X元素的负化合价为—3价,则X元素的气态氢化物为H3X,故D正确;
故选A。
13.A
【详解】A.CaO中含有离子键,为离子化合物,含有氧离子和钙离子,A正确;
B.H2O中存在O的共价键,是共价化合物,不存在氧离子,B错误;
C.KClO3中存在钾离子和氯酸根离子,有离子键,不存在氧离子,C错误;
D.KOH中存在钾离子和氢氧根离子,有离子键,不存在氧离子,D错误;
故选A。
14.(1) 直线
(2) 平面三角 三角锥 平面三角 三角锥 正四面体
(3) 四面体
【分析】中心原子价层电子对个数=σ键个数+孤电子对个数;σ键个数=配原子个数,孤电子对个数=,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;据此确定VSEPR模型,实际空间构型要去掉孤电子对。
(1)
三原子分子常见的空间结构有V形或直线形。分子中,中心原子孤电子对数、价电子对数2+0=2,则其空间构型为直线形,H2O分子中,中心原子孤电子对数=、价层电子对数=2+2=4,故空间构型为V形。
(2)
四原子分子常见的空间结构有平面三角形和三角锥形,如甲醛分子呈平面三角形,键角约为120°;氨分子呈三角锥形,键角为107°;需要注意的是白磷分子呈正四面体形形,键角为60°。
(3)
五原子分子最常见的空间结构为四面体形,如常见的呈正四面体、键角是。
15.(1) 9
(2) 正四面体形 Mg
【解析】(1)
钛原子为22号元素,其基态原子的核外电子排布式为[Ar]3d24s2,则钛原子的价电子排布式为3d24s2;Ti失去4个电子得到Ti4+,则基态Ti4+中的核外电子排布为1s22s22p63s23p6;s能级有一个原子轨道,p能级有3个原子轨道,因此Ti4+中的核外电子占据的原子轨道数为1+1+3+1+3=9,占据几个轨道就有多少种空间运动状态,则基态中的核外电子有9个空间运动状态;
(2)
①中有4个σ键,无孤电子对,的空间构性为正四面体;杂化轨道数等于价层电子对数,即中B的杂化类型为sp3;中H显-1价,B显+3价,则H的电负性大于B,Ti为金属,Ti的电负性小于B,电负性大小顺序是H>B>Ti;
②根据电离能的概念,从表中数据得知,I3>>I2,从而推出该元素最外层有2个电子,M是第三周期金属元素,因此推出M为Mg。
16. N、O、Cl 6
【详解】根据该配离子的结构可知,NH3、H2O、Cl-均为配体,其中N、O、Cl均含有孤电子对,提高孤电子对;3个NH3、2个H2O和1个Cl-配位,所以配位数为3+2+1=6。
17.(1) 分子对称性越高,熔点越高 小于
(2)冰中氢键数目比(HF)n中多
【详解】(1)①根据表格数据,同分异构体分子对称性越高,熔点越高。
②的对称性比差,分子对称性越高,熔点越高,所以熔点:小于;
(2)1molHF只能形成1mol氢键,1molH2O能形成2mol氢键,由于冰中氢键数目比(HF)n中多,所以 (HF)n沸点低于冰。
18. 6 1
【详解】由题意可知,只有成环的配位键才能起到螯合作用,再结合题给结构可知中的2个O原子和C、N杂环上的4个N原子通过螯合作用与形成配位键,故该配合物中通过螯合作用形成配位键;中N原子价电子对数为3+0=3,中N原子价电子对数为2+1=3,C、N杂环上的4个N原子价电子对数为3,故该配合物中N原子均采取杂化,即N的杂化方式有1种。
故答案为:6;1。
19. [Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl 6 空轨道 孤电子对 [Fe(SCN)]Cl2 FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl
【详解】(1) ①由题意知,四种络合物中的自由Cl-分别为3、2、1、1,则它们的化学式分别为[Co(NH3)6]Cl3、[Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl。
②1mol CoCl3·6NH3只生成3mol氯化银,则有3mol氯离子为外界离子,钴的配位数为6;
1mol CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)都只生成1mol氯化银,则有1mol氯离子为外界离子,钴的配位数为6。
(2)①Fe3+与SCN-反应生成的配合物中, Fe3+提供空轨道, SCN-提供孤对电子。
②Fe3+与SCN-以个数比1 : 1配合所得离子为[Fe ( SCN)]2+ ,故FeCl3与KSCN在水溶液中反应生成[Fe ( SCN ) ]Cl2与KCl。
③国Fe3+与SCN-以个数比1 : 5配合所得高子为[Fe (SCN) 5]2-,故FeCl3与KSCN在水溶液中反应生成K2[Fe (SCN)5]2-与KCI,所以反应方程式为: FeCl3+5KSCN===K2[Fe(SCN)5]+3KCl。
20.(1)石墨晶体中C-C的键能大于金刚石晶体中的C-C的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多
(2) < 邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键
【详解】(1)石墨晶体中C-C的键能大于金刚石晶体中的C-C的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多,故答案为:石墨晶体中C-C的键能大于金刚石晶体中的C-C的键能,石墨晶体为层状结构,层间存在分子间作用力,所以石墨的熔点比金刚石高,硬度却比金刚石小得多;
(2)分子内生成氢键,熔、沸点常降低,分子间有氢键的物质熔,熔、沸点常升高,因为邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键,则沸点:邻羟基苯甲醛<对羟基苯甲醛,故答案为:<;邻羟基苯甲醛在分子内形成了氢键,在分子间不存在氢键,对羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键。
21. 三角锥形 低 NH3分子间存在氢键
【详解】As的氢化物同NH3分子,中心原子sp3杂化,一对孤电子对,故为三角锥形;因NH3中存在分子间氢键,故沸点比AsH3高。
22. cd 低 大于 PH4++OH-=PH3↑+H2O 4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4 Ca3P2+6H2O=3Ca(OH)2+2PH3↑ 延长 生成的磷酸能和金属阳离子Cu2+、Pd2+反应,使催化效率降低
【分析】(1)PH3分子中P原子和每个H原子形成1个共价键,且P原子最外层还有一个孤电子对;
a.正负电荷中心不重合的分子为极性分子;
b.存在的化学键键能越大分子越稳定;
c.一个PH3分子中,P原子最外层有一对孤电子对;
d.含有氢键的氢化物熔沸点较高;
(2)因为NH3分子间存在氢键,沸点反常;因为氮的非金属性比磷的非金属性强,氮的电负性比磷的电负性强,在溶于水形成溶液时,一水合氨中的氮原子更容易吸引水中的氢离子而电离产生氢氧根使溶液碱性更强;氯化鏻(PH4C1)与碱反应生成膦的反应原理类似氯化铵与碱的反应;
(3)根据题意提示,PH3是一种还原剂, 可将Cu2+盐溶液还原生成金属铜,而本身被氧化为最高氧化态H3PO4,据此写出化学方程式;
(4)Ca3P2在潮湿的空气中剧烈反应生成氢氧化钙和PH3;
(5)①根据图知,氧气溶解分数越小,反应速率越快;
②生成的磷酸能和金属阳离子反应。
【详解】(1)PH3分子中P原子通过3个共价键与3个H原子相结合,其结构式为;
a.PH3分子是三角锥型分子,正负电荷中心不重合的分子为极性分子,故a正确;
b.P原子的原子半径大于N,形成磷氢键键能小于氮氢键键能,所以PH3分子稳定性低于 NH3分子,故b正确;
c.一个 PH3分子中,P原子核外最外层有一对孤电子对,故c错误;
d.因为NH3分子间存在氢键,所以PH3 沸点低于NH3沸点,与键能无关,故d错误;
答案为:;cd;
(2)因为NH3分子间存在氢键,所以PH3 沸点低于 NH3沸点;因为氮的非金属性比磷的非金属性强,氮的电负性比磷的电负性强,在溶于水形成溶液时,一水合氨中的氮原子更容易吸引水中的氢离子而电离产生氢氧根使溶液碱性更强,所以NH3 的水溶液碱性大于PH3的水溶液碱性;氯化鏻(PH4C1)与碱反应生成膦的反应原理类似氯化铵与碱的反应,其离子方程式为PH4++OH-=PH3↑+H2O;
综上所述,故答案为:低;大于;PH4++OH-=PH3↑+H2O;
(3)根据题意提示,PH3是一种还原剂, 可将Cu2+盐溶液还原生成金属铜, 而本身被氧化为最高氧化态H3PO4,所以PH3与 CuSO4 溶液反应的化学方程式为4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4;
故答案为:4CuSO4+PH3+4H2O=4Cu↓+H3PO4+4H2SO4;
(4)Ca3P2类似于电石(CaC2),电石与水能发生类似水解的反应生成氢氧化钙和乙炔,所以在潮湿的空气中Ca3P2与水反应反应的方程式为Ca3P2+6H2O=3Ca(OH)2+2PH3↑;
故答案为:Ca3P2+6H2O=3Ca(OH)2+2PH3↑;
(5)①由图可知,氧气的体积分数越大,PH3高净化率持续时间长,所以富氧有利于延长催化作用的持续时间;
故答案为:延长;
②由于随着反应的进行,反应生成H3PO4与催化剂Cu2+、Pd2+反应,使催化效率降低,所以PH3 的净化效率急剧降低;
故答案为:生成的磷酸能和金属阳离子Cu2+、Pd2+反应,使催化效率降低。
【点睛】氨气、PH3溶于水时,氮原子、磷原子因为具有较强电负性,并且具有一个孤电子对,会与水电离产生的氢离子形成配位键,使水更容易电离产生氢氧根,所以溶液显碱性,但因为氮元素的电负性比磷元素的电负性强,由此可以推出氨水溶液比PH3水溶液的碱性强。
23. 平面三角形 三角锥形 、 分子中的C原子上没有孤电子对,分子中N原子上有1个孤电子对,分子中O原子上有2个孤电子对,中心原子上孤电子对数越多,对成键电子对的排斥作用越大,则键角越小
【详解】(1)分子中的B原子采取杂化,所以其分子的空间结构为平面三角形;分子中的N原子采取杂化,存在一个孤电子对,所以其分子的空间结构为三角锥形,故填平面三角形、三角锥形;
(2)乙烷分子中的碳原子采取杂化,乙烯和苯分子中的碳原子均采取杂化,乙炔分子中的碳原子采取杂化,故填、和、;
(3)、、分子中的O、N、C原子均采取杂化,而在O原子上有2个孤电子对,对成键电子对的排斥作用最大,键角最小;N原子上有1个孤电子对,对成键电子对的排斥作用没有水分子的大;C原子上无孤电子对,键角最大,故填分子中的C原子上没有孤电子对,分子中N原子上有1个孤电子对,分子中O原子上有2个孤电子对,中心原子上孤电子对数越多,对成键电子对的排斥作用越大,则键角越小。
