第2章元素与物质世界测试题高一上学期化学鲁科版(2019)必修第一册(含答案)
文档属性
| 名称 | 第2章元素与物质世界测试题高一上学期化学鲁科版(2019)必修第一册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 409.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 09:11:15 | ||
图片预览




文档简介
第2章《元素与物质世界》测试题
一、单选题
1.下列操作能达到实验目的的是
A.用量筒量取浓硫酸
B.将饱和溶液滴入溶液,制备胶体
C.将溶液蒸发结晶获得晶体
D.将两个石墨电极插入饱和溶液,接通电源后导电,可证明是电解质
2.电解质溶液导电的能力的强弱主要由自由移动电荷的浓度的大小决定。电荷浓度越大,导电能力越强。下列物质的导电能力最强的是
A.50mL0.1mol·L-1FeCl3溶液 B.20mL0.4mol·L-1NaHCO3溶液
C.80mL0.2mol·L-1H3PO4溶液 D.100mL体积分数50%酒精水溶液
3.物质分类是化学研究的重要方法之一、化学工作者经常根据物质的组成对物质进行分类研究。近年来发现,在金星大气层中存在三氧化二碳(C2O3)。下列物质与C2O3属于同一类物质的是
A.KOH、Mg(OH)2 B.HCl、NH3
C.SO2、NO D.Na2CO3、KClO3
4.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,关于该反应下列说法正确的是
A.CuSO4既不作氧化剂,也不作还原剂
B.11 mol P被氧化时,该反应中有30 mol电子发生转移
C.还原性:CuSO4 > H3PO4
D.该反应的氧化剂和还原剂的物质的量之比是10:3
5.下列物质的分类正确的是
选项 混合物 纯净物 酸性氧化物 碱 盐
A 空气 氨水 CO2 石灰乳 KAl(SO4)2
B 豆浆 Cu SO3 烧碱 NaHCO3
C 稀硫酸 石墨 CO 氨气 CuSO4·5H2O
D 冰水混合物 生石灰 SO2 纯碱 NH4HCO3
A.A B.B C.C D.D
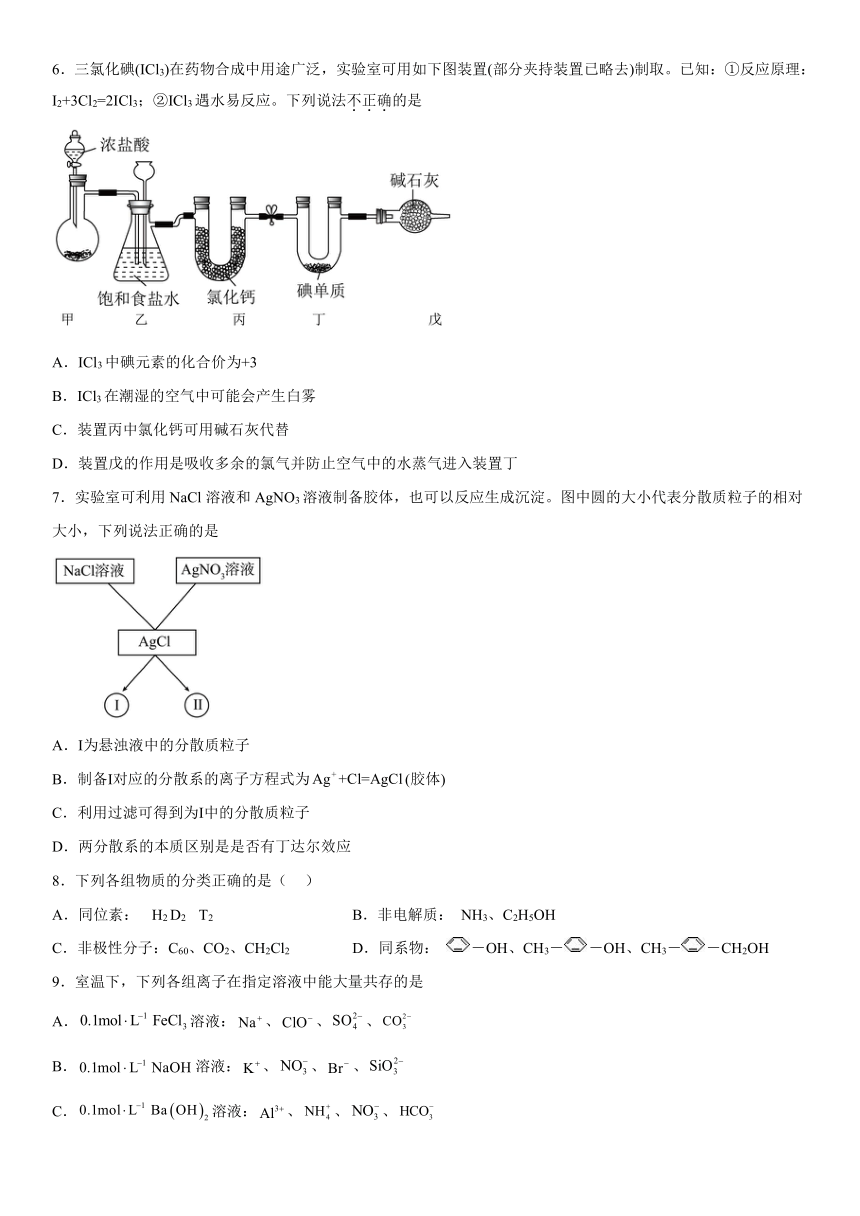
6.三氯化碘(ICl3)在药物合成中用途广泛,实验室可用如下图装置(部分夹持装置已略去)制取。已知:①反应原理:I2+3Cl2=2ICl3;②ICl3遇水易反应。下列说法不正确的是
A.ICl3中碘元素的化合价为+3
B.ICl3在潮湿的空气中可能会产生白雾
C.装置丙中氯化钙可用碱石灰代替
D.装置戊的作用是吸收多余的氯气并防止空气中的水蒸气进入装置丁
7.实验室可利用NaCl溶液和AgNO3溶液制备胶体,也可以反应生成沉淀。图中圆的大小代表分散质粒子的相对大小,下列说法正确的是
A.Ⅰ为悬浊液中的分散质粒子
B.制备Ⅰ对应的分散系的离子方程式为(胶体)
C.利用过滤可得到为Ⅰ中的分散质粒子
D.两分散系的本质区别是是否有丁达尔效应
8.下列各组物质的分类正确的是( )
A.同位素: H2 D2 T2 B.非电解质: NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2 D.同系物: -OH、CH3--OH、CH3--CH2OH
9.室温下,下列各组离子在指定溶液中能大量共存的是
A.溶液:、、、
B.溶液:、、、
C.溶液:、、、
D.溶液:、、、
10.下列离子方程式中,正确的是
A.石灰乳与盐酸反应:
B.铜和硝酸银溶液反应:
C.碳酸钠溶液与稀盐酸反应:
D.铁与盐酸反应:
11.镁元素又称“国防元素”,可用于制造汽车、飞机、火箭等,目前世界上60%的镁是从海水提取的。海水提镁的主要流程如图:
其中说法正确的是
A.上面反应涉及到四大基本反应和氧化还原反应
B.从MgCl2·6H2O到MgCl2的变化是物理变化
C.过滤需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
D.反应①的离子方程式为:Mg2++2OH-=Mg(OH)2↓
12.下列离子方程式书写正确的是
A.向明矾溶液中滴加氢氧化钡至溶液呈中性:3Ba2++6OH-+2Al3++3SO=2Al(OH)3↓+3BaSO4↓
B.向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+2H2O=4Fe3++4OH-
D.CuSO4溶液与少量的Ba(OH)2溶液:Ba2++=BaSO4↓
13.“日照澄洲江雾开,淘金女伴满江限”。这里的雾属于下列分散系中的
A.溶液 B.胶体 C.乳浊液 D.悬浊液
14.下列离子方程式书写正确的是
A.金属钠与水反应:
B.和溶液混合:
C.碳酸氢钠溶液与盐酸反应:
D.向溶液中加入过量的氨水:
15.我国科技创新成果斐然,屠呦呦因发现抗疟新药青蒿素(分子式为C15H22O5)获得诺贝尔奖。按物质的组成和性质进行分类,青蒿素属于
A.有机物 B.单质 C.氧化物 D.盐
二、填空题
16.氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)表述中没有氧化还原反应发生的是_______。
A.沙里淘金 B.蜡炬成灰 C.百炼成钢
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是_______。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C > Fe2+ D.NaNO2是还原剂
(3)宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是Ag + H2S + O2 → X +H2O。X为只含两种元素的黑色固体,它的化学式是_______,该反应的氧化剂与还原剂的质量比为_______。
(4)油画所用颜料含有某种白色铅化合物,久置于空气中就会变成黑色(PbS),从而使油画色彩变暗。若用H2O2来“清洗”,则可将PbS转变成白色的PbSO4,从而使油画的色彩“复原”。上述“清洗”反应的化学方程式为_______,其中氧化剂是_______。
17.①CO2 ②铜 ③硫酸溶液 ④Na2CO3 10H2O晶体 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦Al2(SO4)3固体 ⑧氨水 ⑨稀硝酸
(1)上述物质中属于电解质的有___________(填数字序号);能导电的是__________(填数字序号)
(2)将⑥的溶液滴加到⑤的溶液中至SO42-恰好完全沉淀时的离子方程式为_________________。
(3)写出NaHSO4溶液和NaHCO3溶液反应的离子方程式:______________________。
18.(1)在___________里或___________下能够导电的化合物叫做电解质。电解质溶液之所以能导电是由于电解质在溶液中发生了___________,产生了___________。
(2)氧化还原反应中,元素化合价升高,表明该元素原子___________电子,发生___________反应,这种物质是___________。
19.
(1)写出下列物质在水溶液中的电离方程式:
①Al2(SO4)3:_______;
②NaOH:_______;
③MgCl2:_______;
④NH4NO3:_______。
(2)下列物质:①铜 ②纯碱 ③Ba(OH)2 固体 ④硫酸氢钠固体 ⑤盐酸溶液 ⑥ 酒精 ⑦熔融的NaCl ⑧二氧化碳其中属于盐类的是________ 能导电是________属于电解质的___________ 。
20.填空。
(1)现有下列6种物质:①稀豆浆②K2CO3溶液③Cl2④SO2⑤稀盐酸⑥氢氧化钠。
其中属于胶体的是_______(填序号、下同),属于非电解质的是_______,属于单质的是_______,属于电解质的是_______。K2CO3的电离方程式是_______。
(2)在下列物质中,请选择正确的序号填空:①熔融的氢氧化钠②蔗糖③盐酸④金属钠⑤硫酸⑥二氧化硫气体⑦硫粉⑧石膏(CaSO4·2H2O)⑨酒精溶液
a.属于电解质的有_______。
b.属于非电解质的有_______。
c.上述状态下能导电的有_______。
d.上述状态下的电解质不能导电的有_______。
21.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________________________。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。
在酸性NaClO溶液中,HClO氧化NO生成Cl 和,其离子方程式为__________________
22.生活处处离不开化学。阅读材料,完成各题:
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式___________。
(2)病人同时患有胃溃疡,此时最宜服用___________ (填“小苏打片”或“胃舒平”),发生反应的化学方程式为___________。
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
A.酸性 B.碱性 C.氧化性 D.还原性
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是___________剂。
23.有以下12种物质,请回答下列问题:
①石墨②氧化钠③酒精④氨水⑤二氧化碳⑥碳酸氢钠⑦氢氧化钡溶液⑧硫酸氢钠⑨氯化氢⑩硫酸铝 稀硫酸 氯化银
(1)其中能导电的是___;属于电解质的是___;属于非电解质的是___。
(2)写出物质⑧溶于水的电离方程式:___。
(3)写出物质⑦和 反应的离子方程式:___。
(4)写出物质⑥和⑨在水中发生反应的离子方程式:___。
参考答案:
1.C
【详解】A.量筒能粗略量取液体体积、体积可估读到小数点后一位,A错误;
B. 将饱和溶液滴入沸水中,制备胶体,B错误;
C.氯化钠的溶解度随温度变化不大,故将溶液蒸发结晶获得晶体,C正确;
D. 将两个石墨电极插入饱和溶液,接通电源后导电,不可证明是电解质,因为二氧化碳溶于水后生成的碳酸会电离产生氢离子等可自由移动离子的, D错误;
答案选C。
2.B
【详解】相同温度下,溶液导电能力与离子浓度成正比,导电能力最强说明该溶液中离子浓度最大,FeCl3和NaHCO3是强电解质,在水溶液中完全电离,50mL0.1mol·L-1FeCl3溶液铁离子浓度为0.1mol·L-1,氯离子浓度为0.3mol·L-1,20mL0.4mol·L-1NaHCO3溶液钠离子浓度为0.4mol·L-1,碳酸氢根离子浓度约为0.4mol·L-1,所以B导电能力大于A,H3PO4是弱电解质,在水溶液中部分电离,所以氢离子浓度小于0.2mol/L,磷酸根离子浓度小于0.2mol·L-1,酒精为非电解质,50%酒精水溶液的导电能力很弱,通过以上分析知,溶液中离子浓度最大的是20mL0.4mol·L-1NaHCO3溶液,则溶液导电能力最强的是B。
3.C
【详解】根据元素组成,三氧化二碳(C2O3)由C、O两种元素组成,且其中一种元素为氧元素,符合氧化物的定义,则三氧化二碳(C2O3)属于氧化物;
A.KOH、Mg(OH)2均属于碱,与C2O3不属于同一类物质,故A不符合题意;
B.HCl、NH3均属于非金属元素的氢化物,与C2O3不属于同一类物质,故B不符合题意;
C.SO2、NO均由两种元素组成,且其中一种是氧元素,均属于氧化物,与C2O3属于同一类物质,故C符合题意;
D.Na2CO3、KClO3均为金属阳离子与酸根离子结合形成的化合物,都属于盐,与C2O3不属于同一类物质,故D不符合题意;
答案选C。
4.D
【分析】由方程式可知,反应中铜元素的化合价降低被还原,硫酸铜是反应的氧化剂,磷元素化合价即升高被氧化,又降低被还原,磷单质即是反应的氧化剂,又是还原剂,则磷化亚铜是还原产物,磷酸是反应的氧化产物。
【详解】A.由分析可知,硫酸铜是反应的氧化剂,故A错误;
B.由分析可知,磷单质被氧化生成磷酸,则11 mol磷被氧化时,反应中有55 mol电子发生转移,故B错误;
C.由分析可知,硫酸铜是反应的氧化剂,磷酸是反应的氧化产物,氧化剂和氧化产物表现氧化性,不表现还原性,氧化剂的氧化性强于氧化产物,则硫酸铜的氧化性强于磷酸,故C错误;
D.由分析可知,硫酸铜是反应的氧化剂,磷单质即是反应的氧化剂,又是还原剂,则反应的氧化剂和还原剂的物质的量之比是(15+5):6=10:3,故D正确;
故选D。
5.B
【分析】混合物是由两种或多种物质混合而成的物质;纯净物是指由一种单质或一种化合物组成的物质;酸性氧化物是一类能与碱作用只生成一种盐和水的氧化物;电解质电离时所生成的阴离子全部是氢氧根离子的化合物为碱;金属离子或铵根离子与酸根离子或非金属离子所组成的化合物为盐。
【详解】A.氨水为混合物;石灰乳为悬浊液,属于混合物,不属于碱,A错误;
B.豆浆为混合物,Cu为单质属于纯净物,SO3为酸性氧化物,烧碱为氢氧化钠属于碱,NaHCO3为盐,B正确;
C.CO为不成盐氧化物,并不属于酸性氧化物,氨气并不是碱,一水合氨为一元弱碱,C错误;
D.冰水混合物属于纯净物,纯碱为碳酸钠,属于盐类,D错误;
答案选B。
6.C
【详解】A.ICl3中Cl元素化合价为-1价,则I元素的化合价为+3价,A项正确;
B.ICl3遇水易反应,ICl3在潮湿的空气中会生成氯化氢和HIO2,生成的氯化氢气体极易溶于空气中的水蒸气形成盐酸小液滴,会产生白雾,B项正确;
C.氯气能和碱石灰反应,故不能用碱石灰代替氯化钙,C项错误;
D.戊装置中的碱石灰,可以吸收氯气和水,ICl3遇水易反应,装置戊还能防止空气中的水蒸气进入装置丁,故装置戊的作用是吸收多余的氯气并防止空气中的水蒸气进入装置丁,D项正确;
答案选C。
7.B
【详解】A.根据分散质粒子直径大小来分类,可分为溶液(分散质粒子直径小于1nm)、胶体(分散质粒子直径在1~100nm之间)和浊液(分散质粒子直径大于100 nm)。根据题意可知,图中圆的大小代表分散质粒子的相对大小,即I为胶体中的分散质粒子,II为浊液中的分散质粒子,故A错误;
B.I对应的分散系为氯化银胶体,制备I对应的分散系的离子方程式为(胶体),故B正确;
C.I对应的分散系为氯化银胶体,胶体可以通过滤纸,故不能通过过滤得到Ⅰ中的分散质粒子,故C错误;
D.两分散系的本质区别是分散质粒子直径的大小不同,故D错误;
故答案为B。
8.B
【详解】A.D2、H2、T2是由氢的同位素原子构成的氢分子,不能互为同位素,故A错误;
B.液态NH3和C2H5OH均不导电,且乙醇的水溶液也不导电,NH3的水溶液导电是因为生成NH3·H2O的缘故,则NH3和C2H5OH均为非电解质,故B正确;
C.C60是单质,是非极性分子;CO2是直线对称结构,属于非极性分子;CH2C12正负电荷中心不重合,属于极性分子,故C错误;
D.-OH和CH3--OH均为酚,再者是同系物,而CH3--CH2OH是芳香醇,与酚的结构不相似,与-OH和CH3--OH不是同系物,故D错误;
故答案为B。
9.B
【详解】A.铁离子和碳酸根离子双水解,不能大量共存,A错误;
B.四种离子在碱性条件下共存,B正确;
C.铝离子和碳酸氢根离子双水解不能共存,氢氧化钡和碳酸氢根离子反应,C错误;
D.碘离子被高锰酸根氧化,不能共存,D错误;
故选B。
10.C
【详解】A.石灰乳的溶解性较小,作反应物时写化学式,正确的离子方程式为Ca(OH)2+2H+=2H2O+Ca2+,故A错误;
B.铜和硝酸银溶液反应生成银单质和铜离子,正确的离子方程式为:Cu+2Ag+=Cu2++2Ag,故B错误;
C.碳酸钠溶液与稀盐酸反应的离子方程式为,故C正确;
D.铁与盐酸反应生成亚铁离子和氢气,正确的离子方程式为:,故D错误;
故选:C。
11.C
【分析】贝壳锻烧得到CaO、②、③反应为分解反应,CaO与水得到石灰乳为化合反应,向海水中加入石灰乳,过滤可得到氢氧化镁沉淀,再向沉淀中加入过量盐酸,得到氯化镁溶液,在HCl气流中加热蒸发即可得到氯化镁固体,最后电解熔融状态的氯化镁即可得到金属镁。
【详解】A.贝壳转化为CaO、②、③反应为分解反应,CaO转化为石灰乳为化合反应,①及与盐酸反应为复分解反应,③为氧化还原反应,没有置换反应,故A错误;
B.因为、为纯净物,故两者到的变化是一种物质变成另外一种物质,所以是化学变化,故B错误;
C.过滤需要用到的玻璃仪器有漏斗、玻璃棒、烧杯,故C正确;
D.反应①用的是石灰乳,故不可拆成离子形式,故D错误;
故选C。
12.A
【详解】A.铝离子的水解会使溶液显酸性,所以向明矾溶液中滴加氢氧化钡至溶液呈中性,即铝离子恰好完全沉淀,离子方程式应为3Ba2++6OH-+2Al3++3SO=2Al(OH)3↓+3BaSO4↓,A正确;
B.向Ca(ClO)2溶液通入过量的CO2,碳酸钙转化为碳酸氢钙,B错误;
C.FeSO4酸性溶液暴露在空气中被氧气氧化为Fe3+,离子方程式应为4Fe2++O2+4H+=4Fe3++2H2O,C错误;
D.CuSO4溶液与少量的Ba(OH)2溶液,同时生成硫酸钡沉淀和氢氧化铜沉淀,D错误;
综上所述答案为A。
13.B
【详解】日照澄洲江雾开:雾属于胶体分散系,选项B正确。
答案选B。
14.D
【详解】A.金属钠与水反应:,故A错误;
B.和溶液混合,没有按照比例拆分,因此离子方程式为:,故B错误;
C.碳酸氢钠溶液与盐酸反应,碳酸氢根不能拆:,故C错误;
D.向溶液中加入过量的氨水:,故D正确。
综上所述,答案为D。
15.A
【分析】绝大多数含碳化合物、碳氢化合物及其衍生物为有机物。
【详解】青蒿素的分子式为C15H22O5,青蒿素含有C、H、O元素,不是单质和氧化物,也不是盐,属于有机物,故选A。
16.(1)A
(2)D
(3) Ag2S 2:27
(4) 4H2O2 + PbS=PbSO4+ 4H2O H2O2
【解析】(1)
所有的燃烧都是氧化还原反应。A沙里淘金是物理变化,没有氧化还原反应发生,B蜡炬燃烧成灰和C灼烧铁后捶打炼钢都有元素化合价的升降,属于氧化还原反应,故选A。
(2)
误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+,Fe2+被氧化作还原剂,NaNO2被还原作氧化剂,A正确,D错误;维生素C解毒将Fe3+转化为Fe2+,Fe3+被还原作氧化剂,维生素C被氧化作还原剂具有还原性,B正确;还原剂的还原性比还原产物强,还原性:维生素C > Fe2+,C正确。故选D。
(3)
根据元素原子守恒、得失电子守恒,Ag + H2S + O2 → X +H2O配平补全后的反应方程式是:4Ag + 2H2S + O2 = 2Ag2S +2H2O,X是Ag2S;该反应的氧化剂是O2,还原剂是Ag,其物质的量之比为1:4,质量比为(1×32g):(4×108g)=2:27。
(4)
用H2O2来“清洗”,则可将PbS转变成白色的PbSO4,反应的化学方程式为4H2O2 + PbS=PbSO4+ 4H2O;其中H2O2的O元素从-1价降低到-2价被还原,H2O2是氧化剂。
17. ④⑤⑥⑦ ②③⑧⑨ Ba2++OH-+H++SO42-═BaSO4↓+H2O H++HCO3-=CO2↑+H2O
【分析】(1)根据电解质是化合物,包括酸、碱、盐、水、金属氧化物;金属和电解质溶液能导电,据此分析判断;
(2)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时,假设NaHSO4物质的量为1mol,则需要1mol Ba(OH)2,反应生成硫酸钡、氢氧化钠和水,据此书写反应的离子方程式;
(3)NaHSO4溶液和NaHCO3溶液反应生成二氧化碳、水,据此书写反应的离子方程式。
【详解】(1)①CO2 属于非金属氧化物,属于非电解质,不能导电;
②铜属于金属单质,既不是电解质也不是非电解质,可以导电;
③硫酸溶液属于混合物,既不是电解质也不是非电解质,是电解质的溶液,可以导电;
④NaCO3 10H2O晶体属于盐,属于电解质,不能导电;
⑤NaHSO4固体属于盐,属于电解质,不能导电;
⑥Ba(OH)2固体属于碱,属于电解质,不能导电;
⑦Al2(SO4)3固体属于盐,属于电解质,不能导电,
⑧氨水属于混合物,既不是电解质也不是非电解质,可以导电;
⑨稀硝酸属于混合物,既不是电解质也不是非电解质,可以导电,
属于电解质的有:④⑤⑥⑦,能导电的是:②③⑧⑨,故答案为④⑤⑥⑦;②③⑧⑨;
(2)将⑥的溶液滴加到⑤的溶液中至SO42-恰好沉淀为止时,假设NaHSO4物质的量为1mol,则需要1mol Ba(OH)2,反应生成硫酸钡、氢氧化钠和水,反应的离子方程式为Ba2++OH-+H++SO42-═BaSO4↓+H2O,故答案为Ba2++OH-+H++SO42-═BaSO4↓+H2O;
(3)NaHSO4溶液和NaHCO3溶液反应生成二氧化碳、水和硫酸钠,反应的离子方程式为H++HCO3-=H2O+CO2↑,故答案为H++HCO3-=H2O+CO2↑。
【点睛】本题的易错点为(3),要注意NaHSO4和NaHCO3在水中的电离方程式的区别,NaHSO4=Na++H++SO42-,NaHCO3=Na++HCO3-。
18. 水溶液 熔融状态 电离 自由移动的离子 失去 氧化 还原剂
【详解】(1)在水溶液里或熔融状态下能够导电的化合物叫做电解质;电解质溶液之所以能导电是由于电解质在溶液中发生了电离,产生了自由移动的离子。
(2)氧化还原反应的特征是元素化合价发生了变化,本质是电子发生了转移;氧化还原反应中,元素化合价升高,表明该元素原子失去电子,发生氧化反应,这种物质是还原剂。
19.(1)
(2) ②④⑦ ①⑤⑦ ②③④⑦
【详解】(1)Al2(SO4)3溶于水完全电离,;
NaOH是强碱,溶于水完全电离,;
MgCl2溶于水完全电离,;
NH4NO3溶于水完全电离,;故答案: ;;;;
(2)①铜是金属单质,能导电,既不是电解质也不是非电解质;
②纯碱为碳酸钠是盐,为电解质,不能导电;
③Ba(OH)2固体是强碱,是电解质,不能导电;
④硫酸氢钠固体是盐,是电解质,不能导电;
⑤盐酸溶液是混合物,既不是电解质也不是非电解质,能导电;
⑥酒精是非电解质,不能导电;
⑦熔融的NaCl 是盐,是电解质,能导电;
⑧二氧化碳是酸性氧化物,是非电解质,不能导电;
所以其中属于盐类的是②④⑦,能导电的是①⑤⑦,属于电解质的②③④⑦,故答案:②④⑦;①⑤⑦;②③④⑦。
20.(1) ① ④ ③ ⑥ K2CO3=2K++CO
(2) ①⑤⑧ ②⑥ ①③④ ②⑤⑥⑦⑧⑨
【解析】(1)
①稀豆浆属于胶体,胶体是混合物,混合物既不是电解质也不是非电解质;
②碳酸钾溶液是混合物,混合物既不是电解质也不是非电解质;
③氯气是非金属单质,单质既不是电解质也不是非电解质;
④二氧化硫不能电离出自由移动的离子,属于非电解质;
⑤稀盐酸是混合物,混合物既不是电解质也不是非电解质;
⑥氢氧化钠是碱,熔融状态或在水溶液中能电离出自由移动的离子,属于电解质;
则其中属于胶体的是①、属于非电解质的是④、属于单质的是③、属于电解质的是⑥,碳酸钾是电解质,在溶液中能电离出钾离子和碳酸根离子,电离方程式为K2CO3=2K++CO,故答案为:①;④;③;⑥;K2CO3=2K++CO;
(2)
①熔融的氢氧化钠能电离出自由移动的离子,属于电解质,能导电;
②蔗糖不能电离出自由移动的离子,属于非电解质,不能导电;
③盐酸是溶液中含有氯离子和氢离子的混合溶液,能导电,混合溶液既不是电解质也不是非电解质;
④金属钠是金属单质,能导电,单质既不是电解质也不是非电解质;
⑤硫酸是酸,在水溶液中能电离出自由移动的离子,属于电解质,硫酸中不存在自由移动的离子,不能导电;
⑥二氧化硫气体不能电离出自由移动的离子,属于非电解质,不能导电;
⑦硫粉是非金属单质,单质既不是电解质也不是非电解质,不能导电;
⑧石膏属于盐,熔融状态或在水溶液中能电离出自由移动的离子,属于电解质,石膏中不存在自由移动的离子,不能导电;
⑨酒精溶液是混合物,混合物既不是电解质也不是非电解质,溶液中不存在自由移动的离子,不能导电;
a.由分析可知,属于电解质的有①⑤⑧,故答案为:①⑤⑧;
b.由分析可知,属于非电解质的有②⑥,故答案为:②⑥;
c.由分析可知,上述状态下能导电的有①③④,故答案为:①③④;
d.由分析可知,上述状态下的电解质不能导电的有②⑤⑥⑦⑧⑨,故答案为:②⑤⑥⑦⑧⑨。
21. 2NH3+2O2N2O+3H2O 3HClO+2NO+H2O=3Cl +2+5H+
【分析】(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O和H2O。
(2)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,根据氧化还原反应原理书写离子方程式。
【详解】(1)NH3与O2在加热和催化剂作用下生成N2O和H2O,其化学方程式为2NH3+2O2N2O+3H2O;故答案为:2NH3+2O2N2O+3H2O。
(2)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,根据氧化还原反应原理写出离子方程式,其离子方程式为3HClO+2NO+H2O=3Cl-+2 NO3-+5H+;故答案为:3HClO+ 2NO + H2O=3Cl-+2 NO3-+5H+。
22.(1)NaHCO3=Na++HCO
(2) 胃舒平 Al(OH)3+3HCl=AlCl3+3H2O
(3)A
(4)还原剂
【解析】(1)
NaHCO3在水中电离出Na+、HCO,电离方程式是NaHCO3=Na++HCO;
(2)
碳酸氢钠和盐酸反应放出二氧化碳,所以病人同时患有胃溃疡,最宜服用胃舒平,氢氧化铝和盐酸反应生成氯化铝和水,反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O;
(3)
酸能使石蕊变红,将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈酸性,故选A;
(4)
服用维生素C,可使食物中的铁离子转化成亚铁离子,铁离子发生还原反应,说明具有还原性,上述反应中维生素C是还原剂。
23. ①④⑦ ②⑥⑧⑨⑩ ③⑤ NaHSO4=Na++H++SO Ba2++SO+2OH-+2H+=BaSO4↓+2H2O HCO+H+=H2O+CO2↑
【详解】(1)①石墨中有自由移动的电子,可以导电,但它是单质,不属于电解质,也不属于非电解质;
②氧化钠是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
③酒精是由分子构成的化合物,没有带电微粒,不能导电,属于非电解质;
④氨水中含有自由移动的离子,可以导电,但它是混合物,不是电解质,也不是非电解质;
⑤二氧化碳是由分子构成的化合物,没有带电微粒,不能导电,属于非电解质;
⑥碳酸氢钠是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
⑦氢氧化钡溶液中含有自由移动的离子,可以导电,但它是混合物,不属于电解质,也不属于非电解质;
⑧硫酸氢钠是离子化合物,室温下呈固体态,离子不能自由移动,不能导电,在水中在水分子作用下产生自由移动的离子,所以属于电解质;
⑨氯化氢是由分子构成的化合物,没有带电微粒,不能导电,在水中在水分子作用下产生自由移动的离子,所以属于电解质;
⑩硫酸铝是盐,是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
稀硫酸中含有自由移动的离子,能够导电,但它是混合物,不属于电解质,也不属于非电解质;
氯化银是盐,是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
故能导电的是①④⑦ ;属于电解质的是②⑥⑧⑨⑩ ;属于非电解质的是③⑤;
(2)物质⑧为硫酸氢钠,硫酸氢钠溶于水,电离产生Na+、H+、SO,电离方程式为:NaHSO4=Na+ +H++ SO;
(3)⑦氢氧化钡溶液与 稀硫酸,氢氧化钡与硫酸反应产生硫酸钡沉淀和水,反应的离子方程式为:Ba2++SO+2OH-+2H+=BaSO4↓+2H2O;
(4)⑥碳酸氢钠、⑨氯化氢,碳酸氢钠与HCl在水中发生反应,产生氯化钠、水、二氧化碳,反应的离子方程式为:HCO+H+=H2O+CO2↑。
一、单选题
1.下列操作能达到实验目的的是
A.用量筒量取浓硫酸
B.将饱和溶液滴入溶液,制备胶体
C.将溶液蒸发结晶获得晶体
D.将两个石墨电极插入饱和溶液,接通电源后导电,可证明是电解质
2.电解质溶液导电的能力的强弱主要由自由移动电荷的浓度的大小决定。电荷浓度越大,导电能力越强。下列物质的导电能力最强的是
A.50mL0.1mol·L-1FeCl3溶液 B.20mL0.4mol·L-1NaHCO3溶液
C.80mL0.2mol·L-1H3PO4溶液 D.100mL体积分数50%酒精水溶液
3.物质分类是化学研究的重要方法之一、化学工作者经常根据物质的组成对物质进行分类研究。近年来发现,在金星大气层中存在三氧化二碳(C2O3)。下列物质与C2O3属于同一类物质的是
A.KOH、Mg(OH)2 B.HCl、NH3
C.SO2、NO D.Na2CO3、KClO3
4.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,关于该反应下列说法正确的是
A.CuSO4既不作氧化剂,也不作还原剂
B.11 mol P被氧化时,该反应中有30 mol电子发生转移
C.还原性:CuSO4 > H3PO4
D.该反应的氧化剂和还原剂的物质的量之比是10:3
5.下列物质的分类正确的是
选项 混合物 纯净物 酸性氧化物 碱 盐
A 空气 氨水 CO2 石灰乳 KAl(SO4)2
B 豆浆 Cu SO3 烧碱 NaHCO3
C 稀硫酸 石墨 CO 氨气 CuSO4·5H2O
D 冰水混合物 生石灰 SO2 纯碱 NH4HCO3
A.A B.B C.C D.D
6.三氯化碘(ICl3)在药物合成中用途广泛,实验室可用如下图装置(部分夹持装置已略去)制取。已知:①反应原理:I2+3Cl2=2ICl3;②ICl3遇水易反应。下列说法不正确的是
A.ICl3中碘元素的化合价为+3
B.ICl3在潮湿的空气中可能会产生白雾
C.装置丙中氯化钙可用碱石灰代替
D.装置戊的作用是吸收多余的氯气并防止空气中的水蒸气进入装置丁
7.实验室可利用NaCl溶液和AgNO3溶液制备胶体,也可以反应生成沉淀。图中圆的大小代表分散质粒子的相对大小,下列说法正确的是
A.Ⅰ为悬浊液中的分散质粒子
B.制备Ⅰ对应的分散系的离子方程式为(胶体)
C.利用过滤可得到为Ⅰ中的分散质粒子
D.两分散系的本质区别是是否有丁达尔效应
8.下列各组物质的分类正确的是( )
A.同位素: H2 D2 T2 B.非电解质: NH3、C2H5OH
C.非极性分子:C60、CO2、CH2Cl2 D.同系物: -OH、CH3--OH、CH3--CH2OH
9.室温下,下列各组离子在指定溶液中能大量共存的是
A.溶液:、、、
B.溶液:、、、
C.溶液:、、、
D.溶液:、、、
10.下列离子方程式中,正确的是
A.石灰乳与盐酸反应:
B.铜和硝酸银溶液反应:
C.碳酸钠溶液与稀盐酸反应:
D.铁与盐酸反应:
11.镁元素又称“国防元素”,可用于制造汽车、飞机、火箭等,目前世界上60%的镁是从海水提取的。海水提镁的主要流程如图:
其中说法正确的是
A.上面反应涉及到四大基本反应和氧化还原反应
B.从MgCl2·6H2O到MgCl2的变化是物理变化
C.过滤需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
D.反应①的离子方程式为:Mg2++2OH-=Mg(OH)2↓
12.下列离子方程式书写正确的是
A.向明矾溶液中滴加氢氧化钡至溶液呈中性:3Ba2++6OH-+2Al3++3SO=2Al(OH)3↓+3BaSO4↓
B.向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+2H2O=4Fe3++4OH-
D.CuSO4溶液与少量的Ba(OH)2溶液:Ba2++=BaSO4↓
13.“日照澄洲江雾开,淘金女伴满江限”。这里的雾属于下列分散系中的
A.溶液 B.胶体 C.乳浊液 D.悬浊液
14.下列离子方程式书写正确的是
A.金属钠与水反应:
B.和溶液混合:
C.碳酸氢钠溶液与盐酸反应:
D.向溶液中加入过量的氨水:
15.我国科技创新成果斐然,屠呦呦因发现抗疟新药青蒿素(分子式为C15H22O5)获得诺贝尔奖。按物质的组成和性质进行分类,青蒿素属于
A.有机物 B.单质 C.氧化物 D.盐
二、填空题
16.氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)表述中没有氧化还原反应发生的是_______。
A.沙里淘金 B.蜡炬成灰 C.百炼成钢
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是_______。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C > Fe2+ D.NaNO2是还原剂
(3)宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是Ag + H2S + O2 → X +H2O。X为只含两种元素的黑色固体,它的化学式是_______,该反应的氧化剂与还原剂的质量比为_______。
(4)油画所用颜料含有某种白色铅化合物,久置于空气中就会变成黑色(PbS),从而使油画色彩变暗。若用H2O2来“清洗”,则可将PbS转变成白色的PbSO4,从而使油画的色彩“复原”。上述“清洗”反应的化学方程式为_______,其中氧化剂是_______。
17.①CO2 ②铜 ③硫酸溶液 ④Na2CO3 10H2O晶体 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦Al2(SO4)3固体 ⑧氨水 ⑨稀硝酸
(1)上述物质中属于电解质的有___________(填数字序号);能导电的是__________(填数字序号)
(2)将⑥的溶液滴加到⑤的溶液中至SO42-恰好完全沉淀时的离子方程式为_________________。
(3)写出NaHSO4溶液和NaHCO3溶液反应的离子方程式:______________________。
18.(1)在___________里或___________下能够导电的化合物叫做电解质。电解质溶液之所以能导电是由于电解质在溶液中发生了___________,产生了___________。
(2)氧化还原反应中,元素化合价升高,表明该元素原子___________电子,发生___________反应,这种物质是___________。
19.
(1)写出下列物质在水溶液中的电离方程式:
①Al2(SO4)3:_______;
②NaOH:_______;
③MgCl2:_______;
④NH4NO3:_______。
(2)下列物质:①铜 ②纯碱 ③Ba(OH)2 固体 ④硫酸氢钠固体 ⑤盐酸溶液 ⑥ 酒精 ⑦熔融的NaCl ⑧二氧化碳其中属于盐类的是________ 能导电是________属于电解质的___________ 。
20.填空。
(1)现有下列6种物质:①稀豆浆②K2CO3溶液③Cl2④SO2⑤稀盐酸⑥氢氧化钠。
其中属于胶体的是_______(填序号、下同),属于非电解质的是_______,属于单质的是_______,属于电解质的是_______。K2CO3的电离方程式是_______。
(2)在下列物质中,请选择正确的序号填空:①熔融的氢氧化钠②蔗糖③盐酸④金属钠⑤硫酸⑥二氧化硫气体⑦硫粉⑧石膏(CaSO4·2H2O)⑨酒精溶液
a.属于电解质的有_______。
b.属于非电解质的有_______。
c.上述状态下能导电的有_______。
d.上述状态下的电解质不能导电的有_______。
21.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________________________。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。
在酸性NaClO溶液中,HClO氧化NO生成Cl 和,其离子方程式为__________________
22.生活处处离不开化学。阅读材料,完成各题:
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式___________。
(2)病人同时患有胃溃疡,此时最宜服用___________ (填“小苏打片”或“胃舒平”),发生反应的化学方程式为___________。
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
A.酸性 B.碱性 C.氧化性 D.还原性
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是___________剂。
23.有以下12种物质,请回答下列问题:
①石墨②氧化钠③酒精④氨水⑤二氧化碳⑥碳酸氢钠⑦氢氧化钡溶液⑧硫酸氢钠⑨氯化氢⑩硫酸铝 稀硫酸 氯化银
(1)其中能导电的是___;属于电解质的是___;属于非电解质的是___。
(2)写出物质⑧溶于水的电离方程式:___。
(3)写出物质⑦和 反应的离子方程式:___。
(4)写出物质⑥和⑨在水中发生反应的离子方程式:___。
参考答案:
1.C
【详解】A.量筒能粗略量取液体体积、体积可估读到小数点后一位,A错误;
B. 将饱和溶液滴入沸水中,制备胶体,B错误;
C.氯化钠的溶解度随温度变化不大,故将溶液蒸发结晶获得晶体,C正确;
D. 将两个石墨电极插入饱和溶液,接通电源后导电,不可证明是电解质,因为二氧化碳溶于水后生成的碳酸会电离产生氢离子等可自由移动离子的, D错误;
答案选C。
2.B
【详解】相同温度下,溶液导电能力与离子浓度成正比,导电能力最强说明该溶液中离子浓度最大,FeCl3和NaHCO3是强电解质,在水溶液中完全电离,50mL0.1mol·L-1FeCl3溶液铁离子浓度为0.1mol·L-1,氯离子浓度为0.3mol·L-1,20mL0.4mol·L-1NaHCO3溶液钠离子浓度为0.4mol·L-1,碳酸氢根离子浓度约为0.4mol·L-1,所以B导电能力大于A,H3PO4是弱电解质,在水溶液中部分电离,所以氢离子浓度小于0.2mol/L,磷酸根离子浓度小于0.2mol·L-1,酒精为非电解质,50%酒精水溶液的导电能力很弱,通过以上分析知,溶液中离子浓度最大的是20mL0.4mol·L-1NaHCO3溶液,则溶液导电能力最强的是B。
3.C
【详解】根据元素组成,三氧化二碳(C2O3)由C、O两种元素组成,且其中一种元素为氧元素,符合氧化物的定义,则三氧化二碳(C2O3)属于氧化物;
A.KOH、Mg(OH)2均属于碱,与C2O3不属于同一类物质,故A不符合题意;
B.HCl、NH3均属于非金属元素的氢化物,与C2O3不属于同一类物质,故B不符合题意;
C.SO2、NO均由两种元素组成,且其中一种是氧元素,均属于氧化物,与C2O3属于同一类物质,故C符合题意;
D.Na2CO3、KClO3均为金属阳离子与酸根离子结合形成的化合物,都属于盐,与C2O3不属于同一类物质,故D不符合题意;
答案选C。
4.D
【分析】由方程式可知,反应中铜元素的化合价降低被还原,硫酸铜是反应的氧化剂,磷元素化合价即升高被氧化,又降低被还原,磷单质即是反应的氧化剂,又是还原剂,则磷化亚铜是还原产物,磷酸是反应的氧化产物。
【详解】A.由分析可知,硫酸铜是反应的氧化剂,故A错误;
B.由分析可知,磷单质被氧化生成磷酸,则11 mol磷被氧化时,反应中有55 mol电子发生转移,故B错误;
C.由分析可知,硫酸铜是反应的氧化剂,磷酸是反应的氧化产物,氧化剂和氧化产物表现氧化性,不表现还原性,氧化剂的氧化性强于氧化产物,则硫酸铜的氧化性强于磷酸,故C错误;
D.由分析可知,硫酸铜是反应的氧化剂,磷单质即是反应的氧化剂,又是还原剂,则反应的氧化剂和还原剂的物质的量之比是(15+5):6=10:3,故D正确;
故选D。
5.B
【分析】混合物是由两种或多种物质混合而成的物质;纯净物是指由一种单质或一种化合物组成的物质;酸性氧化物是一类能与碱作用只生成一种盐和水的氧化物;电解质电离时所生成的阴离子全部是氢氧根离子的化合物为碱;金属离子或铵根离子与酸根离子或非金属离子所组成的化合物为盐。
【详解】A.氨水为混合物;石灰乳为悬浊液,属于混合物,不属于碱,A错误;
B.豆浆为混合物,Cu为单质属于纯净物,SO3为酸性氧化物,烧碱为氢氧化钠属于碱,NaHCO3为盐,B正确;
C.CO为不成盐氧化物,并不属于酸性氧化物,氨气并不是碱,一水合氨为一元弱碱,C错误;
D.冰水混合物属于纯净物,纯碱为碳酸钠,属于盐类,D错误;
答案选B。
6.C
【详解】A.ICl3中Cl元素化合价为-1价,则I元素的化合价为+3价,A项正确;
B.ICl3遇水易反应,ICl3在潮湿的空气中会生成氯化氢和HIO2,生成的氯化氢气体极易溶于空气中的水蒸气形成盐酸小液滴,会产生白雾,B项正确;
C.氯气能和碱石灰反应,故不能用碱石灰代替氯化钙,C项错误;
D.戊装置中的碱石灰,可以吸收氯气和水,ICl3遇水易反应,装置戊还能防止空气中的水蒸气进入装置丁,故装置戊的作用是吸收多余的氯气并防止空气中的水蒸气进入装置丁,D项正确;
答案选C。
7.B
【详解】A.根据分散质粒子直径大小来分类,可分为溶液(分散质粒子直径小于1nm)、胶体(分散质粒子直径在1~100nm之间)和浊液(分散质粒子直径大于100 nm)。根据题意可知,图中圆的大小代表分散质粒子的相对大小,即I为胶体中的分散质粒子,II为浊液中的分散质粒子,故A错误;
B.I对应的分散系为氯化银胶体,制备I对应的分散系的离子方程式为(胶体),故B正确;
C.I对应的分散系为氯化银胶体,胶体可以通过滤纸,故不能通过过滤得到Ⅰ中的分散质粒子,故C错误;
D.两分散系的本质区别是分散质粒子直径的大小不同,故D错误;
故答案为B。
8.B
【详解】A.D2、H2、T2是由氢的同位素原子构成的氢分子,不能互为同位素,故A错误;
B.液态NH3和C2H5OH均不导电,且乙醇的水溶液也不导电,NH3的水溶液导电是因为生成NH3·H2O的缘故,则NH3和C2H5OH均为非电解质,故B正确;
C.C60是单质,是非极性分子;CO2是直线对称结构,属于非极性分子;CH2C12正负电荷中心不重合,属于极性分子,故C错误;
D.-OH和CH3--OH均为酚,再者是同系物,而CH3--CH2OH是芳香醇,与酚的结构不相似,与-OH和CH3--OH不是同系物,故D错误;
故答案为B。
9.B
【详解】A.铁离子和碳酸根离子双水解,不能大量共存,A错误;
B.四种离子在碱性条件下共存,B正确;
C.铝离子和碳酸氢根离子双水解不能共存,氢氧化钡和碳酸氢根离子反应,C错误;
D.碘离子被高锰酸根氧化,不能共存,D错误;
故选B。
10.C
【详解】A.石灰乳的溶解性较小,作反应物时写化学式,正确的离子方程式为Ca(OH)2+2H+=2H2O+Ca2+,故A错误;
B.铜和硝酸银溶液反应生成银单质和铜离子,正确的离子方程式为:Cu+2Ag+=Cu2++2Ag,故B错误;
C.碳酸钠溶液与稀盐酸反应的离子方程式为,故C正确;
D.铁与盐酸反应生成亚铁离子和氢气,正确的离子方程式为:,故D错误;
故选:C。
11.C
【分析】贝壳锻烧得到CaO、②、③反应为分解反应,CaO与水得到石灰乳为化合反应,向海水中加入石灰乳,过滤可得到氢氧化镁沉淀,再向沉淀中加入过量盐酸,得到氯化镁溶液,在HCl气流中加热蒸发即可得到氯化镁固体,最后电解熔融状态的氯化镁即可得到金属镁。
【详解】A.贝壳转化为CaO、②、③反应为分解反应,CaO转化为石灰乳为化合反应,①及与盐酸反应为复分解反应,③为氧化还原反应,没有置换反应,故A错误;
B.因为、为纯净物,故两者到的变化是一种物质变成另外一种物质,所以是化学变化,故B错误;
C.过滤需要用到的玻璃仪器有漏斗、玻璃棒、烧杯,故C正确;
D.反应①用的是石灰乳,故不可拆成离子形式,故D错误;
故选C。
12.A
【详解】A.铝离子的水解会使溶液显酸性,所以向明矾溶液中滴加氢氧化钡至溶液呈中性,即铝离子恰好完全沉淀,离子方程式应为3Ba2++6OH-+2Al3++3SO=2Al(OH)3↓+3BaSO4↓,A正确;
B.向Ca(ClO)2溶液通入过量的CO2,碳酸钙转化为碳酸氢钙,B错误;
C.FeSO4酸性溶液暴露在空气中被氧气氧化为Fe3+,离子方程式应为4Fe2++O2+4H+=4Fe3++2H2O,C错误;
D.CuSO4溶液与少量的Ba(OH)2溶液,同时生成硫酸钡沉淀和氢氧化铜沉淀,D错误;
综上所述答案为A。
13.B
【详解】日照澄洲江雾开:雾属于胶体分散系,选项B正确。
答案选B。
14.D
【详解】A.金属钠与水反应:,故A错误;
B.和溶液混合,没有按照比例拆分,因此离子方程式为:,故B错误;
C.碳酸氢钠溶液与盐酸反应,碳酸氢根不能拆:,故C错误;
D.向溶液中加入过量的氨水:,故D正确。
综上所述,答案为D。
15.A
【分析】绝大多数含碳化合物、碳氢化合物及其衍生物为有机物。
【详解】青蒿素的分子式为C15H22O5,青蒿素含有C、H、O元素,不是单质和氧化物,也不是盐,属于有机物,故选A。
16.(1)A
(2)D
(3) Ag2S 2:27
(4) 4H2O2 + PbS=PbSO4+ 4H2O H2O2
【解析】(1)
所有的燃烧都是氧化还原反应。A沙里淘金是物理变化,没有氧化还原反应发生,B蜡炬燃烧成灰和C灼烧铁后捶打炼钢都有元素化合价的升降,属于氧化还原反应,故选A。
(2)
误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+,Fe2+被氧化作还原剂,NaNO2被还原作氧化剂,A正确,D错误;维生素C解毒将Fe3+转化为Fe2+,Fe3+被还原作氧化剂,维生素C被氧化作还原剂具有还原性,B正确;还原剂的还原性比还原产物强,还原性:维生素C > Fe2+,C正确。故选D。
(3)
根据元素原子守恒、得失电子守恒,Ag + H2S + O2 → X +H2O配平补全后的反应方程式是:4Ag + 2H2S + O2 = 2Ag2S +2H2O,X是Ag2S;该反应的氧化剂是O2,还原剂是Ag,其物质的量之比为1:4,质量比为(1×32g):(4×108g)=2:27。
(4)
用H2O2来“清洗”,则可将PbS转变成白色的PbSO4,反应的化学方程式为4H2O2 + PbS=PbSO4+ 4H2O;其中H2O2的O元素从-1价降低到-2价被还原,H2O2是氧化剂。
17. ④⑤⑥⑦ ②③⑧⑨ Ba2++OH-+H++SO42-═BaSO4↓+H2O H++HCO3-=CO2↑+H2O
【分析】(1)根据电解质是化合物,包括酸、碱、盐、水、金属氧化物;金属和电解质溶液能导电,据此分析判断;
(2)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时,假设NaHSO4物质的量为1mol,则需要1mol Ba(OH)2,反应生成硫酸钡、氢氧化钠和水,据此书写反应的离子方程式;
(3)NaHSO4溶液和NaHCO3溶液反应生成二氧化碳、水,据此书写反应的离子方程式。
【详解】(1)①CO2 属于非金属氧化物,属于非电解质,不能导电;
②铜属于金属单质,既不是电解质也不是非电解质,可以导电;
③硫酸溶液属于混合物,既不是电解质也不是非电解质,是电解质的溶液,可以导电;
④NaCO3 10H2O晶体属于盐,属于电解质,不能导电;
⑤NaHSO4固体属于盐,属于电解质,不能导电;
⑥Ba(OH)2固体属于碱,属于电解质,不能导电;
⑦Al2(SO4)3固体属于盐,属于电解质,不能导电,
⑧氨水属于混合物,既不是电解质也不是非电解质,可以导电;
⑨稀硝酸属于混合物,既不是电解质也不是非电解质,可以导电,
属于电解质的有:④⑤⑥⑦,能导电的是:②③⑧⑨,故答案为④⑤⑥⑦;②③⑧⑨;
(2)将⑥的溶液滴加到⑤的溶液中至SO42-恰好沉淀为止时,假设NaHSO4物质的量为1mol,则需要1mol Ba(OH)2,反应生成硫酸钡、氢氧化钠和水,反应的离子方程式为Ba2++OH-+H++SO42-═BaSO4↓+H2O,故答案为Ba2++OH-+H++SO42-═BaSO4↓+H2O;
(3)NaHSO4溶液和NaHCO3溶液反应生成二氧化碳、水和硫酸钠,反应的离子方程式为H++HCO3-=H2O+CO2↑,故答案为H++HCO3-=H2O+CO2↑。
【点睛】本题的易错点为(3),要注意NaHSO4和NaHCO3在水中的电离方程式的区别,NaHSO4=Na++H++SO42-,NaHCO3=Na++HCO3-。
18. 水溶液 熔融状态 电离 自由移动的离子 失去 氧化 还原剂
【详解】(1)在水溶液里或熔融状态下能够导电的化合物叫做电解质;电解质溶液之所以能导电是由于电解质在溶液中发生了电离,产生了自由移动的离子。
(2)氧化还原反应的特征是元素化合价发生了变化,本质是电子发生了转移;氧化还原反应中,元素化合价升高,表明该元素原子失去电子,发生氧化反应,这种物质是还原剂。
19.(1)
(2) ②④⑦ ①⑤⑦ ②③④⑦
【详解】(1)Al2(SO4)3溶于水完全电离,;
NaOH是强碱,溶于水完全电离,;
MgCl2溶于水完全电离,;
NH4NO3溶于水完全电离,;故答案: ;;;;
(2)①铜是金属单质,能导电,既不是电解质也不是非电解质;
②纯碱为碳酸钠是盐,为电解质,不能导电;
③Ba(OH)2固体是强碱,是电解质,不能导电;
④硫酸氢钠固体是盐,是电解质,不能导电;
⑤盐酸溶液是混合物,既不是电解质也不是非电解质,能导电;
⑥酒精是非电解质,不能导电;
⑦熔融的NaCl 是盐,是电解质,能导电;
⑧二氧化碳是酸性氧化物,是非电解质,不能导电;
所以其中属于盐类的是②④⑦,能导电的是①⑤⑦,属于电解质的②③④⑦,故答案:②④⑦;①⑤⑦;②③④⑦。
20.(1) ① ④ ③ ⑥ K2CO3=2K++CO
(2) ①⑤⑧ ②⑥ ①③④ ②⑤⑥⑦⑧⑨
【解析】(1)
①稀豆浆属于胶体,胶体是混合物,混合物既不是电解质也不是非电解质;
②碳酸钾溶液是混合物,混合物既不是电解质也不是非电解质;
③氯气是非金属单质,单质既不是电解质也不是非电解质;
④二氧化硫不能电离出自由移动的离子,属于非电解质;
⑤稀盐酸是混合物,混合物既不是电解质也不是非电解质;
⑥氢氧化钠是碱,熔融状态或在水溶液中能电离出自由移动的离子,属于电解质;
则其中属于胶体的是①、属于非电解质的是④、属于单质的是③、属于电解质的是⑥,碳酸钾是电解质,在溶液中能电离出钾离子和碳酸根离子,电离方程式为K2CO3=2K++CO,故答案为:①;④;③;⑥;K2CO3=2K++CO;
(2)
①熔融的氢氧化钠能电离出自由移动的离子,属于电解质,能导电;
②蔗糖不能电离出自由移动的离子,属于非电解质,不能导电;
③盐酸是溶液中含有氯离子和氢离子的混合溶液,能导电,混合溶液既不是电解质也不是非电解质;
④金属钠是金属单质,能导电,单质既不是电解质也不是非电解质;
⑤硫酸是酸,在水溶液中能电离出自由移动的离子,属于电解质,硫酸中不存在自由移动的离子,不能导电;
⑥二氧化硫气体不能电离出自由移动的离子,属于非电解质,不能导电;
⑦硫粉是非金属单质,单质既不是电解质也不是非电解质,不能导电;
⑧石膏属于盐,熔融状态或在水溶液中能电离出自由移动的离子,属于电解质,石膏中不存在自由移动的离子,不能导电;
⑨酒精溶液是混合物,混合物既不是电解质也不是非电解质,溶液中不存在自由移动的离子,不能导电;
a.由分析可知,属于电解质的有①⑤⑧,故答案为:①⑤⑧;
b.由分析可知,属于非电解质的有②⑥,故答案为:②⑥;
c.由分析可知,上述状态下能导电的有①③④,故答案为:①③④;
d.由分析可知,上述状态下的电解质不能导电的有②⑤⑥⑦⑧⑨,故答案为:②⑤⑥⑦⑧⑨。
21. 2NH3+2O2N2O+3H2O 3HClO+2NO+H2O=3Cl +2+5H+
【分析】(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O和H2O。
(2)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,根据氧化还原反应原理书写离子方程式。
【详解】(1)NH3与O2在加热和催化剂作用下生成N2O和H2O,其化学方程式为2NH3+2O2N2O+3H2O;故答案为:2NH3+2O2N2O+3H2O。
(2)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,根据氧化还原反应原理写出离子方程式,其离子方程式为3HClO+2NO+H2O=3Cl-+2 NO3-+5H+;故答案为:3HClO+ 2NO + H2O=3Cl-+2 NO3-+5H+。
22.(1)NaHCO3=Na++HCO
(2) 胃舒平 Al(OH)3+3HCl=AlCl3+3H2O
(3)A
(4)还原剂
【解析】(1)
NaHCO3在水中电离出Na+、HCO,电离方程式是NaHCO3=Na++HCO;
(2)
碳酸氢钠和盐酸反应放出二氧化碳,所以病人同时患有胃溃疡,最宜服用胃舒平,氢氧化铝和盐酸反应生成氯化铝和水,反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O;
(3)
酸能使石蕊变红,将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈酸性,故选A;
(4)
服用维生素C,可使食物中的铁离子转化成亚铁离子,铁离子发生还原反应,说明具有还原性,上述反应中维生素C是还原剂。
23. ①④⑦ ②⑥⑧⑨⑩ ③⑤ NaHSO4=Na++H++SO Ba2++SO+2OH-+2H+=BaSO4↓+2H2O HCO+H+=H2O+CO2↑
【详解】(1)①石墨中有自由移动的电子,可以导电,但它是单质,不属于电解质,也不属于非电解质;
②氧化钠是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
③酒精是由分子构成的化合物,没有带电微粒,不能导电,属于非电解质;
④氨水中含有自由移动的离子,可以导电,但它是混合物,不是电解质,也不是非电解质;
⑤二氧化碳是由分子构成的化合物,没有带电微粒,不能导电,属于非电解质;
⑥碳酸氢钠是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
⑦氢氧化钡溶液中含有自由移动的离子,可以导电,但它是混合物,不属于电解质,也不属于非电解质;
⑧硫酸氢钠是离子化合物,室温下呈固体态,离子不能自由移动,不能导电,在水中在水分子作用下产生自由移动的离子,所以属于电解质;
⑨氯化氢是由分子构成的化合物,没有带电微粒,不能导电,在水中在水分子作用下产生自由移动的离子,所以属于电解质;
⑩硫酸铝是盐,是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
稀硫酸中含有自由移动的离子,能够导电,但它是混合物,不属于电解质,也不属于非电解质;
氯化银是盐,是离子化合物,但室温下呈固体态,离子不能自由移动,所以不能导电,在熔融状态下可以导电,属于电解质;
故能导电的是①④⑦ ;属于电解质的是②⑥⑧⑨⑩ ;属于非电解质的是③⑤;
(2)物质⑧为硫酸氢钠,硫酸氢钠溶于水,电离产生Na+、H+、SO,电离方程式为:NaHSO4=Na+ +H++ SO;
(3)⑦氢氧化钡溶液与 稀硫酸,氢氧化钡与硫酸反应产生硫酸钡沉淀和水,反应的离子方程式为:Ba2++SO+2OH-+2H+=BaSO4↓+2H2O;
(4)⑥碳酸氢钠、⑨氯化氢,碳酸氢钠与HCl在水中发生反应,产生氯化钠、水、二氧化碳,反应的离子方程式为:HCO+H+=H2O+CO2↑。
