高一化学(人教版)-第五章第二节氮及其化合物(1)第一课时氮气(66张ppt)
文档属性
| 名称 | 高一化学(人教版)-第五章第二节氮及其化合物(1)第一课时氮气(66张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 180.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 09:24:31 | ||
图片预览





文档简介
(共66张PPT)
第五章 第二节
氮及其化合物(1)
高一年级 化学
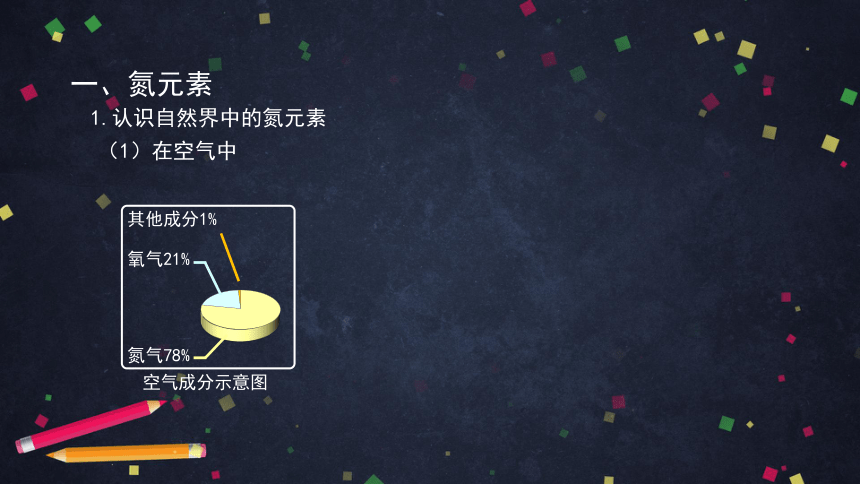
一、氮元素
1.认识自然界中的氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
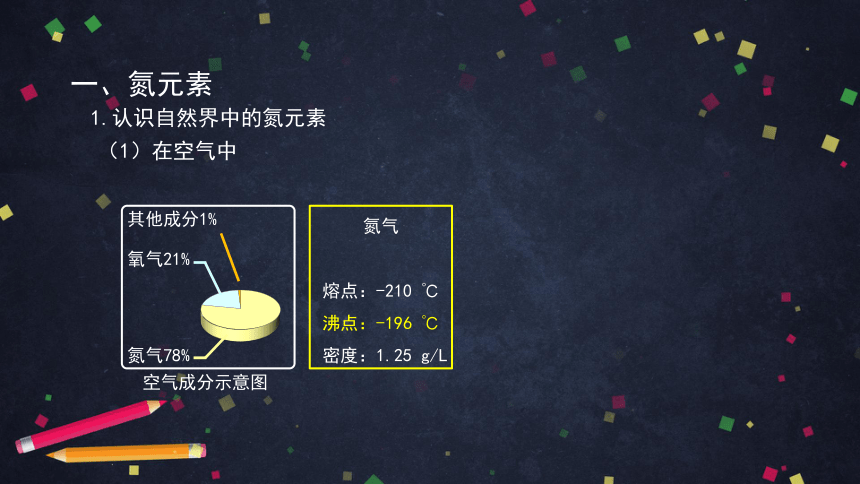
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
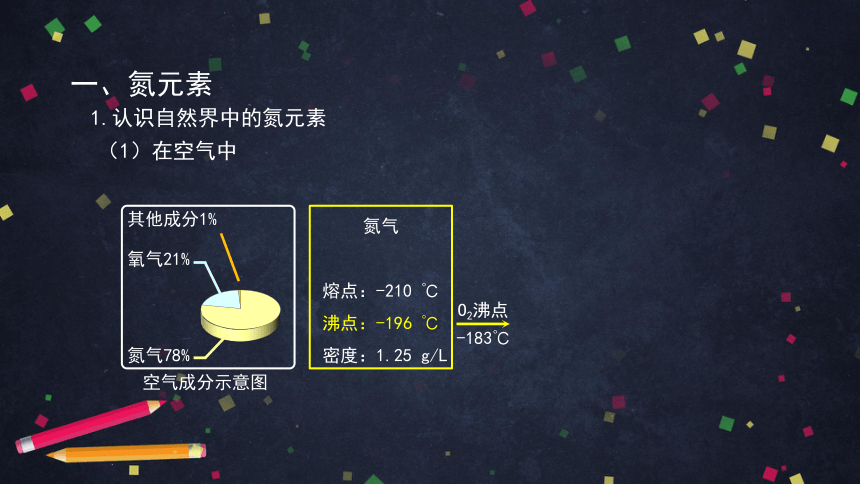
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
-183℃
O2沸点
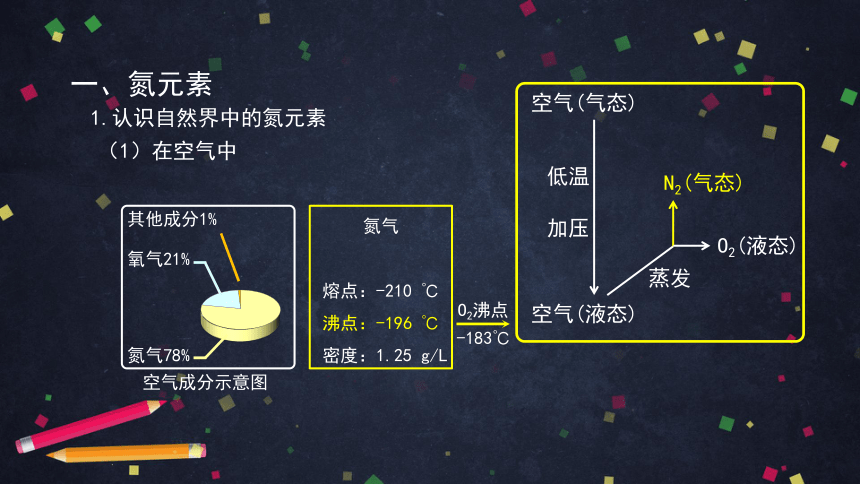
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气(气态)
空气(液态)
蒸发
低温
加压
O2(液态)
N2(气态)
-183℃
O2沸点
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
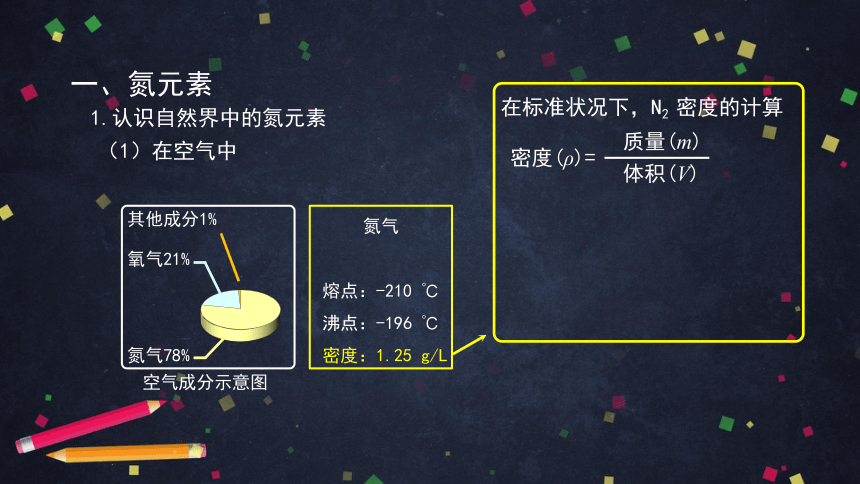
在标准状况下,N2 密度的计算
质量(m)
体积(V)
密度(ρ)=
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
在标准状况下,N2 密度的计算
密度(ρ)=
质量(m)
体积(V)
取1mol N2
密度(ρ)=
1 mol×28 g/mol
1 mol×22.4 L/mol
= 1.25 g/L
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
溶解性:难溶
一、氮元素
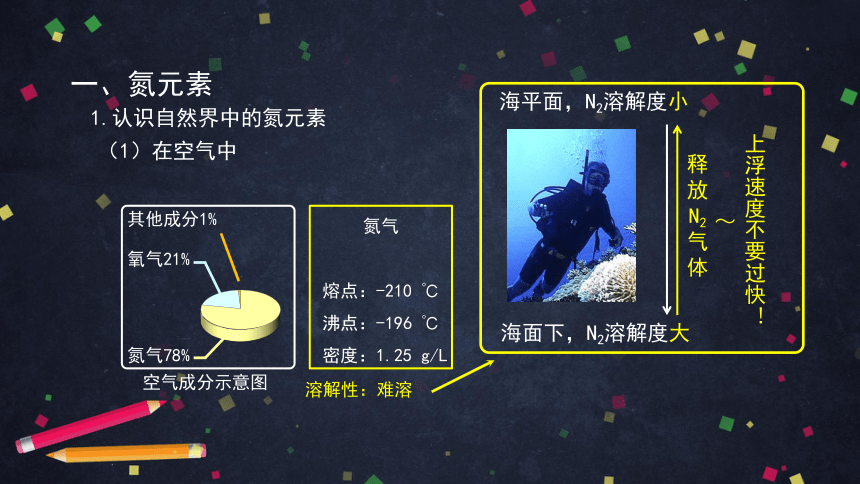
海平面,N2溶解度小
海面下,N2溶解度大
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
溶解性:难溶
一、氮元素
溶解性:难溶
海平面,N2溶解度小
海面下,N2溶解度大
释
放
N2
气
体
上浮速度不要过快!
~
(1)在空气中
氧气21%
其他成分1%
氮气78%
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
空气成分示意图
1.认识自然界中的氮元素
一、氮元素
(2)在动植物、土壤、海洋中
蛋白质
硝酸盐、铵盐
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
动物摄食
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
氨或铵盐
亚硝酸盐
硝酸盐
动物摄食
动物排泄物
及遗体
植物遗体
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
动物摄食
动物排泄物
及遗体
植物遗体
吸收
被细菌
分解
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
动物摄食
动物排泄物
及遗体
植物遗体
吸收
被细菌
分解
1.认识自然界中的氮元素
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
第二周期,第VA族
N
+7
2
5
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
第二周期,第VA族
既不容易得到3个电子,
也不容易失去5个电子
N
+7
2
5
共价键
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
第二周期,第VA族
既不容易得到3个电子,
也不容易失去5个电子
N
+7
2
5
共价键
二、氮气
1.结构
(1)电子式
(2)结构式
(3)化学键类型
二、氮气
1.结构
(1)电子式
(2)结构式
(3)化学键类型
N
N
+7
2
5
N
N
氮原子的
电子式
氮原子的
原子结构示意图
二、氮气
1.结构
(1)电子式
(2)结构式
(3)化学键类型
N
N
+7
2
5
N
N
N
N
N
N
非极性共价键
×
氮原子的
电子式
氮原子的
原子结构示意图
二、氮气
2.化学性质
(1)通常很稳定
测定空气中氧气的含量
二、氮气
2.化学性质
(1)通常很稳定
测定空气中氧气的含量
保护气
稳定
二、氮气
2.化学性质
(1)通常很稳定
测定空气中氧气的含量
保护气
稳定
在空气中点燃镁条
O2
Mg、点燃
MgO
在空气中点燃镁条
O2
N2
Mg、点燃
Mg、点燃
MgO
?
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
?
N2 + 3Mg
Mg3N2
点燃
氮化镁
+2
-3
二、氮气
2.化学性质
(2)氮气的反应
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
?
N2 + 3Mg
Mg3N2
点燃
氮化镁
+2
-3
二、氮气
2.化学性质
(2)氮气的反应
时间
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
?
N2 + 3Mg
Mg3N2
点燃
氮化镁
+2
-3
二、氮气
2.化学性质
(2)氮气的反应
时间
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
Mg3N2
二、氮气
2.化学性质
(2)氮气的反应
放电
N2 + O2
2NO
放电
一氧化氮
+2
-2
二、氮气
2.化学性质
(2)氮气的反应
放电
高温
N2 + O2
2NO
放电
一氧化氮
+2
-2
或高温
二、氮气
2.化学性质
(2)氮气的反应
N2 + H2
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
氮肥
尿素
碳酸氢铵
氯化铵
硝酸铵
CO(NH2)2
NH4Cl
NH4NO3
NH4HCO3
制备
……
-3
+1
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
氮肥
尿素
碳酸氢铵
氯化铵
硝酸铵
CO(NH2)2
NH4Cl
NH4NO3
NH4HCO3
制备
应用
……
-3
+1
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
1918年
……
提出+研究
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
……
提出+研究
实现工业化
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
埃特尔
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
2007年
提出+研究
实现工业化
研究机理
……
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
埃特尔
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
……
提出+研究
实现工业化
2007年
研究机理
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
埃特尔
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
……
6%
15-20%
提出+研究
实现工业化
2007年
研究机理
二、氮气
2.化学性质
(2)氮气的反应
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
二、氮气
2.化学性质
(2)氮气的反应
能量!
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
二、氮气
2.化学性质
(2)氮气的反应
能量!
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
N≡N 断裂
三、氮的固定
1.什么是氮的固定?
大气中游离态的氮
氮的化合物
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
人工
固氮
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
人工
固氮
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
硝酸盐
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
人工
固氮
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
三、氮的固定
3. 氮的循环
人工
固氮
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
动物摄食
动物排泄物
及遗体
植物遗体
吸收
被细菌
分解
四、小结
N2的结构
N
N
N
N
四、小结
N2的结构
N2的性质
稳定 + 反应
N
N
N
N
N2 + 3Mg
Mg3N2
点燃
N2 + O2
2NO
放电或高温
N2 + 3H2
2NH3
高温、高压
催化剂
四、小结
N2的结构
N2的性质
稳定 + 反应
氮的固定
氮的循环
N2 → 氮的化合物
N
N
N
N
N2 + 3Mg
Mg3N2
点燃
N2 + O2
2NO
放电或高温
N2 + 3H2
2NH3
高温、高压
催化剂
五、例题
例. 下列关于氮气的用途,叙述错误的是( )
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
五、例题
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
通常情况下,氮气的化学性质很稳定
通常情况下,氮气的化学性质很稳定
√
√
例. 下列关于氮气的用途,叙述错误的是( )
五、例题
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
通常情况下,氮气的化学性质很稳定
通常情况下,氮气的化学性质很稳定
氮气不可燃
√
√
×
例. 下列关于氮气的用途,叙述错误的是( )
例. 下列关于氮气的用途,叙述错误的是( )
五、例题
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
通常情况下,氮气的化学性质很稳定
通常情况下,氮气的化学性质很稳定
氮气不可燃
N2 + 3H2
2NH3
高温、高压
催化剂
√
√
√
×
C
例. 下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
五、例题
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
N2 NO
O2
N2 NH3
H2
五、例题
√
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
+2
0
-3
0
例. 下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
N2 + O2
2NO
放电
五、例题
√
√
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
N2 NO
O2
N2 NH3
H2
+2
0
-3
0
例. 下列关于氮气的叙述,错误的是( )
例. 下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
N2 + O2
2NO
放电
N2 + 3H2
2NH3
高温、高压
催化剂
五、例题
√
√
×
√
D
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
N2 NO
O2
N2 NH3
H2
+2
0
-3
0
第五章 第二节
氮及其化合物(1)
高一年级 化学
一、氮元素
1.认识自然界中的氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
-183℃
O2沸点
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气(气态)
空气(液态)
蒸发
低温
加压
O2(液态)
N2(气态)
-183℃
O2沸点
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
在标准状况下,N2 密度的计算
质量(m)
体积(V)
密度(ρ)=
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
在标准状况下,N2 密度的计算
密度(ρ)=
质量(m)
体积(V)
取1mol N2
密度(ρ)=
1 mol×28 g/mol
1 mol×22.4 L/mol
= 1.25 g/L
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
一、氮元素
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
溶解性:难溶
一、氮元素
海平面,N2溶解度小
海面下,N2溶解度大
(1)在空气中
氧气21%
其他成分1%
氮气78%
空气成分示意图
1.认识自然界中的氮元素
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
溶解性:难溶
一、氮元素
溶解性:难溶
海平面,N2溶解度小
海面下,N2溶解度大
释
放
N2
气
体
上浮速度不要过快!
~
(1)在空气中
氧气21%
其他成分1%
氮气78%
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
空气成分示意图
1.认识自然界中的氮元素
一、氮元素
(2)在动植物、土壤、海洋中
蛋白质
硝酸盐、铵盐
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
动物摄食
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
氨或铵盐
亚硝酸盐
硝酸盐
动物摄食
动物排泄物
及遗体
植物遗体
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
动物摄食
动物排泄物
及遗体
植物遗体
吸收
被细菌
分解
1.认识自然界中的氮元素
一、氮元素
(3)自然界中的氮的循环
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
动物摄食
动物排泄物
及遗体
植物遗体
吸收
被细菌
分解
1.认识自然界中的氮元素
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
第二周期,第VA族
N
+7
2
5
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
第二周期,第VA族
既不容易得到3个电子,
也不容易失去5个电子
N
+7
2
5
共价键
一、氮元素
2.回顾周期表中的氮元素
(1)氮元素在周期表中的位置
(2)氮原子的原子结构
(3)氮原子的性质
(4)氮原子形成的化学键类型
第二周期,第VA族
既不容易得到3个电子,
也不容易失去5个电子
N
+7
2
5
共价键
二、氮气
1.结构
(1)电子式
(2)结构式
(3)化学键类型
二、氮气
1.结构
(1)电子式
(2)结构式
(3)化学键类型
N
N
+7
2
5
N
N
氮原子的
电子式
氮原子的
原子结构示意图
二、氮气
1.结构
(1)电子式
(2)结构式
(3)化学键类型
N
N
+7
2
5
N
N
N
N
N
N
非极性共价键
×
氮原子的
电子式
氮原子的
原子结构示意图
二、氮气
2.化学性质
(1)通常很稳定
测定空气中氧气的含量
二、氮气
2.化学性质
(1)通常很稳定
测定空气中氧气的含量
保护气
稳定
二、氮气
2.化学性质
(1)通常很稳定
测定空气中氧气的含量
保护气
稳定
在空气中点燃镁条
O2
Mg、点燃
MgO
在空气中点燃镁条
O2
N2
Mg、点燃
Mg、点燃
MgO
?
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
?
N2 + 3Mg
Mg3N2
点燃
氮化镁
+2
-3
二、氮气
2.化学性质
(2)氮气的反应
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
?
N2 + 3Mg
Mg3N2
点燃
氮化镁
+2
-3
二、氮气
2.化学性质
(2)氮气的反应
时间
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
?
N2 + 3Mg
Mg3N2
点燃
氮化镁
+2
-3
二、氮气
2.化学性质
(2)氮气的反应
时间
在空气中点燃镁条
将燃着的镁条伸入到盛有N2的集气瓶中
O2
N2
Mg、点燃
Mg、点燃
MgO
Mg3N2
二、氮气
2.化学性质
(2)氮气的反应
放电
N2 + O2
2NO
放电
一氧化氮
+2
-2
二、氮气
2.化学性质
(2)氮气的反应
放电
高温
N2 + O2
2NO
放电
一氧化氮
+2
-2
或高温
二、氮气
2.化学性质
(2)氮气的反应
N2 + H2
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
氮肥
尿素
碳酸氢铵
氯化铵
硝酸铵
CO(NH2)2
NH4Cl
NH4NO3
NH4HCO3
制备
……
-3
+1
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
氮肥
尿素
碳酸氢铵
氯化铵
硝酸铵
CO(NH2)2
NH4Cl
NH4NO3
NH4HCO3
制备
应用
……
-3
+1
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
1918年
……
提出+研究
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
……
提出+研究
实现工业化
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
埃特尔
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
2007年
提出+研究
实现工业化
研究机理
……
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
埃特尔
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
……
提出+研究
实现工业化
2007年
研究机理
二、氮气
2.化学性质
(2)氮气的反应
氨气
N2 + 3H2
2NH3
高温、高压
催化剂
-3
+1
哈伯
【德】
埃特尔
【德】
博施
【德】
柏吉斯
【德】
1918年
1931年
……
6%
15-20%
提出+研究
实现工业化
2007年
研究机理
二、氮气
2.化学性质
(2)氮气的反应
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
二、氮气
2.化学性质
(2)氮气的反应
能量!
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
二、氮气
2.化学性质
(2)氮气的反应
能量!
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
N≡N 断裂
三、氮的固定
1.什么是氮的固定?
大气中游离态的氮
氮的化合物
N2
Mg3N2
NO
NH3
(氮化镁)
(一氧化氮)
(氨气)
+ Mg ,点燃
+ H2 ,高温、高压、催化剂
+ O2 ,放电或高温
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
人工
固氮
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
人工
固氮
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
硝酸盐
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
人工
固氮
三、氮的固定
2.自然固氮和人工固氮
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
三、氮的固定
3. 氮的循环
人工
固氮
大气中的氮
氨或铵盐
亚硝酸盐
硝酸盐
自然固氮
雷电作用
豆科植物的
根瘤菌固氮
化肥生产
动物摄食
动物排泄物
及遗体
植物遗体
吸收
被细菌
分解
四、小结
N2的结构
N
N
N
N
四、小结
N2的结构
N2的性质
稳定 + 反应
N
N
N
N
N2 + 3Mg
Mg3N2
点燃
N2 + O2
2NO
放电或高温
N2 + 3H2
2NH3
高温、高压
催化剂
四、小结
N2的结构
N2的性质
稳定 + 反应
氮的固定
氮的循环
N2 → 氮的化合物
N
N
N
N
N2 + 3Mg
Mg3N2
点燃
N2 + O2
2NO
放电或高温
N2 + 3H2
2NH3
高温、高压
催化剂
五、例题
例. 下列关于氮气的用途,叙述错误的是( )
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
五、例题
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
通常情况下,氮气的化学性质很稳定
通常情况下,氮气的化学性质很稳定
√
√
例. 下列关于氮气的用途,叙述错误的是( )
五、例题
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
通常情况下,氮气的化学性质很稳定
通常情况下,氮气的化学性质很稳定
氮气不可燃
√
√
×
例. 下列关于氮气的用途,叙述错误的是( )
例. 下列关于氮气的用途,叙述错误的是( )
五、例题
A.在灯泡中充入氮气以延长使用寿命
B.焊接金属时常用氮气作保护气
C.用氮气作火箭的燃料
D.用氮气生产氨气制造氮肥
通常情况下,氮气的化学性质很稳定
通常情况下,氮气的化学性质很稳定
氮气不可燃
N2 + 3H2
2NH3
高温、高压
催化剂
√
√
√
×
C
例. 下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
五、例题
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
N2 NO
O2
N2 NH3
H2
五、例题
√
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
+2
0
-3
0
例. 下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
N2 + O2
2NO
放电
五、例题
√
√
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
N2 NO
O2
N2 NH3
H2
+2
0
-3
0
例. 下列关于氮气的叙述,错误的是( )
例. 下列关于氮气的叙述,错误的是( )
A.氮气既可以做氧化剂又可以做还原剂
B.在雷雨天,空气中的氮气和氧气可以反应生成一氧化氮
C.氮的固定是将氮气转化成含氮化合物
N2 + O2
2NO
放电
N2 + 3H2
2NH3
高温、高压
催化剂
五、例题
√
√
×
√
D
D.1 mol氮气可与3 mol氢气完全反应生成2 mol氨气
N2 NO
O2
N2 NH3
H2
+2
0
-3
0
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
