河南省郑州市2022-2023学年高一上学期期末考试化学试题(含答案)
文档属性
| 名称 | 河南省郑州市2022-2023学年高一上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 09:53:59 | ||
图片预览


文档简介
郑州市2022-2023学年高一上学期期末考试
化学
注意事项:
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.考试时间90分
钟,满分100分.考生应首先阅读答题卡上的文字信息,然后在答题卡上作答,在试题卷上作答无效.交卷时只交答题卡.
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 Fe-56
第Ⅰ卷 选择题
选择题(本题共16小题,每题只有一个选项符合题意,每小题3分,共48分)
1.下列我国技术应用中,其工作原理不涉及化学反应的是( )
A.合成结晶牛胰岛素 B.用乙醚提取青蒿素 C.烧制陶瓷 D.合成药物
A.A B.B C.C D.D
2.新冠病毒直径大约为.化学知识在新冠疫情防控中发挥着重要作用,下列说法正确的是( )
A.新冠病毒扩散到空气中可能会产生丁达尔现象
B.使用过的口罩放到可回收垃圾桶回收利用
C.将不同品牌的消毒液混合使用消毒效果一定更好
D.过氧乙酸可用于空气消毒,其氧元素化合价均为
3.下图表示汽车尾气净化器处理汽车尾气的过程.下列有关叙述不正确的是( )
A.转化为所需氧元素来源于
B.汽车尾气发生的都是氧化反应
C.催化剂化学反应前后质量不变
D.使用该净化器可减少酸雨的发生
4.常温下,下列各组中的离子,能在溶液中大量共存的是( )
A. B.
C. D.
5.下列变化中,与氧化还原反应无关的是( )
A.食物的腐败 B.钢铁的锈蚀 C.钟乳石的形成 D.燃料的燃烧
A.A B.B C.C D.D
6.化工原料氰化钠有剧毒,一旦进入城市排水系统,后果不堪设想.下列物质能对泄漏的少量氰化钠做无害化处理的是( )
A.氢氧化钠溶液 B.氯化钠溶液 C.双氧水 D.铁粉
7.五育并举,劳动先行.下列劳动涉及的化学知识表述不正确的是( )
选项 劳动项目 化学知识
A 用含有活性氧颗粒的漂白剂浸泡变黄的衣服 活性氧颗粒具有强氧化性,可做漂白剂
B 用食醋除去水壶中的水垢 食醋可溶解水垢的主要成分
C 用复合膨松剂制作馒头 利用碳酸盐类产生使馒头松软
D 用酒精进行消毒 酒精的强氧化性能灭活病毒和细菌
A.A B.B C.C D.D
8.安全重于泰山.下列行为不符合安全要求的是( )
A.熄灭少量燃着的金属钠,可用干燥沙土覆盖
B.做实验剩余的金属钠,丢弃在废液缸中
C.大量氯气泄漏时,迅速离开现场并尽量往高处去
D.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
9.铝粉与氧化铁在高温条件下的反应可用来焊接钢轨.下列说法不正确的是( )
A.该反应放出大量的热,生成的铁呈熔融态
B.该反应的化学方程式
C.被氧化的物质与被还原的物质的物质的量之比为
D.实验室引发该反应通常在铝热剂表面加氯酸钾,插上镁带并点燃
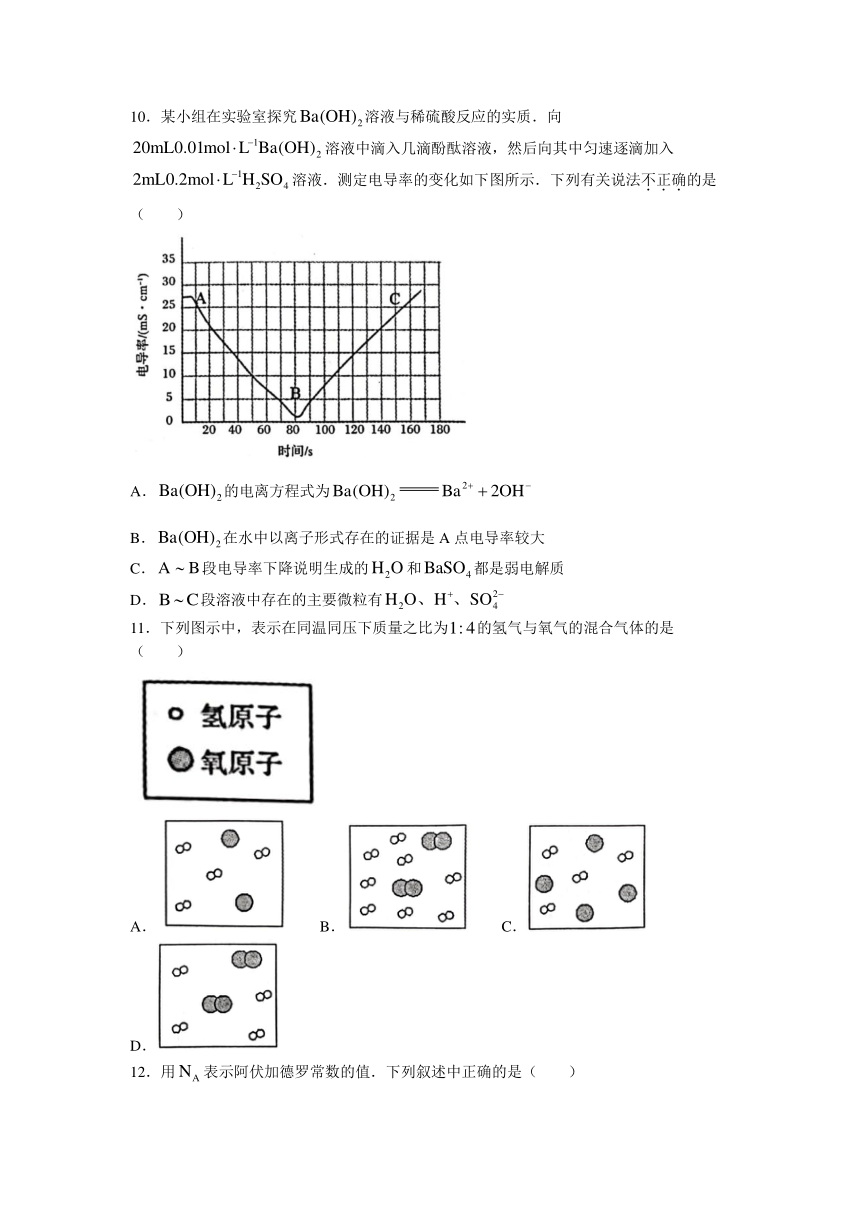
10.某小组在实验室探究溶液与稀硫酸反应的实质.向溶液中滴入几滴酚酞溶液,然后向其中匀速逐滴加入溶液.测定电导率的变化如下图所示.下列有关说法不正确的是( )
A.的电离方程式为
B.在水中以离子形式存在的证据是A点电导率较大
C.段电导率下降说明生成的和都是弱电解质
D.段溶液中存在的主要微粒有
11.下列图示中,表示在同温同压下质量之比为的氢气与氧气的混合气体的是( )
A. B. C. D.
12.用表示阿伏加德罗常数的值.下列叙述中正确的是( )
A.足量和反应,转移电子数目为
B.和的混合气体中含有的氧原子数为
C.常温常压下,所含电子数为
D.的溶液中数目为
13.下列实验中,利用图中装置不能达到实验目的的是( )
选项 A B C D
装置
目的 证明极易溶于水 证明与水反应放热 验证铁粉与水蒸气反应 鉴别碳酸钠和碳酸氢钠
A.A B.B C.C D.D
14.下列有关离子方程式不正确的是( )
A.用溶液蚀刻铜板:
B.向硫酸铁溶液中加入溶液:
C.向碳酸钙中加入稀盐酸:
D.向氢氧化铜悬浊液中加入稀硫酸:
15.下列“实验结论”与“实验操作及现象”不相符的一组是( )
选项 实验操作及现象 实验结论
A 向某溶液中先滴加双氧水,再滴加溶液,溶液呈红色 原溶液一定含
B 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 氯水中含有酸性物质和漂白性物质
C 向某溶液中加入足量稀盐酸,无明显现象;再加入溶液,有白色沉淀产生 原溶液中含有
D 向某溶液中加入浓溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 原溶液中含有
A.A B.B C.C D.D
16.研究不同价态硫元素之间的转化是合理利用硫元素的基本途径.以下是硫及其化合物的“价一类”二维图及它们之间相互转化的部分信息.下列说法错误的是( )
A.C与A反应生成B,体现C的氧化性
B.C可使品红溶液褪色,体现C的漂白性
C.以及都是造成酸雨的可能途径
D.E的浓溶液可作干燥剂,能干燥等气体
第Ⅱ卷 非选择题
非选择题(本题包括5大题,共52分)
17.(9分)分类归纳是化学学习的一种重要方法.依据物质的性质分析以下物质:、、、、、,回答下列问题.
上述物质中:
(1)碱性氧化物与盐酸反应的化学方程式为_____________________.
(2)酸性氧化物与足量溶液反应的离子方程式为_____________________.
(3)属于碱且具有还原性的物质是_____________________(填化学式),属于酸的物质是_____________________(填化学式),二者发生反应的反应类型为_____________________(填“氧化还原反应”或“非氧化还原反应”).
(4)实验室利用盐与碱反应制氨气,该反应的化学方程式为_____________________.
18.(9分)实验室用浓盐酸配制稀盐酸.
(1)请将以下配制溶液的操作步骤补充完整.
a.计算:计算需要浓盐酸的体积为_____________________.
b.量取:根据计算结果,用量筒准确量取所需体积的浓盐酸.
c.稀释:将浓盐酸沿玻璃棒注入盛有蒸馏水的烧杯中,用玻璃棒慢慢搅动后,再向烧杯中加少量蒸馏水,搅拌使其混合均匀.
d.转移、洗涤:冷却至室温后,将烧杯中的溶液沿玻璃棒注入_____________________中,用蒸馏水洗涤烧杯和玻璃棒各2~3次,将洗涤液全部注入容量瓶,轻轻摇动容量瓶.
e.定容、摇匀:将蒸馏水注入容量瓶,当液面离刻度线时改用_____________________滴加蒸馏水至溶液的凹液面与刻度线相切.盖好瓶塞,反复上下颠倒,摇匀.
£.贴标签:将配制好的溶液倒入试剂瓶中,贴好标签.
(2)下列操作中,会造成所配制溶液的物质的量浓度偏高的是_____________________(填字母).
a.定容时,俯视刻度线
b.配制过程中忘记洗涤烧杯和玻璃棒
c.转移时有少量溶液酒出
d.加蒸馏水时不慎超过了容量瓶瓶颈上的刻度线
(3)若实验过程中加蒸馏水时,不慎超过了容量瓶瓶颈上的刻度线,应如何处理?__________________________________________
19.(10分)某同学用下图装置制取并探究其性质,回答下列问题:
(1)装置①用于制取,该反应的离子方程式为_____________________.
(2)装置②的作用是_____________________.
(3)装置③用于验证的氧化性强于S,该装置中发生反应的离子方程式为_____________________.
(4)装置④中的现象是_____________________.
(5)装置⑤的作用是_____________________.
20.(12分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将O氧化成,而稀硝酸不能氧化.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
可选试剂:浓硝酸、稀硝酸、蒸馏水、溶液、.(提示:所提供的5种试剂在本实验中均要用到.)
已知:溶液不与反应,能与反应.
(1)滴加浓硝酸之前的操作依次为:检验装置的气密性,加入药品,打开弹簧夹后通入一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内.通入的作用是_____________________.
(2)装置①中发生反应的化学方程式是_____________________;该反应中氧化剂与还原剂的物质的量之比为_____________________.
(3)用化学方程式表示装置②的作用_____________________.
(4)实验应避免有害气体排放到空气中.装置③④⑥中盛放的药品依次是_____________________、_____________________、_____________________.
(5)该小组得出的结论所依据的实验现象是装置③中液面上方气体仍为无色,装置④中液面上方_____________________.
21.(12分)84消毒液是一种常见的含氯消毒剂,广泛用于家庭、医院的消毒.某学习小组对84消毒液的性质进行探究
查阅资料:(1)84消毒液的主要成分是,还含有少量的
(2)单质碘遇淀粉变蓝.
预测性质:
(1)从物质类别看,属于_____________________,属于_____________________(填“强”或“弱”)酸,可能与某些酸反应.
(2)84消毒液具有氧化性,预测的依据是_____________________.
(3)实验验证:
实验序号 操作 现象 结论或解释
ⅰ 向稀释后的84消毒液中滴入稍过量的溶液和几滴淀粉 ____________ 84消毒液具有氧化性
ⅱ 向稀释后的84消毒液中滴入稀盐酸 溶液变为黄绿色 反应的离子方程式___________
ⅲ 向稀释后的84消毒液中通入 无明显现象
(4)该学习小组同学对实验ⅲ进行了如下改进:
观察到ⅲ—1试管中无明显现象,ⅱ—2、ⅲ—3中红色布条均褪色,ⅲ—3中红色布条褪色更明显.
①对比ⅲ—1、ⅰ—2的现象,可得到的结论是_____________________.
②对比ⅰ—2、ⅲ—3的现象,产生该现象差异的原因是_____________________.
高一化学参考答案
选择题(16小题,每小题3分,共48分)
1.B 2.A 3.B 4.D 5.C 6.C 7.D 8.B 9.C 10.C 11.B 12.B 13.A 14.A 15.A 16.D
非选择题(共5小题,共52分)
17. (9分)(1)Fe2O3 +6HCl===2FeCl3 +3 H2O (2分)
(2)SO2 +2OH- ===SO3 2- + H2O (2分)
(3)Fe(OH) 2 HNO3 氧化还原反应 (各1分,共3分)
(4)2NH4Cl+ Ca(OH) 2 CaCl2 + 2NH3↑ + 2H2O (2分)
18(9分)(1)5.0 (2分) 250 mL容量瓶(2分) 胶头滴管(1分)
(2)a(2分)
(3)重新配制 (2分)
19(10分)(1)MnO2 + 4H++2Cl-Mn2+ + Cl2↑ + 2H2O (2分)
(2)除去Cl2中混有的HCl气体(2分)
(3)Cl2 + S2-=== 2Cl-+ S↓(2分)
(4)集气瓶中逐渐充满黄绿色气体,湿润的有色布条褪色(2分)
(5)吸收氯气,防止污染环境 (2分)
20.(12分)(1)赶尽装置内的空气(2分)
(2)Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O(2分) 2∶1(1分)
(3)3NO2+H2O===2HNO3+NO(2分)
(4)3 mol L-1稀硝酸、浓硝酸、氢氧化钠溶液(各1分,共3分)
(5)气体由无色变为红棕色(2分)
21.(12分)(1)盐(1分) 弱(1分)
(2)NaClO中Cl为+1价,可能降低为0价或-1价,因此NaClO具有氧化性(2分)
(3)溶液变蓝(2分) ClO+ Cl-+2H+===H2O+Cl2↑(2分)
(4)①84消毒液具有漂白性(2分)
②NaClO在CO2和H2O的作用下转化为HClO,HClO的漂白性更强(2分)
化学
注意事项:
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.考试时间90分
钟,满分100分.考生应首先阅读答题卡上的文字信息,然后在答题卡上作答,在试题卷上作答无效.交卷时只交答题卡.
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 Fe-56
第Ⅰ卷 选择题
选择题(本题共16小题,每题只有一个选项符合题意,每小题3分,共48分)
1.下列我国技术应用中,其工作原理不涉及化学反应的是( )
A.合成结晶牛胰岛素 B.用乙醚提取青蒿素 C.烧制陶瓷 D.合成药物
A.A B.B C.C D.D
2.新冠病毒直径大约为.化学知识在新冠疫情防控中发挥着重要作用,下列说法正确的是( )
A.新冠病毒扩散到空气中可能会产生丁达尔现象
B.使用过的口罩放到可回收垃圾桶回收利用
C.将不同品牌的消毒液混合使用消毒效果一定更好
D.过氧乙酸可用于空气消毒,其氧元素化合价均为
3.下图表示汽车尾气净化器处理汽车尾气的过程.下列有关叙述不正确的是( )
A.转化为所需氧元素来源于
B.汽车尾气发生的都是氧化反应
C.催化剂化学反应前后质量不变
D.使用该净化器可减少酸雨的发生
4.常温下,下列各组中的离子,能在溶液中大量共存的是( )
A. B.
C. D.
5.下列变化中,与氧化还原反应无关的是( )
A.食物的腐败 B.钢铁的锈蚀 C.钟乳石的形成 D.燃料的燃烧
A.A B.B C.C D.D
6.化工原料氰化钠有剧毒,一旦进入城市排水系统,后果不堪设想.下列物质能对泄漏的少量氰化钠做无害化处理的是( )
A.氢氧化钠溶液 B.氯化钠溶液 C.双氧水 D.铁粉
7.五育并举,劳动先行.下列劳动涉及的化学知识表述不正确的是( )
选项 劳动项目 化学知识
A 用含有活性氧颗粒的漂白剂浸泡变黄的衣服 活性氧颗粒具有强氧化性,可做漂白剂
B 用食醋除去水壶中的水垢 食醋可溶解水垢的主要成分
C 用复合膨松剂制作馒头 利用碳酸盐类产生使馒头松软
D 用酒精进行消毒 酒精的强氧化性能灭活病毒和细菌
A.A B.B C.C D.D
8.安全重于泰山.下列行为不符合安全要求的是( )
A.熄灭少量燃着的金属钠,可用干燥沙土覆盖
B.做实验剩余的金属钠,丢弃在废液缸中
C.大量氯气泄漏时,迅速离开现场并尽量往高处去
D.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
9.铝粉与氧化铁在高温条件下的反应可用来焊接钢轨.下列说法不正确的是( )
A.该反应放出大量的热,生成的铁呈熔融态
B.该反应的化学方程式
C.被氧化的物质与被还原的物质的物质的量之比为
D.实验室引发该反应通常在铝热剂表面加氯酸钾,插上镁带并点燃
10.某小组在实验室探究溶液与稀硫酸反应的实质.向溶液中滴入几滴酚酞溶液,然后向其中匀速逐滴加入溶液.测定电导率的变化如下图所示.下列有关说法不正确的是( )
A.的电离方程式为
B.在水中以离子形式存在的证据是A点电导率较大
C.段电导率下降说明生成的和都是弱电解质
D.段溶液中存在的主要微粒有
11.下列图示中,表示在同温同压下质量之比为的氢气与氧气的混合气体的是( )
A. B. C. D.
12.用表示阿伏加德罗常数的值.下列叙述中正确的是( )
A.足量和反应,转移电子数目为
B.和的混合气体中含有的氧原子数为
C.常温常压下,所含电子数为
D.的溶液中数目为
13.下列实验中,利用图中装置不能达到实验目的的是( )
选项 A B C D
装置
目的 证明极易溶于水 证明与水反应放热 验证铁粉与水蒸气反应 鉴别碳酸钠和碳酸氢钠
A.A B.B C.C D.D
14.下列有关离子方程式不正确的是( )
A.用溶液蚀刻铜板:
B.向硫酸铁溶液中加入溶液:
C.向碳酸钙中加入稀盐酸:
D.向氢氧化铜悬浊液中加入稀硫酸:
15.下列“实验结论”与“实验操作及现象”不相符的一组是( )
选项 实验操作及现象 实验结论
A 向某溶液中先滴加双氧水,再滴加溶液,溶液呈红色 原溶液一定含
B 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 氯水中含有酸性物质和漂白性物质
C 向某溶液中加入足量稀盐酸,无明显现象;再加入溶液,有白色沉淀产生 原溶液中含有
D 向某溶液中加入浓溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 原溶液中含有
A.A B.B C.C D.D
16.研究不同价态硫元素之间的转化是合理利用硫元素的基本途径.以下是硫及其化合物的“价一类”二维图及它们之间相互转化的部分信息.下列说法错误的是( )
A.C与A反应生成B,体现C的氧化性
B.C可使品红溶液褪色,体现C的漂白性
C.以及都是造成酸雨的可能途径
D.E的浓溶液可作干燥剂,能干燥等气体
第Ⅱ卷 非选择题
非选择题(本题包括5大题,共52分)
17.(9分)分类归纳是化学学习的一种重要方法.依据物质的性质分析以下物质:、、、、、,回答下列问题.
上述物质中:
(1)碱性氧化物与盐酸反应的化学方程式为_____________________.
(2)酸性氧化物与足量溶液反应的离子方程式为_____________________.
(3)属于碱且具有还原性的物质是_____________________(填化学式),属于酸的物质是_____________________(填化学式),二者发生反应的反应类型为_____________________(填“氧化还原反应”或“非氧化还原反应”).
(4)实验室利用盐与碱反应制氨气,该反应的化学方程式为_____________________.
18.(9分)实验室用浓盐酸配制稀盐酸.
(1)请将以下配制溶液的操作步骤补充完整.
a.计算:计算需要浓盐酸的体积为_____________________.
b.量取:根据计算结果,用量筒准确量取所需体积的浓盐酸.
c.稀释:将浓盐酸沿玻璃棒注入盛有蒸馏水的烧杯中,用玻璃棒慢慢搅动后,再向烧杯中加少量蒸馏水,搅拌使其混合均匀.
d.转移、洗涤:冷却至室温后,将烧杯中的溶液沿玻璃棒注入_____________________中,用蒸馏水洗涤烧杯和玻璃棒各2~3次,将洗涤液全部注入容量瓶,轻轻摇动容量瓶.
e.定容、摇匀:将蒸馏水注入容量瓶,当液面离刻度线时改用_____________________滴加蒸馏水至溶液的凹液面与刻度线相切.盖好瓶塞,反复上下颠倒,摇匀.
£.贴标签:将配制好的溶液倒入试剂瓶中,贴好标签.
(2)下列操作中,会造成所配制溶液的物质的量浓度偏高的是_____________________(填字母).
a.定容时,俯视刻度线
b.配制过程中忘记洗涤烧杯和玻璃棒
c.转移时有少量溶液酒出
d.加蒸馏水时不慎超过了容量瓶瓶颈上的刻度线
(3)若实验过程中加蒸馏水时,不慎超过了容量瓶瓶颈上的刻度线,应如何处理?__________________________________________
19.(10分)某同学用下图装置制取并探究其性质,回答下列问题:
(1)装置①用于制取,该反应的离子方程式为_____________________.
(2)装置②的作用是_____________________.
(3)装置③用于验证的氧化性强于S,该装置中发生反应的离子方程式为_____________________.
(4)装置④中的现象是_____________________.
(5)装置⑤的作用是_____________________.
20.(12分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将O氧化成,而稀硝酸不能氧化.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
可选试剂:浓硝酸、稀硝酸、蒸馏水、溶液、.(提示:所提供的5种试剂在本实验中均要用到.)
已知:溶液不与反应,能与反应.
(1)滴加浓硝酸之前的操作依次为:检验装置的气密性,加入药品,打开弹簧夹后通入一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内.通入的作用是_____________________.
(2)装置①中发生反应的化学方程式是_____________________;该反应中氧化剂与还原剂的物质的量之比为_____________________.
(3)用化学方程式表示装置②的作用_____________________.
(4)实验应避免有害气体排放到空气中.装置③④⑥中盛放的药品依次是_____________________、_____________________、_____________________.
(5)该小组得出的结论所依据的实验现象是装置③中液面上方气体仍为无色,装置④中液面上方_____________________.
21.(12分)84消毒液是一种常见的含氯消毒剂,广泛用于家庭、医院的消毒.某学习小组对84消毒液的性质进行探究
查阅资料:(1)84消毒液的主要成分是,还含有少量的
(2)单质碘遇淀粉变蓝.
预测性质:
(1)从物质类别看,属于_____________________,属于_____________________(填“强”或“弱”)酸,可能与某些酸反应.
(2)84消毒液具有氧化性,预测的依据是_____________________.
(3)实验验证:
实验序号 操作 现象 结论或解释
ⅰ 向稀释后的84消毒液中滴入稍过量的溶液和几滴淀粉 ____________ 84消毒液具有氧化性
ⅱ 向稀释后的84消毒液中滴入稀盐酸 溶液变为黄绿色 反应的离子方程式___________
ⅲ 向稀释后的84消毒液中通入 无明显现象
(4)该学习小组同学对实验ⅲ进行了如下改进:
观察到ⅲ—1试管中无明显现象,ⅱ—2、ⅲ—3中红色布条均褪色,ⅲ—3中红色布条褪色更明显.
①对比ⅲ—1、ⅰ—2的现象,可得到的结论是_____________________.
②对比ⅰ—2、ⅲ—3的现象,产生该现象差异的原因是_____________________.
高一化学参考答案
选择题(16小题,每小题3分,共48分)
1.B 2.A 3.B 4.D 5.C 6.C 7.D 8.B 9.C 10.C 11.B 12.B 13.A 14.A 15.A 16.D
非选择题(共5小题,共52分)
17. (9分)(1)Fe2O3 +6HCl===2FeCl3 +3 H2O (2分)
(2)SO2 +2OH- ===SO3 2- + H2O (2分)
(3)Fe(OH) 2 HNO3 氧化还原反应 (各1分,共3分)
(4)2NH4Cl+ Ca(OH) 2 CaCl2 + 2NH3↑ + 2H2O (2分)
18(9分)(1)5.0 (2分) 250 mL容量瓶(2分) 胶头滴管(1分)
(2)a(2分)
(3)重新配制 (2分)
19(10分)(1)MnO2 + 4H++2Cl-Mn2+ + Cl2↑ + 2H2O (2分)
(2)除去Cl2中混有的HCl气体(2分)
(3)Cl2 + S2-=== 2Cl-+ S↓(2分)
(4)集气瓶中逐渐充满黄绿色气体,湿润的有色布条褪色(2分)
(5)吸收氯气,防止污染环境 (2分)
20.(12分)(1)赶尽装置内的空气(2分)
(2)Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O(2分) 2∶1(1分)
(3)3NO2+H2O===2HNO3+NO(2分)
(4)3 mol L-1稀硝酸、浓硝酸、氢氧化钠溶液(各1分,共3分)
(5)气体由无色变为红棕色(2分)
21.(12分)(1)盐(1分) 弱(1分)
(2)NaClO中Cl为+1价,可能降低为0价或-1价,因此NaClO具有氧化性(2分)
(3)溶液变蓝(2分) ClO+ Cl-+2H+===H2O+Cl2↑(2分)
(4)①84消毒液具有漂白性(2分)
②NaClO在CO2和H2O的作用下转化为HClO,HClO的漂白性更强(2分)
同课章节目录
