2.2.1 烯烃 课件(共25张PPT)
文档属性
| 名称 | 2.2.1 烯烃 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-16 21:41:44 | ||
图片预览





文档简介
(共25张PPT)
第一节 烯烃 炔烃
第1课时 烯烃
第二章 烃
石油被称为工业的血液,石油化工的一种重要的产品——乙烯,其产量则是衡量国家石油化工水平的重要标志
学习目标
1.了解烯烃物理性质的变化规律
2.掌握烯烃的化学性质
3.了解烯烃的结构特征和顺反异构
探究学习
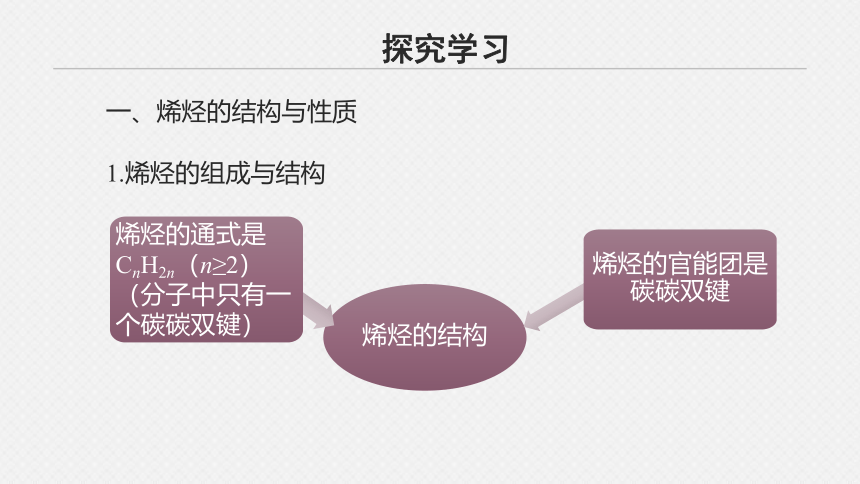
一、烯烃的结构与性质
1.烯烃的组成与结构
烯烃的结构
烯烃的通式是CnH2n(n≥2)(分子中只有一个碳碳双键)
烯烃的官能团是碳碳双键
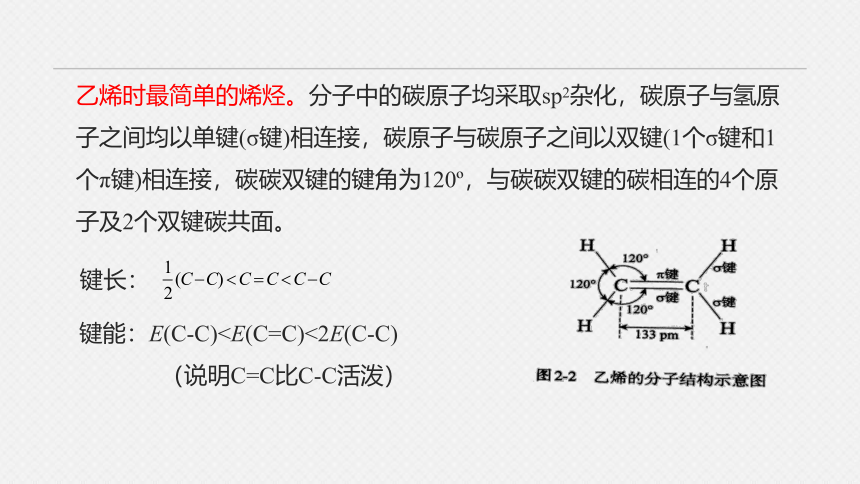
乙烯时最简单的烯烃。分子中的碳原子均采取sp2杂化,碳原子与氢原子之间均以单键(σ键)相连接,碳原子与碳原子之间以双键(1个σ键和1个π键)相连接,碳碳双键的键角为120 ,与碳碳双键的碳相连的4个原子及2个双键碳共面。
键长:
键能:E(C-C)(说明C=C比C-C活泼)
2.烯烃的性质——乙烯
(1)物理性质
通常状况下,乙烯是一种无色、稍有气味的气体,其密度比相同条件下的空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂
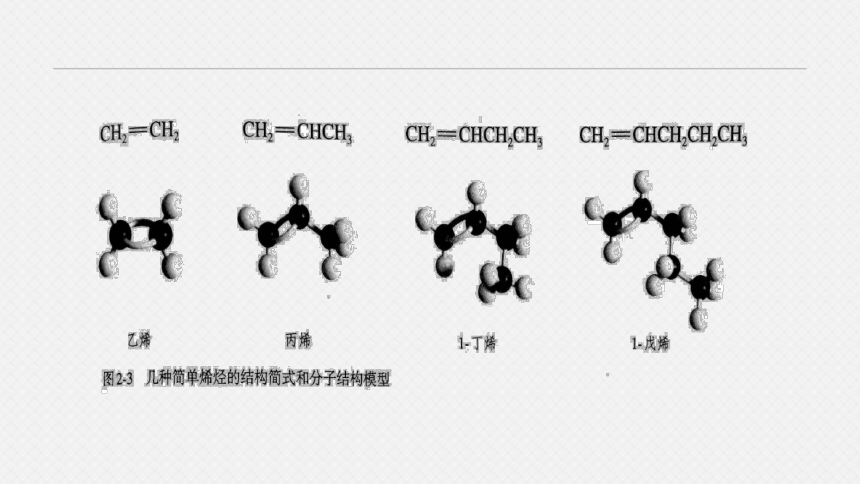
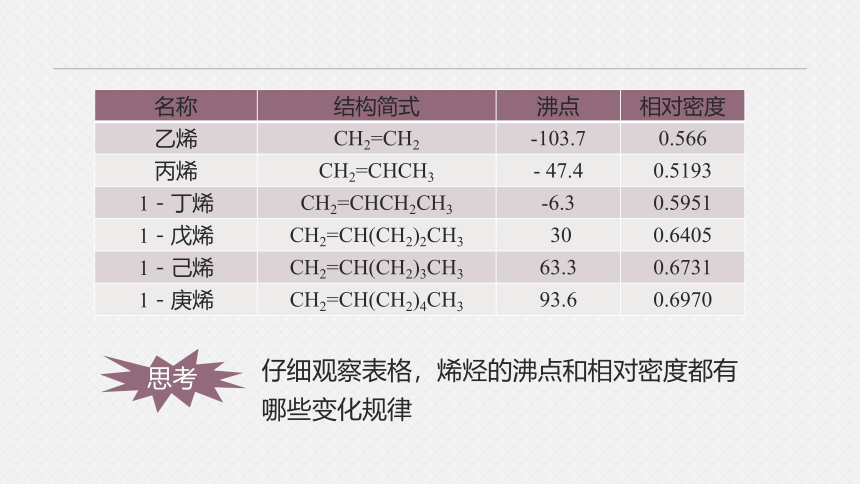
名称 结构简式 沸点 相对密度
乙烯 CH2=CH2 -103.7 0.566
丙烯 CH2=CHCH3 - 47.4 0.5193
1-丁烯 CH2=CHCH2CH3 -6.3 0.5951
1-戊烯 CH2=CH(CH2)2CH3 30 0.6405
1-己烯 CH2=CH(CH2)3CH3 63.3 0.6731
1-庚烯 CH2=CH(CH2)4CH3 93.6 0.6970
思考
仔细观察表格,烯烃的沸点和相对密度都有哪些变化规律
随着分子中碳原子数的递增,熔、沸点逐渐升高,相对密度逐渐增大,常温下的存在状态也是由气态逐渐过渡到液态、固态。
①当烃分子中碳原子数≤4时,常温下呈气态。
②分子式相同的烃,支链越多,熔、沸点越低。
③烃的相对密度小于水的密度。
回忆与思考
烃类的熔沸点有那些规律呢?
(2)化学性质
①氧化反应
A.燃烧:燃烧通式为CnH2n+O2nCO2+nH2O
燃烧现象:火焰明亮,有少量黑烟
B.使酸性高锰酸钾溶液褪色
烯烃含有不饱和碳键,相较于烷烃,性质更加的活泼,易被酸性高锰酸钾氧化。
②加成反应
概念:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合,生成新的化合物的反应。
乙烯与溴的四氯化碳溶液反应生成1,2- 二溴乙烷
CH2══CH2+Br2 CH2—CH2
Br Br
可以利用酸性高锰酸钾或溴水与烯烃反应,产生的颜色变化来区分烯烃与烷烃
通过乙烯与溴的四氯化碳溶液反应,试写出乙烯与HCl、水的加成反应的化学方程式
催化剂
△
CH2══CH2+ HCl CH3— CH2Cl
CH2══CH2+ H2 CH3 CH2—OH
催化剂
△
根据上述所学知识,能否写出丙烯与溴的四氯化碳溶液、HCl、水的加成反应的化学方程式呢?
CH2══CHCH3+Br2 CH2Br—CH2BrCH3
CH2══CHCH3+HCl CH3—CHClCH3
CH2══CHCH3+H2 (CH3) 2CH—OH
CH2══CHCH3+H2CH3CH2CH2—OH
催化剂
△
催化剂
△
催化剂
△
催化剂
△
CH2══CHCH3+H2 (CH3) 2CH—OH
CH2══CHCH3+H2 CH3CH2CH2—OH
注意
催化剂
△
催化剂
△
③加聚反应
与加成反应相似,在乙烯生成聚乙烯的聚合反应中,乙烯双键中的一个键也发生了断裂,相互通过碳碳单键结合,形成了具有很长的碳链的高分子化合物
nCH2 == CH2 [ CH2—CH2 ]n
催化剂
nCH2 == CH [ CH2—CH ]n
催化剂
C1
C1
请根据乙烯、氯乙烯发生的加聚反应,分别写出丙烯、异丁烯 发生加聚反应的化学方程式。
巩固练习
(1)乙烯与KMnO4(H+)溶液、溴水反应类型相同。( )
(2)乙烯、聚乙烯均能发生加成反应。( )
(3)聚丙烯的结构简式为 [CH2—CH—CH2]n 。( )
(4)1 -丁烯与1,3 -丁二烯为同系物。( )
×
×
×
×
二、烯烃的顺反异构
1.定义:通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象
2. 顺反异构产生的条件:
①分子中具有碳碳双键结构;
②组成双键的每个碳原子必须连接两个不同的原子或原子团。
顺反异构的类别
①顺式结构:两个相同的原子或原子团排列在双键的同一侧。
②反式结构:两个相同的原子或原子团分别排列在双键的两侧。
4. 命名:
5. 烯烃的构造异构
烯烃分子结构中因存在碳碳双键,又与环烷烃的分子通式相同,决定其同分异构体包括构造异构中的三种类型:碳架异构、位置异构、官能团异构
顺式:
反式:
C== C
a
a
b
b
C== C
a
b
b
a
3. 性质:化学性质基本相同,物理性质有一定的差异
2. 代表物——CH2==CH—CH==CH2 1,3-丁二烯
③1,4加成:CH2==CH—CH==CH2+Cl2→CH2Cl—CH=CH—CH2Cl
①1,2加成:CH2==CH—CH==CH2+Cl2→CH2Cl—CHCl—CH==CH2
②完全加成:CH2==CH—CH==CH2+2Cl2→CH2Cl—CHCl—CHCl—CH2Cl
加聚反应:nCH2==CH—CH==CH2→
二烯烃
1. 定义:分子中含有两个碳碳双键的烯烃
3. 化学性质:加成反应
资料卡片
[ CH2—CH==CH—CH2]n
烯烃的命名
1. 选主链,称某烯:选含碳碳双键最长的链为主链
2. 编位号:从距离碳碳双键最近的一端编号
3. 写名称:用汉字在“烯” 的名称前表示碳碳双键的个数,
用阿拉伯数字表示碳碳双键的位置在最前面写出取代基的名
称、位置和个数。
知识链接
例:
1-丁烯
2-甲基-2,4-己二烯
课堂小结
烯烃
结构
物理性质
化学性质
氧化反应
加成反应
加聚反应
当堂检测
1.1 mol丙烯与Cl2发生加成反应,得到的产物再与Cl2发生取代反应,两个过程最多消耗Cl2的物质的量为( )
A.2 mol B.4 mol C.7 mol D.8 mol
2.下列烯烃中存在顺反异构体的是( )
A.丙烯 B.1 -丁烯
C.2 -戊烯 D.2 -甲基- 2 -丁烯
C
C
3.有机化合物C4H8是生活中的重要物质,关于C4H8的说法中,错误的是( )
A.C4H8可能是烯烃
B.C4H8中属于烯烃类的同分异构体有4种
C.核磁共振氢谱有2种吸收峰的烯烃结构一定是CH2===C(CH3)
D.C4H8中属于烯烃的顺反异构体有2种
C
本节内容结束
第一节 烯烃 炔烃
第1课时 烯烃
第二章 烃
石油被称为工业的血液,石油化工的一种重要的产品——乙烯,其产量则是衡量国家石油化工水平的重要标志
学习目标
1.了解烯烃物理性质的变化规律
2.掌握烯烃的化学性质
3.了解烯烃的结构特征和顺反异构
探究学习
一、烯烃的结构与性质
1.烯烃的组成与结构
烯烃的结构
烯烃的通式是CnH2n(n≥2)(分子中只有一个碳碳双键)
烯烃的官能团是碳碳双键
乙烯时最简单的烯烃。分子中的碳原子均采取sp2杂化,碳原子与氢原子之间均以单键(σ键)相连接,碳原子与碳原子之间以双键(1个σ键和1个π键)相连接,碳碳双键的键角为120 ,与碳碳双键的碳相连的4个原子及2个双键碳共面。
键长:
键能:E(C-C)
2.烯烃的性质——乙烯
(1)物理性质
通常状况下,乙烯是一种无色、稍有气味的气体,其密度比相同条件下的空气的密度略小,难溶于水,易溶于四氯化碳等有机溶剂
名称 结构简式 沸点 相对密度
乙烯 CH2=CH2 -103.7 0.566
丙烯 CH2=CHCH3 - 47.4 0.5193
1-丁烯 CH2=CHCH2CH3 -6.3 0.5951
1-戊烯 CH2=CH(CH2)2CH3 30 0.6405
1-己烯 CH2=CH(CH2)3CH3 63.3 0.6731
1-庚烯 CH2=CH(CH2)4CH3 93.6 0.6970
思考
仔细观察表格,烯烃的沸点和相对密度都有哪些变化规律
随着分子中碳原子数的递增,熔、沸点逐渐升高,相对密度逐渐增大,常温下的存在状态也是由气态逐渐过渡到液态、固态。
①当烃分子中碳原子数≤4时,常温下呈气态。
②分子式相同的烃,支链越多,熔、沸点越低。
③烃的相对密度小于水的密度。
回忆与思考
烃类的熔沸点有那些规律呢?
(2)化学性质
①氧化反应
A.燃烧:燃烧通式为CnH2n+O2nCO2+nH2O
燃烧现象:火焰明亮,有少量黑烟
B.使酸性高锰酸钾溶液褪色
烯烃含有不饱和碳键,相较于烷烃,性质更加的活泼,易被酸性高锰酸钾氧化。
②加成反应
概念:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合,生成新的化合物的反应。
乙烯与溴的四氯化碳溶液反应生成1,2- 二溴乙烷
CH2══CH2+Br2 CH2—CH2
Br Br
可以利用酸性高锰酸钾或溴水与烯烃反应,产生的颜色变化来区分烯烃与烷烃
通过乙烯与溴的四氯化碳溶液反应,试写出乙烯与HCl、水的加成反应的化学方程式
催化剂
△
CH2══CH2+ HCl CH3— CH2Cl
CH2══CH2+ H2 CH3 CH2—OH
催化剂
△
根据上述所学知识,能否写出丙烯与溴的四氯化碳溶液、HCl、水的加成反应的化学方程式呢?
CH2══CHCH3+Br2 CH2Br—CH2BrCH3
CH2══CHCH3+HCl CH3—CHClCH3
CH2══CHCH3+H2 (CH3) 2CH—OH
CH2══CHCH3+H2CH3CH2CH2—OH
催化剂
△
催化剂
△
催化剂
△
催化剂
△
CH2══CHCH3+H2 (CH3) 2CH—OH
CH2══CHCH3+H2 CH3CH2CH2—OH
注意
催化剂
△
催化剂
△
③加聚反应
与加成反应相似,在乙烯生成聚乙烯的聚合反应中,乙烯双键中的一个键也发生了断裂,相互通过碳碳单键结合,形成了具有很长的碳链的高分子化合物
nCH2 == CH2 [ CH2—CH2 ]n
催化剂
nCH2 == CH [ CH2—CH ]n
催化剂
C1
C1
请根据乙烯、氯乙烯发生的加聚反应,分别写出丙烯、异丁烯 发生加聚反应的化学方程式。
巩固练习
(1)乙烯与KMnO4(H+)溶液、溴水反应类型相同。( )
(2)乙烯、聚乙烯均能发生加成反应。( )
(3)聚丙烯的结构简式为 [CH2—CH—CH2]n 。( )
(4)1 -丁烯与1,3 -丁二烯为同系物。( )
×
×
×
×
二、烯烃的顺反异构
1.定义:通过碳碳双键连接的原子或原子团不能绕键轴旋转会导致其空间排列方式不同,产生顺反异构现象
2. 顺反异构产生的条件:
①分子中具有碳碳双键结构;
②组成双键的每个碳原子必须连接两个不同的原子或原子团。
顺反异构的类别
①顺式结构:两个相同的原子或原子团排列在双键的同一侧。
②反式结构:两个相同的原子或原子团分别排列在双键的两侧。
4. 命名:
5. 烯烃的构造异构
烯烃分子结构中因存在碳碳双键,又与环烷烃的分子通式相同,决定其同分异构体包括构造异构中的三种类型:碳架异构、位置异构、官能团异构
顺式:
反式:
C== C
a
a
b
b
C== C
a
b
b
a
3. 性质:化学性质基本相同,物理性质有一定的差异
2. 代表物——CH2==CH—CH==CH2 1,3-丁二烯
③1,4加成:CH2==CH—CH==CH2+Cl2→CH2Cl—CH=CH—CH2Cl
①1,2加成:CH2==CH—CH==CH2+Cl2→CH2Cl—CHCl—CH==CH2
②完全加成:CH2==CH—CH==CH2+2Cl2→CH2Cl—CHCl—CHCl—CH2Cl
加聚反应:nCH2==CH—CH==CH2→
二烯烃
1. 定义:分子中含有两个碳碳双键的烯烃
3. 化学性质:加成反应
资料卡片
[ CH2—CH==CH—CH2]n
烯烃的命名
1. 选主链,称某烯:选含碳碳双键最长的链为主链
2. 编位号:从距离碳碳双键最近的一端编号
3. 写名称:用汉字在“烯” 的名称前表示碳碳双键的个数,
用阿拉伯数字表示碳碳双键的位置在最前面写出取代基的名
称、位置和个数。
知识链接
例:
1-丁烯
2-甲基-2,4-己二烯
课堂小结
烯烃
结构
物理性质
化学性质
氧化反应
加成反应
加聚反应
当堂检测
1.1 mol丙烯与Cl2发生加成反应,得到的产物再与Cl2发生取代反应,两个过程最多消耗Cl2的物质的量为( )
A.2 mol B.4 mol C.7 mol D.8 mol
2.下列烯烃中存在顺反异构体的是( )
A.丙烯 B.1 -丁烯
C.2 -戊烯 D.2 -甲基- 2 -丁烯
C
C
3.有机化合物C4H8是生活中的重要物质,关于C4H8的说法中,错误的是( )
A.C4H8可能是烯烃
B.C4H8中属于烯烃类的同分异构体有4种
C.核磁共振氢谱有2种吸收峰的烯烃结构一定是CH2===C(CH3)
D.C4H8中属于烯烃的顺反异构体有2种
C
本节内容结束
