2.2.2 炔烃 课件(共24张PPT)
文档属性
| 名称 | 2.2.2 炔烃 课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-16 21:43:17 | ||
图片预览








文档简介
(共24张PPT)
第2课时 炔烃
第二节 烯烃 炔烃
第二章 烃
一根很长的金属管道,有时需要将它切短;两根短的金属管道,有时又要将它们接在一起,怎么办呢?
切割管道,你也许会想到用钢锯,然而,对于一些口径很粗大的管道,那是多么地费时费力啊!
在20世纪70年代我国农村照明曾经用电石为主要原料制取一种可燃性气体,点燃该气体,产生明亮的火焰;工业上用该气体燃烧产生的高温切割或焊接金属等。这种气体是什么?它的组成和结构如何?在本课时中你将找到答案,明了于心。
学习目标
1.以乙炔为例,掌握炔烃的结构与性质。
2.掌握乙炔的实验室制法。
一、定义:分子里含有碳碳三键的不饱和链烃
二、通式:炔烃只含有一个碳碳三键时,其通式一般表示为 CnH2n-2(n≥2)
注:每形成一个碳碳三键,就减少4个氢
三、物理性质:随着碳原子数的增多,熔沸点依次升高,密度依次增大(密度小于水);C2——C4为气态,其他为液态或固态;不溶于水,易溶于有机溶剂
学习探究 炔烃
四、代表物——乙炔
1、组成与结构:
分子式:C2H2
最简式:CH
电子式:
结构式:H-C≡C-H
结构简式:CH≡CH
空间构型:键角180 ,所有原子共直线。分子中的碳原子均采取sp杂化,碳原子和氢原子之间均以单键(σ键)相连接,碳原子和碳原子之间以三键(1个σ键和2个π键)相连接。
2、物理性质:
俗称电石气。无色、无味气体,密度比空气小,微溶于水,易溶于有机溶剂,由于常混有杂质(H2S、PH3)而带有特殊难闻的臭味
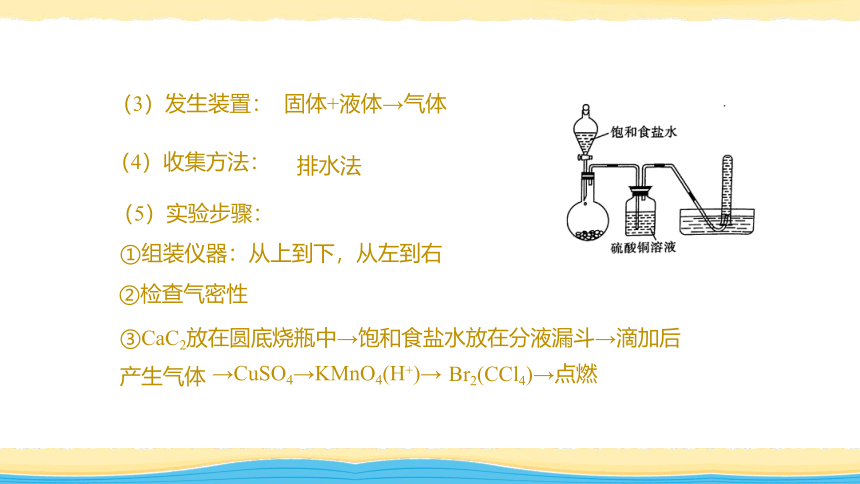
3、实验室制法:
(1)实验用品:
仪器:圆底烧瓶、分液漏斗、铁架台(带铁夹)、导管、试管、双孔塞等
药品:CaC2(电石,离子化合物)、H2O(饱和食盐水)
(2)反应原理:
CaC2+2H2O→C2H2↑+Ca(OH)2
(3)发生装置:
固体+液体→气体
(4)收集方法:
排水法
(5)实验步骤:
①组装仪器:从上到下,从左到右
②检查气密性
③CaC2放在圆底烧瓶中→饱和食盐水放在分液漏斗→滴加后产生气体
→CuSO4→KMnO4(H+)→
Br2(CCl4)→点燃
(6)注意事项:
①检查装置气密性;
②CaC2要密封保存,防止吸水失效;
③用镊子夹取电石,不能用手拿;
④圆底烧瓶在反应前要干燥;
⑤向烧瓶里加入电石时,要使电石沿烧瓶内壁慢慢滑下,以防电石打破烧瓶;
⑥若用大试管制少量C2H2时,在试管上部要放一团疏松的棉花,以避免生成的Ca(OH)2糊状物将导气管口堵塞
⑦电石与水反应很剧烈,为得到平稳的乙炔气流,可用饱和食盐水代替水,并选用分液漏斗控制水流速度
⑧该实验不可用启普发生器:原因有三:
第一:此反应放出大量热,易使启普发生器炸裂
第二:电石吸水性强,与水反应剧烈,不能随用,随停
第三:生成的Ca(OH)2呈糊状,易堵塞球形漏斗,使启普发生器不能随用、随停
⑨工业上用生石灰和焦炭在高压电弧下制备电石:
CaO+3C
CaC2+CO↑
这样制得的电石中往往含有CaS、Ca3P2,由于
CaS+2H2O=H2S↑+Ca(OH)2、
Ca3P2+6H2O=2PH3↑+3Ca(OH)2,
所以制得的C2H2气体中往往含有H2S、PH3等有特殊臭味的杂质。因此可使该混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去
⑩点燃前应先验纯
实验探究
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
产生明亮的火焰,有黑烟
结果与讨论
(1)以上实验现象与你的预测是否一致?乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质?
(2)乙炔通入溴的四氯化碳溶液时的实验现象,说明乙炔具有怎样的化学性质?这与乙炔的哪些结构特点有关?请写出反应的化学方程式,并指出反应前后官能团和化学键的变化。
提示:乙炔使溴的四氯化碳溶液褪色,说明乙炔能发生加成反应,这与乙炔碳碳三键中两个π键易断裂有关。反应的化学方程式:CH≡CH+2Br2→CHBr2CHBr2
提示:一致。乙炔使酸性高锰酸钾溶液褪色,说明乙炔具有还原性,易发生氧化反应。
结果与讨论
(3)乙炔在空气中燃烧的实验现象(如图2-7),说明乙炔在组成上有哪些特点?请写出反应的化学方程式。
提示:乙炔在空气中燃烧,火焰明亮,有黑烟,主要是因为乙炔含碳量高。反应的化学方程式:
2C2H2+5O2
4CO2+2H2O
(1)氧化反应:
①使酸性KMnO4(aq)反应使其褪色
②可燃性:
2C2H2+5O2
4CO2+2H2O
火焰明亮,伴有浓烟。燃烧时放出大量的热,氧炔焰的温度可达3000℃以上
注:点燃乙炔前,要验纯
4、化学性质:
(2)加成反应:
①与X2反应:
CH≡CH+Br2→BrCH=CHBr
CH≡CH+2Br2→CHBr2CHBr2
②与HX反应:
CH≡CH+HCl
CH2=CHCl
③与H2反应:
CH≡CH+H2
CH2=CH2
④与H2O反应:
CH≡CH+H2O
CH3CHO
(3)加聚反应:
聚乙炔可用于制备导电高分子材料
五、化学性质:与乙炔相似
1、氧化反应:
①燃烧:CnH2n-2+
O2
nCO2+(n-1)H2O
②与酸性KMnO4反应→褪色
2、加成反应:常与X2、HX、H2O、H2等发生加成反应
3、加聚反应:
3n-1
2
思考与讨论
(1)请写出戊炔所有属于炔烃的同分异构体的结构简式。
(2)请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
思考与讨论
(3)某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
六、炔烃的命名
选主链,称某炔:选含碳碳三键最长的链为主链;
编位号:从距离碳碳三键最近的一端编号;
写名称:用汉字在“炔”的名称前表示碳碳三键的个数,用阿拉伯数字表示碳碳三键的位置在最前面写出取代基的名称、位置和个数。
2-戊炔
4-甲基-1-戊炔
1.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
当堂检测
A
2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径
是 ( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
D
3.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理
的是( )
A.逐滴加入饱和氯化钠溶液可控制生成乙炔的速率
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.若用溴的CCl4溶液验证乙炔的性质,不需要通过CuSO4溶液除杂
D.若将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
C
本节内容结束
第2课时 炔烃
第二节 烯烃 炔烃
第二章 烃
一根很长的金属管道,有时需要将它切短;两根短的金属管道,有时又要将它们接在一起,怎么办呢?
切割管道,你也许会想到用钢锯,然而,对于一些口径很粗大的管道,那是多么地费时费力啊!
在20世纪70年代我国农村照明曾经用电石为主要原料制取一种可燃性气体,点燃该气体,产生明亮的火焰;工业上用该气体燃烧产生的高温切割或焊接金属等。这种气体是什么?它的组成和结构如何?在本课时中你将找到答案,明了于心。
学习目标
1.以乙炔为例,掌握炔烃的结构与性质。
2.掌握乙炔的实验室制法。
一、定义:分子里含有碳碳三键的不饱和链烃
二、通式:炔烃只含有一个碳碳三键时,其通式一般表示为 CnH2n-2(n≥2)
注:每形成一个碳碳三键,就减少4个氢
三、物理性质:随着碳原子数的增多,熔沸点依次升高,密度依次增大(密度小于水);C2——C4为气态,其他为液态或固态;不溶于水,易溶于有机溶剂
学习探究 炔烃
四、代表物——乙炔
1、组成与结构:
分子式:C2H2
最简式:CH
电子式:
结构式:H-C≡C-H
结构简式:CH≡CH
空间构型:键角180 ,所有原子共直线。分子中的碳原子均采取sp杂化,碳原子和氢原子之间均以单键(σ键)相连接,碳原子和碳原子之间以三键(1个σ键和2个π键)相连接。
2、物理性质:
俗称电石气。无色、无味气体,密度比空气小,微溶于水,易溶于有机溶剂,由于常混有杂质(H2S、PH3)而带有特殊难闻的臭味
3、实验室制法:
(1)实验用品:
仪器:圆底烧瓶、分液漏斗、铁架台(带铁夹)、导管、试管、双孔塞等
药品:CaC2(电石,离子化合物)、H2O(饱和食盐水)
(2)反应原理:
CaC2+2H2O→C2H2↑+Ca(OH)2
(3)发生装置:
固体+液体→气体
(4)收集方法:
排水法
(5)实验步骤:
①组装仪器:从上到下,从左到右
②检查气密性
③CaC2放在圆底烧瓶中→饱和食盐水放在分液漏斗→滴加后产生气体
→CuSO4→KMnO4(H+)→
Br2(CCl4)→点燃
(6)注意事项:
①检查装置气密性;
②CaC2要密封保存,防止吸水失效;
③用镊子夹取电石,不能用手拿;
④圆底烧瓶在反应前要干燥;
⑤向烧瓶里加入电石时,要使电石沿烧瓶内壁慢慢滑下,以防电石打破烧瓶;
⑥若用大试管制少量C2H2时,在试管上部要放一团疏松的棉花,以避免生成的Ca(OH)2糊状物将导气管口堵塞
⑦电石与水反应很剧烈,为得到平稳的乙炔气流,可用饱和食盐水代替水,并选用分液漏斗控制水流速度
⑧该实验不可用启普发生器:原因有三:
第一:此反应放出大量热,易使启普发生器炸裂
第二:电石吸水性强,与水反应剧烈,不能随用,随停
第三:生成的Ca(OH)2呈糊状,易堵塞球形漏斗,使启普发生器不能随用、随停
⑨工业上用生石灰和焦炭在高压电弧下制备电石:
CaO+3C
CaC2+CO↑
这样制得的电石中往往含有CaS、Ca3P2,由于
CaS+2H2O=H2S↑+Ca(OH)2、
Ca3P2+6H2O=2PH3↑+3Ca(OH)2,
所以制得的C2H2气体中往往含有H2S、PH3等有特殊臭味的杂质。因此可使该混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去
⑩点燃前应先验纯
实验探究
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
产生明亮的火焰,有黑烟
结果与讨论
(1)以上实验现象与你的预测是否一致?乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质?
(2)乙炔通入溴的四氯化碳溶液时的实验现象,说明乙炔具有怎样的化学性质?这与乙炔的哪些结构特点有关?请写出反应的化学方程式,并指出反应前后官能团和化学键的变化。
提示:乙炔使溴的四氯化碳溶液褪色,说明乙炔能发生加成反应,这与乙炔碳碳三键中两个π键易断裂有关。反应的化学方程式:CH≡CH+2Br2→CHBr2CHBr2
提示:一致。乙炔使酸性高锰酸钾溶液褪色,说明乙炔具有还原性,易发生氧化反应。
结果与讨论
(3)乙炔在空气中燃烧的实验现象(如图2-7),说明乙炔在组成上有哪些特点?请写出反应的化学方程式。
提示:乙炔在空气中燃烧,火焰明亮,有黑烟,主要是因为乙炔含碳量高。反应的化学方程式:
2C2H2+5O2
4CO2+2H2O
(1)氧化反应:
①使酸性KMnO4(aq)反应使其褪色
②可燃性:
2C2H2+5O2
4CO2+2H2O
火焰明亮,伴有浓烟。燃烧时放出大量的热,氧炔焰的温度可达3000℃以上
注:点燃乙炔前,要验纯
4、化学性质:
(2)加成反应:
①与X2反应:
CH≡CH+Br2→BrCH=CHBr
CH≡CH+2Br2→CHBr2CHBr2
②与HX反应:
CH≡CH+HCl
CH2=CHCl
③与H2反应:
CH≡CH+H2
CH2=CH2
④与H2O反应:
CH≡CH+H2O
CH3CHO
(3)加聚反应:
聚乙炔可用于制备导电高分子材料
五、化学性质:与乙炔相似
1、氧化反应:
①燃烧:CnH2n-2+
O2
nCO2+(n-1)H2O
②与酸性KMnO4反应→褪色
2、加成反应:常与X2、HX、H2O、H2等发生加成反应
3、加聚反应:
3n-1
2
思考与讨论
(1)请写出戊炔所有属于炔烃的同分异构体的结构简式。
(2)请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
思考与讨论
(3)某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
六、炔烃的命名
选主链,称某炔:选含碳碳三键最长的链为主链;
编位号:从距离碳碳三键最近的一端编号;
写名称:用汉字在“炔”的名称前表示碳碳三键的个数,用阿拉伯数字表示碳碳三键的位置在最前面写出取代基的名称、位置和个数。
2-戊炔
4-甲基-1-戊炔
1.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
当堂检测
A
2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径
是 ( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
D
3.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理
的是( )
A.逐滴加入饱和氯化钠溶液可控制生成乙炔的速率
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.若用溴的CCl4溶液验证乙炔的性质,不需要通过CuSO4溶液除杂
D.若将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
C
本节内容结束
