3.3 醛 酮 课件(共41张PPT)
文档属性
| 名称 | 3.3 醛 酮 课件(共41张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-16 22:00:59 | ||
图片预览










文档简介
(共41张PPT)
第三节 醛 酮
第三章 烃的衍生物
学习目标
认识醛的组成、结构特点、性质及其在生产生活中的重要应用。
能描述和分析乙醛的重要反应,能书写相应的化学方程式。
C
O
这种原子团叫羰基,如在其一端连接一个氢原子就形成了
C H
O
它叫醛基。
醛基(-CHO)与烃基(或氢原子)相连构成的一类化合物就叫醛,可用通式RCHO表示。
一、醛
1. 醛的定义:
2. 官能团:
或—CHO,醛基
C
O
H
3. 饱和一元醛的通式:
CnH2nO 或 CnH2n+1CHO
4. 代表物:
CH3
C
O
H
H
C
O
H
甲醛 乙醛
从结构上看,由烃基(或氢原子)跟醛基(-CHO)相连而成的化合物叫醛。
5. 醛的分类:
①醛基的个数:一元醛、二元醛、多元醛
②烃基的种类:脂肪醛、脂环醛、芳香醛
③烃基是否饱和:饱和醛、不饱和醛
二、乙醛
1.物理性质
无色、有刺激性气味的液态
易挥发
密度比水小
与水、乙醇等互溶
乙醛(结构简式为CH3CHO)
2.分子结构:
分子式为C2H4O,结构式为 ,简写为CH3CHO,乙醛的核磁共振氢谱有2组峰,峰面积比为3∶1。
乙醛的核磁共振氢谱
δ
吸收强度
10
8
6
4
2
0
乙醛分子的空间填充模型
乙醛分子的球棍模型
官能团:
或(—CHO)
醛基
—C—H
O
3.化学性质:
(1)加成反应
①催化加氢又称为还原反应,化学方程式为
乙醛能和一些极性试剂发生加成反应,例如与氢氰酸加成:
2-羟基丙腈
②与HCN加成
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。
—C—H
O
δ-
δ+
通常能与碳氧双键加成:H2、HCN
能与碳碳双键加成:H2、X2、HX、H2O
醛基与极性分子加成时,极性分子中带正电荷的原子或原子团连接在醛基的氧原子上,带负电荷的原子或原子团连接在碳原子上。
(2)氧化反应
①银镜反应
试验现象:试管内壁出现光亮的银镜
【实验3-7】在洁净的试管中加入1 mL 2% AgNO3溶液,然后边振荡边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
银氨溶液的配制方法:
取1 mL 2%的AgNO3溶液于洁净试管中,一边振荡试管,一边逐滴滴入2%的稀氨水,至生成的沉淀恰好完全溶解,制得银氨溶液。
AgNO3+NH3·H2O===AgOH↓+NH4NO3
AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
实验成功的关键环节:
①试管内壁必须光滑、洁净;
②实验的银氨溶液应现配现用;氨水不能太浓
③必须用水浴加热,不可用酒精灯直接加热;
④加热时不能振荡和摇动试管。
实验后附着的银镜的试管如何洗净?
可用稀硝酸浸泡,再用水洗除去。
②与新制的Cu(OH)2(又叫菲林试剂)反应
实验现象:试管中出现砖红色沉淀
【实验3-8】在试管里加入2 mL10% NaOH溶液,加入5滴5% CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
说明:
a、必须用新制的Cu(OH)2:一方面,新制的Cu(OH)2为絮状物,跟醛的接触面积大;另一方面,久置的Cu(OH)2,易转变成Cu2(OH)2CO3;
b、制备Cu(OH)2时,NaOH必须过量,且质量分数要大些,这样形成的Cu(OH)2能加快乙醛的氧化使现象明显;
c、该反应必须加热到沸腾,才有明显的红色沉淀产生,但不能太久,否则会有黑色的沉淀CuO生成;
d、用途:检验醛基,医疗上检测尿糖;
(2)氧化反应:体现乙醛的还原性
①可燃性:
2C2H4O+O2
4CO2+H2O
②被强氧化剂氧化:
遇到酸性高锰酸钾溶液和溴水使其褪色
注:必须是溴水,溴的CCl4溶液不会氧化醛基,因为其中不含氧
③催化氧化(加氧):
2CH3CHO+O2
2CH3COOH
④被弱氧化剂氧化:
银镜反应:
CH3CHO+2[Ag(NH3)2]OH 2Ag↓+CH3COONH4+3NH3+H2O
与新制的Cu(OH)2反应:
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
RCH2OH RCHO RCOOH
思考与讨论:
乙醇、乙醛和乙酸三者之间的转化关系如下图所示。请结合具体反应,以及三者的分子结构和官能团的变化情况,谈谈有机反应中的氧化反应和还原反应的特点。
乙醛 乙醛 乙酸
自然界的许多植物中都含有醛,其中有些具有特殊的香味,可作为植物香料使用。
—CH=CH—CHO
肉桂醛
—CHO
苯甲醛
桂皮和杏仁中分别含有肉桂醛和苯甲醛
三、醛类物质的物理性质
1. 熔沸点随碳原子数增多而变大,随支链增多而减小。密度随碳原子数增多而逐渐变大;
2. 随着碳原子数的增多,在水中的溶解度逐渐减小,低级醛易溶于水(CH3CHO、HCHO)
3. 除了甲醛是气体,其他的醛常温下是液体或者固体,有一定气味(或刺激性气味)。
四、醛类物质的化学性质
1. 加成反应(还原反应):与H2、HCN反应;
2. 氧化反应:
(1)燃烧
(2)被高锰酸钾、溴水等强氧化剂氧化
(3)被银氨溶液、新制氢氧化铜等若氧化剂氧化
醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生光亮的银镜 产生砖红色沉淀
注意事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
含醛基物质中碳碳双键的检验方法
官能团 醛基 碳碳双键
加入酸性KMnO4溶液 褪色 褪色
加入溴水 褪色 褪色
加入银氨溶液 产生银镜 不反应
加入新制的Cu(OH)2 产生砖红色沉淀 不反应
(1)醛基和碳碳双键性质的比较
(2)含醛基物质中碳碳双键的检验流程
易错警示:
(1)能发生银镜反应的物质不一定是醛类,也可以是甲酸、甲酸酯和葡萄糖等。
(2)配制银氨溶液是向AgNO3稀溶液中逐滴加稀氨水,直到最初生成的沉淀恰好溶解为止,顺序不能颠倒。
(3)银镜反应、与新制的氢氧化铜的反应都必须在碱性条件下进行,若溶液呈酸性,必须先用氢氧化钠溶液中和至碱性。
1. 甲醛
俗名蚁醛,最简单的醛类物质,是一种无色、有强烈刺激性气味的气体,易溶于水,质量分数为35%~40%的水溶液叫做福尔马林,具有防腐和杀菌能力,常作防腐杀菌剂(消毒、浸制标本);制药(农药、消毒剂),香料,染料;制造酚醛树脂、脲醛树脂、维纶等。
五、常见醛——甲醛、丙醛、苯甲醛
结构:
性质 :
与乙醛相似
C
O
H
H
不同点:
①常温下甲醛为无色有刺激性气味的气体。
②甲醛中有2个活泼氢可被氧化。
从结构: H—C—H 分析
O=
(注意:相当于含有两个醛基的特殊结构)
(1)氧化反应:
①被银氨溶液氧化
②被新制Cu(OH)2碱性悬浊液氧化
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
水浴加热
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
加热
(2)加成反应
(3)缩聚反应
还原反应:
n
n
n
n
2. 苯甲醛
(1)组成和结构:
分子式:C6H7O
结构简式:
(2)物理性质:
苯甲醛是最简单的芳香醛,俗称苦杏仁油,是一种有苦杏仁气味的无色液体
(3)用途:
杏仁中含有苯甲醛,苯甲醛是制造染料、香料及药物的重要原料。
(4)化学性质:
①加成反应(还原反应):与H2、HCN反应;
②氧化反应:
I、燃烧
II、被高锰酸钾、溴水等强氧化剂氧化
III、被银氨溶液、新制氢氧化铜等若氧化剂氧化
3. 肉桂醛
(1)组成和结构:
分子式:C9H8O
结构简式:
(2)桂皮中含有肉桂醛。肉桂醛的化学性质主要体现在醛基上
思考与讨论:
(1)由丙醛如何得到1-丙醛或丙酸?
(2)苯甲醛在空气中旧置,在容器内壁会出现苯甲酸的结晶,这是为什么?
六、酮
1.酮的概念和结构特点
酮与醛可能为官能团异构,如丙醛与丙酮互为同分异构体。
酮
概念:羰基与两个羟基相连的化合物
代表物:丙酮( )
官能团:羰基( )
通式:
提示:分子中含相同碳原子数的饱和一元醛与饱和一元酮的分子式相同,结构不同,互为同分异构体。
思考与讨论:
饱和一元醛的通式为CnH2nO(n≥1),饱和一元酮的通式为CnH2nO(n≥3),那么分子中含相同碳原子数的饱和一元醛与饱和一元酮有什么关系
2.丙酮的性质及应用
(1)性质
常温下,丙酮是无色透明的液体,易挥发,能与水、乙醇等互溶。丙酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化。在催化剂存在的条件下,丙酮催化加氢的化学方程式为
加氢还原为相应的醇;
不能发生银镜反应;
不与新制Cu(OH)2悬浊液反应
可用于鉴别酮与醛
(2)应用
酮是重要的有机溶剂和化工原料。例如,丙酮可用作化学纤维、钢瓶储存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
思考与讨论:
丙酮是丙醛的同分异构体吗?它们有哪些性质差异?可采用哪些方法鉴别它们?
解答:丙酮与丙醛分子式均为C3H6O,两者互为同分异构体。
丙醛能被弱氧化剂如银氨溶液、新制氢氧化铜氧化,而丙酮却不能,故可采用上述两种试剂鉴别它们。
1. 加成反应
醛+H2→醇
2. 氧化反应
a. 催化氧化
b. 被弱氧化剂氧化(银氨溶液、新制的Cu(OH)2)
乙酸
c. 使酸性高锰酸钾溶液、溴水褪色
d. 燃烧
(还原反应)
乙醛的化学性质
CH3—C—H+H—CN→CH3—CH—CN
O
OH
(2-羟基丙腈)
课堂小结
乙醛的结构
乙醛的物理性质
1.下列物质中不属于醛类的是( )
③CH2=CH—CHO ④Cl—CH2—CHO
A.①③ B.②④ C.②③ D.①④
B
课堂检测
2.下列有关说法正确的是( )
A.醛一定含醛基,含有醛基的物质一定是醛
B.丙醛只有丙酮一种同分异构体
C.醛类物质在常温常压下都为液体或固体
D.含醛基的物质在一定条件下可与H2发生还原反应
D
3.下列说法中,正确的是( )
A.乙醛与苯甲醛互为同系物
B.苯乙醛的结构简式:
C.醛类既能被氧化为羧酸,又能被还原为醇
D.完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量相等
C
4.某学生做乙醛还原性的实验,取1 mol·L-1的硫酸铜溶液2 mL和0.4 mol·L-1的氢氧化钠溶液4 mL,在一个试管中混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无砖红色沉淀,实验失败的原因是( )
A.氢氧化钠的量不够 B.硫酸铜的量不够
C.乙醛溶液太少 D.加热时间不够
A
5.科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如下。下列关于A的说法中正确的是 ( )
A.化合物A的分子式为C15H22O3
B.与FeCl3溶液发生反应后溶液显紫色
C.1 mol A最多可以与2 mol Cu(OH)2反应
D.1 mol A最多与1 mol H2发生加成反应
A
本节内容结束
第三节 醛 酮
第三章 烃的衍生物
学习目标
认识醛的组成、结构特点、性质及其在生产生活中的重要应用。
能描述和分析乙醛的重要反应,能书写相应的化学方程式。
C
O
这种原子团叫羰基,如在其一端连接一个氢原子就形成了
C H
O
它叫醛基。
醛基(-CHO)与烃基(或氢原子)相连构成的一类化合物就叫醛,可用通式RCHO表示。
一、醛
1. 醛的定义:
2. 官能团:
或—CHO,醛基
C
O
H
3. 饱和一元醛的通式:
CnH2nO 或 CnH2n+1CHO
4. 代表物:
CH3
C
O
H
H
C
O
H
甲醛 乙醛
从结构上看,由烃基(或氢原子)跟醛基(-CHO)相连而成的化合物叫醛。
5. 醛的分类:
①醛基的个数:一元醛、二元醛、多元醛
②烃基的种类:脂肪醛、脂环醛、芳香醛
③烃基是否饱和:饱和醛、不饱和醛
二、乙醛
1.物理性质
无色、有刺激性气味的液态
易挥发
密度比水小
与水、乙醇等互溶
乙醛(结构简式为CH3CHO)
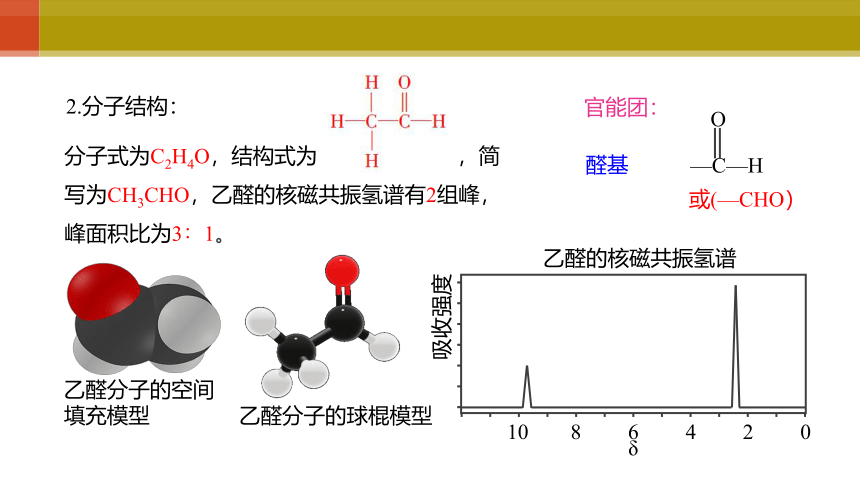
2.分子结构:
分子式为C2H4O,结构式为 ,简写为CH3CHO,乙醛的核磁共振氢谱有2组峰,峰面积比为3∶1。
乙醛的核磁共振氢谱
δ
吸收强度
10
8
6
4
2
0
乙醛分子的空间填充模型
乙醛分子的球棍模型
官能团:
或(—CHO)
醛基
—C—H
O
3.化学性质:
(1)加成反应
①催化加氢又称为还原反应,化学方程式为
乙醛能和一些极性试剂发生加成反应,例如与氢氰酸加成:
2-羟基丙腈
②与HCN加成
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。
—C—H
O
δ-
δ+
通常能与碳氧双键加成:H2、HCN
能与碳碳双键加成:H2、X2、HX、H2O
醛基与极性分子加成时,极性分子中带正电荷的原子或原子团连接在醛基的氧原子上,带负电荷的原子或原子团连接在碳原子上。
(2)氧化反应
①银镜反应
试验现象:试管内壁出现光亮的银镜
【实验3-7】在洁净的试管中加入1 mL 2% AgNO3溶液,然后边振荡边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
银氨溶液的配制方法:
取1 mL 2%的AgNO3溶液于洁净试管中,一边振荡试管,一边逐滴滴入2%的稀氨水,至生成的沉淀恰好完全溶解,制得银氨溶液。
AgNO3+NH3·H2O===AgOH↓+NH4NO3
AgOH+2NH3·H2O===Ag(NH3)2OH+2H2O
实验成功的关键环节:
①试管内壁必须光滑、洁净;
②实验的银氨溶液应现配现用;氨水不能太浓
③必须用水浴加热,不可用酒精灯直接加热;
④加热时不能振荡和摇动试管。
实验后附着的银镜的试管如何洗净?
可用稀硝酸浸泡,再用水洗除去。
②与新制的Cu(OH)2(又叫菲林试剂)反应
实验现象:试管中出现砖红色沉淀
【实验3-8】在试管里加入2 mL10% NaOH溶液,加入5滴5% CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5 mL乙醛溶液,加热。观察实验现象。
说明:
a、必须用新制的Cu(OH)2:一方面,新制的Cu(OH)2为絮状物,跟醛的接触面积大;另一方面,久置的Cu(OH)2,易转变成Cu2(OH)2CO3;
b、制备Cu(OH)2时,NaOH必须过量,且质量分数要大些,这样形成的Cu(OH)2能加快乙醛的氧化使现象明显;
c、该反应必须加热到沸腾,才有明显的红色沉淀产生,但不能太久,否则会有黑色的沉淀CuO生成;
d、用途:检验醛基,医疗上检测尿糖;
(2)氧化反应:体现乙醛的还原性
①可燃性:
2C2H4O+O2
4CO2+H2O
②被强氧化剂氧化:
遇到酸性高锰酸钾溶液和溴水使其褪色
注:必须是溴水,溴的CCl4溶液不会氧化醛基,因为其中不含氧
③催化氧化(加氧):
2CH3CHO+O2
2CH3COOH
④被弱氧化剂氧化:
银镜反应:
CH3CHO+2[Ag(NH3)2]OH 2Ag↓+CH3COONH4+3NH3+H2O
与新制的Cu(OH)2反应:
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
RCH2OH RCHO RCOOH
思考与讨论:
乙醇、乙醛和乙酸三者之间的转化关系如下图所示。请结合具体反应,以及三者的分子结构和官能团的变化情况,谈谈有机反应中的氧化反应和还原反应的特点。
乙醛 乙醛 乙酸
自然界的许多植物中都含有醛,其中有些具有特殊的香味,可作为植物香料使用。
—CH=CH—CHO
肉桂醛
—CHO
苯甲醛
桂皮和杏仁中分别含有肉桂醛和苯甲醛
三、醛类物质的物理性质
1. 熔沸点随碳原子数增多而变大,随支链增多而减小。密度随碳原子数增多而逐渐变大;
2. 随着碳原子数的增多,在水中的溶解度逐渐减小,低级醛易溶于水(CH3CHO、HCHO)
3. 除了甲醛是气体,其他的醛常温下是液体或者固体,有一定气味(或刺激性气味)。
四、醛类物质的化学性质
1. 加成反应(还原反应):与H2、HCN反应;
2. 氧化反应:
(1)燃烧
(2)被高锰酸钾、溴水等强氧化剂氧化
(3)被银氨溶液、新制氢氧化铜等若氧化剂氧化
醛类的两个特征反应及—CHO的检验
特征反应 银镜反应 与新制的Cu(OH)2反应
现象 产生光亮的银镜 产生砖红色沉淀
注意事项 (1)试管内壁必须洁净。 (2)银氨溶液随用随配,不可久置。 (3)水浴加热,不可用酒精灯直接加热。 (4)醛用量不宜太多,如乙醛一般滴3滴。 (5)银镜可用稀硝酸浸泡洗涤除去 (1)新制的Cu(OH)2要随用随配,不可久置。
(2)配制新制的Cu(OH)2时,所用NaOH溶液必须过量
含醛基物质中碳碳双键的检验方法
官能团 醛基 碳碳双键
加入酸性KMnO4溶液 褪色 褪色
加入溴水 褪色 褪色
加入银氨溶液 产生银镜 不反应
加入新制的Cu(OH)2 产生砖红色沉淀 不反应
(1)醛基和碳碳双键性质的比较
(2)含醛基物质中碳碳双键的检验流程
易错警示:
(1)能发生银镜反应的物质不一定是醛类,也可以是甲酸、甲酸酯和葡萄糖等。
(2)配制银氨溶液是向AgNO3稀溶液中逐滴加稀氨水,直到最初生成的沉淀恰好溶解为止,顺序不能颠倒。
(3)银镜反应、与新制的氢氧化铜的反应都必须在碱性条件下进行,若溶液呈酸性,必须先用氢氧化钠溶液中和至碱性。
1. 甲醛
俗名蚁醛,最简单的醛类物质,是一种无色、有强烈刺激性气味的气体,易溶于水,质量分数为35%~40%的水溶液叫做福尔马林,具有防腐和杀菌能力,常作防腐杀菌剂(消毒、浸制标本);制药(农药、消毒剂),香料,染料;制造酚醛树脂、脲醛树脂、维纶等。
五、常见醛——甲醛、丙醛、苯甲醛
结构:
性质 :
与乙醛相似
C
O
H
H
不同点:
①常温下甲醛为无色有刺激性气味的气体。
②甲醛中有2个活泼氢可被氧化。
从结构: H—C—H 分析
O=
(注意:相当于含有两个醛基的特殊结构)
(1)氧化反应:
①被银氨溶液氧化
②被新制Cu(OH)2碱性悬浊液氧化
HCHO+4[Ag(NH3)2]OH 4Ag↓+(NH4)2CO3+6NH3+2H2O
水浴加热
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
加热
(2)加成反应
(3)缩聚反应
还原反应:
n
n
n
n
2. 苯甲醛
(1)组成和结构:
分子式:C6H7O
结构简式:
(2)物理性质:
苯甲醛是最简单的芳香醛,俗称苦杏仁油,是一种有苦杏仁气味的无色液体
(3)用途:
杏仁中含有苯甲醛,苯甲醛是制造染料、香料及药物的重要原料。
(4)化学性质:
①加成反应(还原反应):与H2、HCN反应;
②氧化反应:
I、燃烧
II、被高锰酸钾、溴水等强氧化剂氧化
III、被银氨溶液、新制氢氧化铜等若氧化剂氧化
3. 肉桂醛
(1)组成和结构:
分子式:C9H8O
结构简式:
(2)桂皮中含有肉桂醛。肉桂醛的化学性质主要体现在醛基上
思考与讨论:
(1)由丙醛如何得到1-丙醛或丙酸?
(2)苯甲醛在空气中旧置,在容器内壁会出现苯甲酸的结晶,这是为什么?
六、酮
1.酮的概念和结构特点
酮与醛可能为官能团异构,如丙醛与丙酮互为同分异构体。
酮
概念:羰基与两个羟基相连的化合物
代表物:丙酮( )
官能团:羰基( )
通式:
提示:分子中含相同碳原子数的饱和一元醛与饱和一元酮的分子式相同,结构不同,互为同分异构体。
思考与讨论:
饱和一元醛的通式为CnH2nO(n≥1),饱和一元酮的通式为CnH2nO(n≥3),那么分子中含相同碳原子数的饱和一元醛与饱和一元酮有什么关系
2.丙酮的性质及应用
(1)性质
常温下,丙酮是无色透明的液体,易挥发,能与水、乙醇等互溶。丙酮不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化。在催化剂存在的条件下,丙酮催化加氢的化学方程式为
加氢还原为相应的醇;
不能发生银镜反应;
不与新制Cu(OH)2悬浊液反应
可用于鉴别酮与醛
(2)应用
酮是重要的有机溶剂和化工原料。例如,丙酮可用作化学纤维、钢瓶储存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
思考与讨论:
丙酮是丙醛的同分异构体吗?它们有哪些性质差异?可采用哪些方法鉴别它们?
解答:丙酮与丙醛分子式均为C3H6O,两者互为同分异构体。
丙醛能被弱氧化剂如银氨溶液、新制氢氧化铜氧化,而丙酮却不能,故可采用上述两种试剂鉴别它们。
1. 加成反应
醛+H2→醇
2. 氧化反应
a. 催化氧化
b. 被弱氧化剂氧化(银氨溶液、新制的Cu(OH)2)
乙酸
c. 使酸性高锰酸钾溶液、溴水褪色
d. 燃烧
(还原反应)
乙醛的化学性质
CH3—C—H+H—CN→CH3—CH—CN
O
OH
(2-羟基丙腈)
课堂小结
乙醛的结构
乙醛的物理性质
1.下列物质中不属于醛类的是( )
③CH2=CH—CHO ④Cl—CH2—CHO
A.①③ B.②④ C.②③ D.①④
B
课堂检测
2.下列有关说法正确的是( )
A.醛一定含醛基,含有醛基的物质一定是醛
B.丙醛只有丙酮一种同分异构体
C.醛类物质在常温常压下都为液体或固体
D.含醛基的物质在一定条件下可与H2发生还原反应
D
3.下列说法中,正确的是( )
A.乙醛与苯甲醛互为同系物
B.苯乙醛的结构简式:
C.醛类既能被氧化为羧酸,又能被还原为醇
D.完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量相等
C
4.某学生做乙醛还原性的实验,取1 mol·L-1的硫酸铜溶液2 mL和0.4 mol·L-1的氢氧化钠溶液4 mL,在一个试管中混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无砖红色沉淀,实验失败的原因是( )
A.氢氧化钠的量不够 B.硫酸铜的量不够
C.乙醛溶液太少 D.加热时间不够
A
5.科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如下。下列关于A的说法中正确的是 ( )
A.化合物A的分子式为C15H22O3
B.与FeCl3溶液发生反应后溶液显紫色
C.1 mol A最多可以与2 mol Cu(OH)2反应
D.1 mol A最多与1 mol H2发生加成反应
A
本节内容结束
