3.5.1有机合成的主要任务 课件(共36张PPT)
文档属性
| 名称 | 3.5.1有机合成的主要任务 课件(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-16 22:07:30 | ||
图片预览






文档简介
(共36张PPT)
第1课时 有机合成的主要任务
第三章 烃的衍生物
第五节 有机合成
德国化学家维勒
从远古时代起,人类长期依靠自然界的资源生存。在实践中,人类逐渐学会了对自然资源进行加工和转化,从生物体中获得有机化合物。然而,自然资源是有限的,天然有机物的性能并不能满足人们的全部需要。19世纪20年代,德国化学家维勒合成了尿素,开创了人工合成有机物的新时代。此后,人们陆续合成了多种天然有机物,还合成了大量自然界并不存在的新的有机物,以满足生产、生活和科学研究对物质性质的特殊需要。有机合成帮助人们发现和制备了一系列药物、香料、染料、催化剂、添加剂等,有力地推动了材料科学和生命科学的发展。
学习目标
1. 掌握构建碳骨架的方法和引入官能团的方法及有机物官能团之间的相互转化。
2. 了解有机合成对人类生产、生活的影响。
含义:有机合成使用相对简单易得的原料,通过有机化学反应合成出具有特定结构和性质的目标分子。
学习探究
有机合成
主要任务:构建骨架和引入官能团。
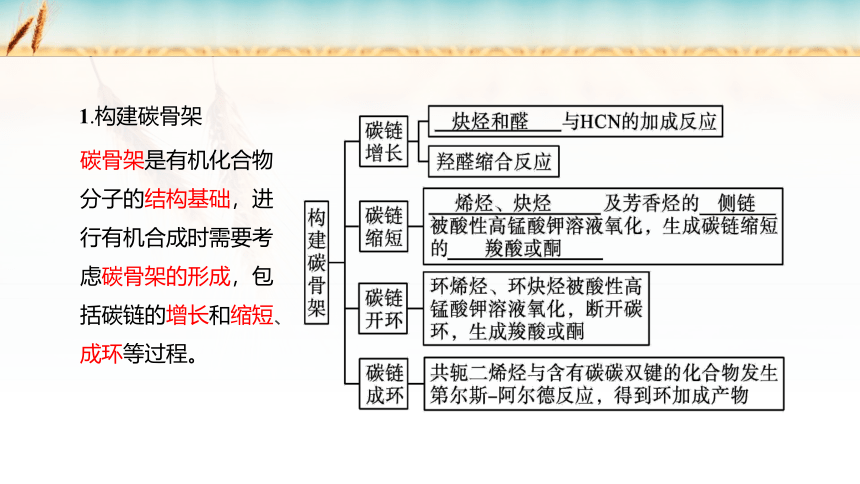
1.构建碳骨架
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长和缩短、成环等过程。
当原料分子中的碳原子数少于目标分子中的碳原子数时,可以通过引入含碳原子的官能团等方式使碳链增长。例如,炔烃和醛中的不饱和键与HCN发生加成反应生成含有氰基(—CN)的物质,再经水解生成羧酸,或经催化加氢还原生成胺。这样,在将羧基、氨基等官能团引入碳链的同时,产物较原料分子增加了一个碳原子。
(1)碳链的增长:
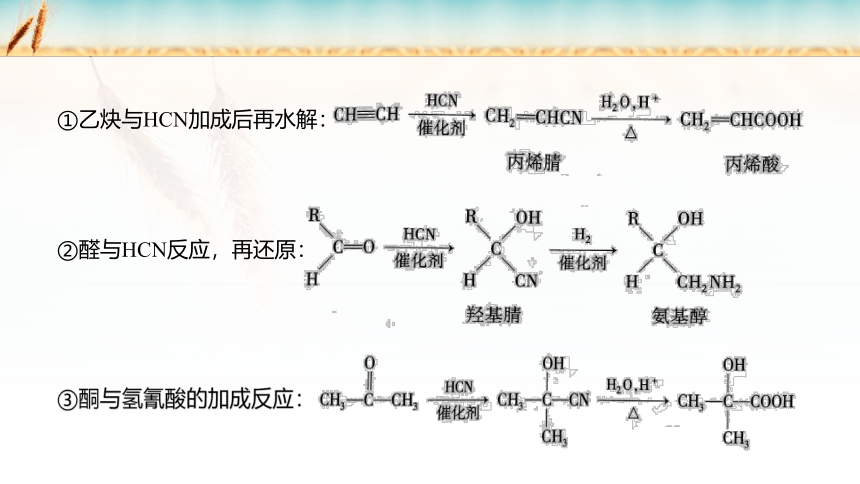
①乙炔与HCN加成后再水解:
②醛与HCN反应,再还原:
③酮与氢氰酸的加成反应:
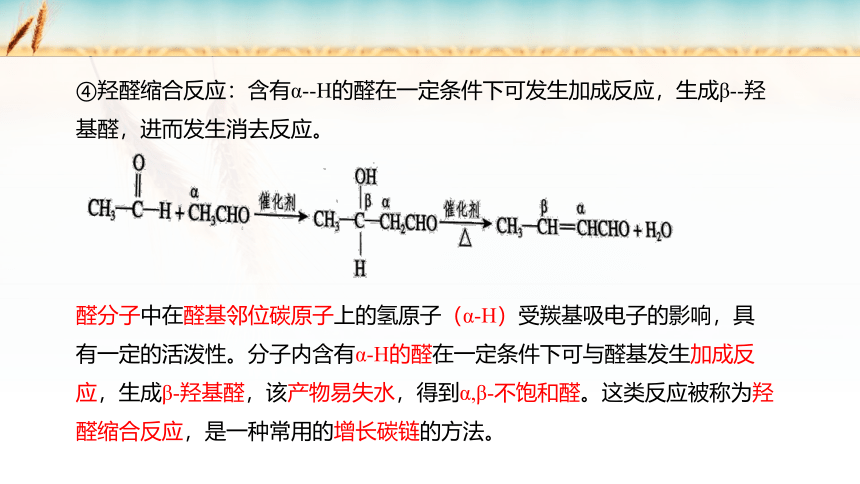
④羟醛缩合反应:含有α -H的醛在一定条件下可发生加成反应,生成β -羟基醛,进而发生消去反应。
醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可与醛基发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
a.卤代烃与NaCN取代;
b.醛、酮与氢氰酸(HCN)加成;
c.羟醛缩合反应等。
碳链增长的三种方法
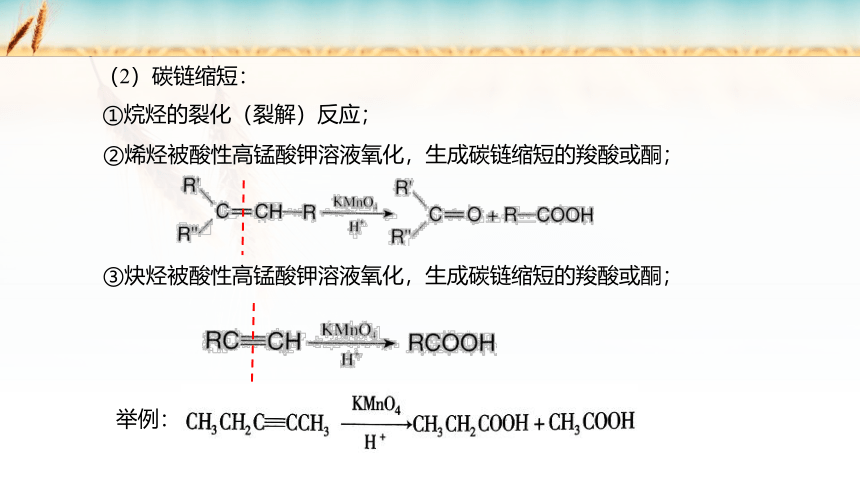
(2)碳链缩短:
①烷烃的裂化(裂解)反应;
②烯烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮;
③炔烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮;
举例:
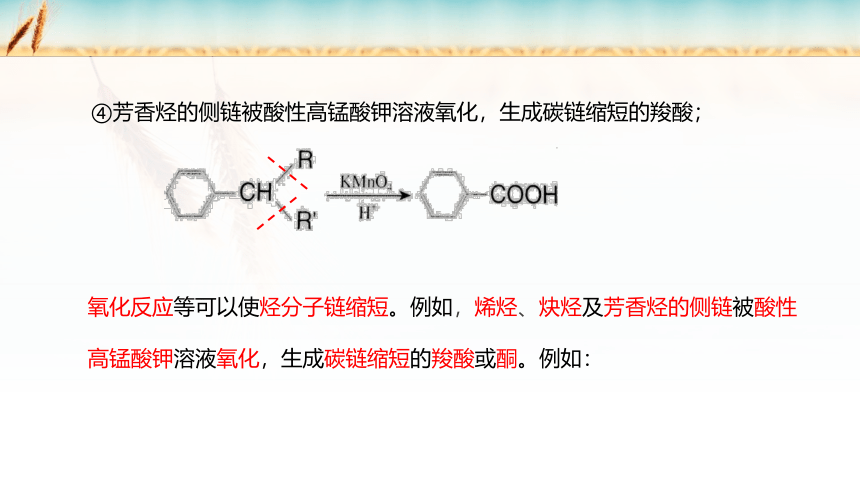
④芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸;
氧化反应等可以使烃分子链缩短。例如,烯烃、炔烃及芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮。例如:
2-甲基-2-丁烯与酸性高锰酸钾溶液反应:
乙苯与酸性高锰酸钾溶液反应:
(3)碳链成环:
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如
1,3 丁二烯)与含碳碳双键的化合物在一定条件下发生第尔斯 阿尔德反应
(Diels Alder reaction),得到环加成产物,构建了环状碳骨架。
1,3-丁二烯与丙烯酸反应:
共轭二烯烃与烯或炔的加成成环和成环酯或环醚等。
形成环酯:
2.引入官能团
常见官能团的引入
官能团 引入方法(举例)
碳碳双键 卤代烃的消去或醇的消去或炔烃的不完全加成
碳卤键 醇、酚的取代或烯烃、炔烃的加成或
烷烃、苯及苯的同系物的取代
羟基 烯烃与水的加成或卤代烃的水解或醛的还原或酯的水解
醛基 醇的催化氧化或烯烃的氧化
羧基 醇的氧化或醛的氧化或酯的水解
酯基 酯化反应
例如:
+Br2
催化剂
—Br+HBr
—CH3+Cl2
光照
—CH2Cl+HCl
CH2=CH—CH3+Cl2
500~600℃
或光照
CH2=CH—CH2Cl+HCl
(1)卤素原子的引入方法:
引入官能团(包括引入、消除)的反应类型常见的有取代、加成、消去、氧化还原等。
①烃与卤素单质的取代反应
+Br2
—Br
—Br
CH2=CH—CH3+Br2
CH2Br—CHBr—CH3
CH2=CH—CH3+HBr
CH3—CHBr—CH3
CH2Br—CH2—CH3
或
CH≡CH+HCl
催化剂
△
CH2=CHCl
例如:
△
R—OH+HX
R—X+H2O
②不饱和烃与卤素单质、卤化氢等的加成反应
例如:
③醇与氢卤酸的取代反应
a. 烯烃水化生成醇。例如:
CH2=CH2+H2O
催化剂
加压,△
CH3—CH2—OH
b. 卤代烃在强碱性水溶液中水解生成醇。例如:
CH3—CH2—Br+NaOH
CH3—CH2—OH+NaBr
水
△
(2)羟基的引入方法:
醇羟基的引入方法
c. 醛或酮与氢气加成生成醇。例如:
d. 酯水解生成醇。例如:
CH3—CHO+H2
Ni
△
CH3—CH2—OH
CH3COCH3+H2
Ni
△
CH3CH(OH)CH3
CH3COOCH2CH3+H2O
H+
△
CH3COOH+CH3CH2OH
烯与H2O加成,卤代烃水解,酯水解,酮、醛与H2加成等。
a. 酚钠盐溶液中通入CO2生成苯酚。例如:
—ONa+CO2+H2O
—OH+NaHCO3
b. 苯的卤代物水解生成苯酚。例如:
—Cl+H2O
一定条件下
—OH+HCl
酚羟基的引入方法
a. 醇的消去反应引入碳碳双键。例如:
CH2=CH2↑+H2O
CH3CH2OH
浓硫酸
170℃
b. 卤代烃的消去反应引入碳碳双键。例如:
CH3CH2Br+NaOH
乙醇
CH2=CH2↑+NaBr+H2O
c. 炔烃与H2、HX、X2的不完全加成(限制物质的量)可得碳碳双键。例如:
CH≡CH+HCl
催化剂
△
CH2=CHCl
(3)碳碳双键和碳氧双键的引入方法:
碳碳双键的引入方法
醇的催化氧化引入碳氧双键。例如:
2RCH2OH+O2
催化剂
△
2RCHO+2H2O
2RCH(OH)R'+O2
催化剂
△
2R—C—R+2H2O
O
(4)碳氧双键的引入方法:
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
△
CH3COONa CH3COOH
H+
2CH3CHO+O2 2CH3COOH
催化剂
△
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
△
(5)羧基的引入方法:
①醛被弱氧化剂氧化。例如:
②醛被氧气氧化成羧酸。例如:
③酯在酸性条件下水解。例如:
④含侧链的芳香烃被强氧化剂氧化。例如:
CH3COOCH2CH3 CH3COOH+CH3CH2OH
H+
△
—CH3
—COOH
KMnO4
H+
⑤伯醇被酸性高锰酸钾溶液氧化的反应:
(6)引入醛基(或酮羰基):
①醇的催化氧化:
2CH3CH2OH+O2
2CH3CHO+2H2O
②某些烯烃被酸性高锰酸钾溶液氧化的反应:
(6)引入酯基:
①加成
不饱和键
②取代、消去、酯化、氧化
羟基
③加成、氧化
醛基
④消去、水解
卤原子
⑤水解
酯基
3.官能团的消除
官能团的转化体现在烃及其衍生物的相互转化关系中:
规律总结
4.官能团的保护
含有多个官能团的有机物在进行反应时,非目标官能团也可能受到影响。此时需要将该官能团保护起来,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。例如,有机合成中的某些反应可能会使羟基受到影响,需要对羟基进行保护。此时,可以先将羟基转化为醚键,使醇转化为在一般反应条件下比较稳定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作用的基团(保护基),恢复羟基。
①酚羟基的保护
因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH转变为—ONa保护起来,待氧化其他基团后再酸化将其转变为—OH。
②碳碳双键的保护
碳碳双键也容易被氧化,在氧化其他基团前可以利用其与卤素单质、卤化氢等的加成反应将其保护起来,待氧化其他基团后再利用消去反应将其转变为碳碳双键。
例如,已知烯烃中 在某些强氧化剂的作用下易发生断裂,因而在有机合成中有时需要对其进行保护,过程可简单表示如下:
③醛基的保护
醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,对其保护和恢复过程为
④官能团数目变化。
通过不同的反应途径增加官能团的个数,如
⑤官能团位置变化。
通过不同的反应,改变官能团的位置,如
【思考与讨论】
举例说明在合成有机化合物时,如何保护碳碳双键
提示:如需氧化含碳碳双键的分子中的羟基时,先让碳碳双键与HX发生加成反应,氧化后再发生消去反应生成碳碳双键,如:
1.已知卤代烃在一定条件下既可发生水解反应,又可发生消去反应,现以2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应是( )
A.消去—加成—取代 B.加成—消去—取代
C.取代—消去—加成 D.取代—加成—消去
A
学习检测
2.下列制备设计错误的是( )
A.以苯为原料制水杨酸(邻羟基苯甲酸),应向苯环上先引入酚羟基
B.制备表面活性剂对十二烷基苯磺酸钠,可向苯环上先引入磺酸基(—SO3H)
C.制备十二烷基苯可以采用1-十二烯在一定条件下与苯加成
D.采用对MgCl2·6H2O在氯化氢气流中加热脱水制无水MgCl2
B
3.在有机合成中官能团的引入或改变是极为重要的,下列说法正确的是
( )
A.甲苯在光照下与Cl2反应,主反应为苯环上引入氯原子
B.引入羟基的方法常有卤代烃和酯的水解、烯烃的加成、醛类的还原
C.将CH2=CH—CH2OH与酸性KMnO4溶液反应即可得到CH2=CH—COOH
D.HC≡CH、(CN)2、CH3COOH三种单体在一定条件下发生加成、酯化反应即可得到
B
本节内容结束
第1课时 有机合成的主要任务
第三章 烃的衍生物
第五节 有机合成
德国化学家维勒
从远古时代起,人类长期依靠自然界的资源生存。在实践中,人类逐渐学会了对自然资源进行加工和转化,从生物体中获得有机化合物。然而,自然资源是有限的,天然有机物的性能并不能满足人们的全部需要。19世纪20年代,德国化学家维勒合成了尿素,开创了人工合成有机物的新时代。此后,人们陆续合成了多种天然有机物,还合成了大量自然界并不存在的新的有机物,以满足生产、生活和科学研究对物质性质的特殊需要。有机合成帮助人们发现和制备了一系列药物、香料、染料、催化剂、添加剂等,有力地推动了材料科学和生命科学的发展。
学习目标
1. 掌握构建碳骨架的方法和引入官能团的方法及有机物官能团之间的相互转化。
2. 了解有机合成对人类生产、生活的影响。
含义:有机合成使用相对简单易得的原料,通过有机化学反应合成出具有特定结构和性质的目标分子。
学习探究
有机合成
主要任务:构建骨架和引入官能团。
1.构建碳骨架
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长和缩短、成环等过程。
当原料分子中的碳原子数少于目标分子中的碳原子数时,可以通过引入含碳原子的官能团等方式使碳链增长。例如,炔烃和醛中的不饱和键与HCN发生加成反应生成含有氰基(—CN)的物质,再经水解生成羧酸,或经催化加氢还原生成胺。这样,在将羧基、氨基等官能团引入碳链的同时,产物较原料分子增加了一个碳原子。
(1)碳链的增长:
①乙炔与HCN加成后再水解:
②醛与HCN反应,再还原:
③酮与氢氰酸的加成反应:
④羟醛缩合反应:含有α -H的醛在一定条件下可发生加成反应,生成β -羟基醛,进而发生消去反应。
醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可与醛基发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
a.卤代烃与NaCN取代;
b.醛、酮与氢氰酸(HCN)加成;
c.羟醛缩合反应等。
碳链增长的三种方法
(2)碳链缩短:
①烷烃的裂化(裂解)反应;
②烯烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮;
③炔烃被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮;
举例:
④芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸;
氧化反应等可以使烃分子链缩短。例如,烯烃、炔烃及芳香烃的侧链被酸性高锰酸钾溶液氧化,生成碳链缩短的羧酸或酮。例如:
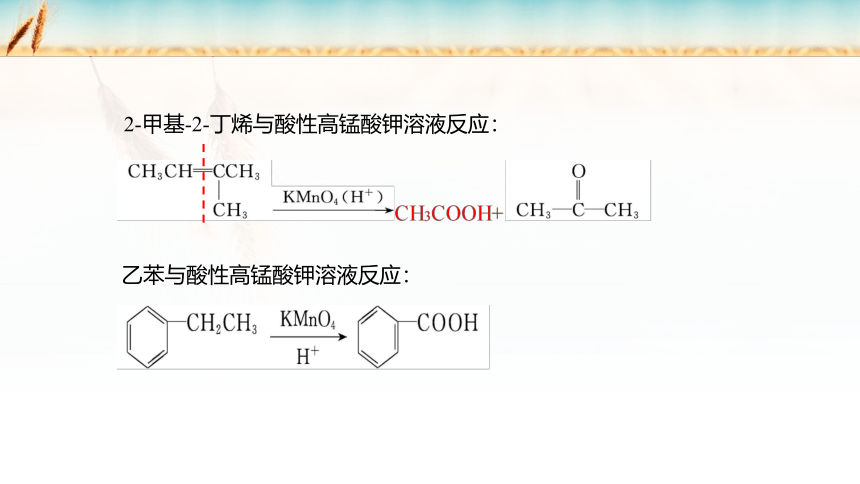
2-甲基-2-丁烯与酸性高锰酸钾溶液反应:
乙苯与酸性高锰酸钾溶液反应:
(3)碳链成环:
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如
1,3 丁二烯)与含碳碳双键的化合物在一定条件下发生第尔斯 阿尔德反应
(Diels Alder reaction),得到环加成产物,构建了环状碳骨架。
1,3-丁二烯与丙烯酸反应:
共轭二烯烃与烯或炔的加成成环和成环酯或环醚等。
形成环酯:
2.引入官能团
常见官能团的引入
官能团 引入方法(举例)
碳碳双键 卤代烃的消去或醇的消去或炔烃的不完全加成
碳卤键 醇、酚的取代或烯烃、炔烃的加成或
烷烃、苯及苯的同系物的取代
羟基 烯烃与水的加成或卤代烃的水解或醛的还原或酯的水解
醛基 醇的催化氧化或烯烃的氧化
羧基 醇的氧化或醛的氧化或酯的水解
酯基 酯化反应
例如:
+Br2
催化剂
—Br+HBr
—CH3+Cl2
光照
—CH2Cl+HCl
CH2=CH—CH3+Cl2
500~600℃
或光照
CH2=CH—CH2Cl+HCl
(1)卤素原子的引入方法:
引入官能团(包括引入、消除)的反应类型常见的有取代、加成、消去、氧化还原等。
①烃与卤素单质的取代反应
+Br2
—Br
—Br
CH2=CH—CH3+Br2
CH2Br—CHBr—CH3
CH2=CH—CH3+HBr
CH3—CHBr—CH3
CH2Br—CH2—CH3
或
CH≡CH+HCl
催化剂
△
CH2=CHCl
例如:
△
R—OH+HX
R—X+H2O
②不饱和烃与卤素单质、卤化氢等的加成反应
例如:
③醇与氢卤酸的取代反应
a. 烯烃水化生成醇。例如:
CH2=CH2+H2O
催化剂
加压,△
CH3—CH2—OH
b. 卤代烃在强碱性水溶液中水解生成醇。例如:
CH3—CH2—Br+NaOH
CH3—CH2—OH+NaBr
水
△
(2)羟基的引入方法:
醇羟基的引入方法
c. 醛或酮与氢气加成生成醇。例如:
d. 酯水解生成醇。例如:
CH3—CHO+H2
Ni
△
CH3—CH2—OH
CH3COCH3+H2
Ni
△
CH3CH(OH)CH3
CH3COOCH2CH3+H2O
H+
△
CH3COOH+CH3CH2OH
烯与H2O加成,卤代烃水解,酯水解,酮、醛与H2加成等。
a. 酚钠盐溶液中通入CO2生成苯酚。例如:
—ONa+CO2+H2O
—OH+NaHCO3
b. 苯的卤代物水解生成苯酚。例如:
—Cl+H2O
一定条件下
—OH+HCl
酚羟基的引入方法
a. 醇的消去反应引入碳碳双键。例如:
CH2=CH2↑+H2O
CH3CH2OH
浓硫酸
170℃
b. 卤代烃的消去反应引入碳碳双键。例如:
CH3CH2Br+NaOH
乙醇
CH2=CH2↑+NaBr+H2O
c. 炔烃与H2、HX、X2的不完全加成(限制物质的量)可得碳碳双键。例如:
CH≡CH+HCl
催化剂
△
CH2=CHCl
(3)碳碳双键和碳氧双键的引入方法:
碳碳双键的引入方法
醇的催化氧化引入碳氧双键。例如:
2RCH2OH+O2
催化剂
△
2RCHO+2H2O
2RCH(OH)R'+O2
催化剂
△
2R—C—R+2H2O
O
(4)碳氧双键的引入方法:
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
△
CH3COONa CH3COOH
H+
2CH3CHO+O2 2CH3COOH
催化剂
△
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
△
(5)羧基的引入方法:
①醛被弱氧化剂氧化。例如:
②醛被氧气氧化成羧酸。例如:
③酯在酸性条件下水解。例如:
④含侧链的芳香烃被强氧化剂氧化。例如:
CH3COOCH2CH3 CH3COOH+CH3CH2OH
H+
△
—CH3
—COOH
KMnO4
H+
⑤伯醇被酸性高锰酸钾溶液氧化的反应:
(6)引入醛基(或酮羰基):
①醇的催化氧化:
2CH3CH2OH+O2
2CH3CHO+2H2O
②某些烯烃被酸性高锰酸钾溶液氧化的反应:
(6)引入酯基:
①加成
不饱和键
②取代、消去、酯化、氧化
羟基
③加成、氧化
醛基
④消去、水解
卤原子
⑤水解
酯基
3.官能团的消除
官能团的转化体现在烃及其衍生物的相互转化关系中:
规律总结
4.官能团的保护
含有多个官能团的有机物在进行反应时,非目标官能团也可能受到影响。此时需要将该官能团保护起来,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。例如,有机合成中的某些反应可能会使羟基受到影响,需要对羟基进行保护。此时,可以先将羟基转化为醚键,使醇转化为在一般反应条件下比较稳定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作用的基团(保护基),恢复羟基。
①酚羟基的保护
因酚羟基易被氧化,所以在氧化其他基团前可以先使其与NaOH反应,把—OH转变为—ONa保护起来,待氧化其他基团后再酸化将其转变为—OH。
②碳碳双键的保护
碳碳双键也容易被氧化,在氧化其他基团前可以利用其与卤素单质、卤化氢等的加成反应将其保护起来,待氧化其他基团后再利用消去反应将其转变为碳碳双键。
例如,已知烯烃中 在某些强氧化剂的作用下易发生断裂,因而在有机合成中有时需要对其进行保护,过程可简单表示如下:
③醛基的保护
醛基可被弱氧化剂氧化,为避免在反应过程中受到影响,对其保护和恢复过程为
④官能团数目变化。
通过不同的反应途径增加官能团的个数,如
⑤官能团位置变化。
通过不同的反应,改变官能团的位置,如
【思考与讨论】
举例说明在合成有机化合物时,如何保护碳碳双键
提示:如需氧化含碳碳双键的分子中的羟基时,先让碳碳双键与HX发生加成反应,氧化后再发生消去反应生成碳碳双键,如:
1.已知卤代烃在一定条件下既可发生水解反应,又可发生消去反应,现以2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应是( )
A.消去—加成—取代 B.加成—消去—取代
C.取代—消去—加成 D.取代—加成—消去
A
学习检测
2.下列制备设计错误的是( )
A.以苯为原料制水杨酸(邻羟基苯甲酸),应向苯环上先引入酚羟基
B.制备表面活性剂对十二烷基苯磺酸钠,可向苯环上先引入磺酸基(—SO3H)
C.制备十二烷基苯可以采用1-十二烯在一定条件下与苯加成
D.采用对MgCl2·6H2O在氯化氢气流中加热脱水制无水MgCl2
B
3.在有机合成中官能团的引入或改变是极为重要的,下列说法正确的是
( )
A.甲苯在光照下与Cl2反应,主反应为苯环上引入氯原子
B.引入羟基的方法常有卤代烃和酯的水解、烯烃的加成、醛类的还原
C.将CH2=CH—CH2OH与酸性KMnO4溶液反应即可得到CH2=CH—COOH
D.HC≡CH、(CN)2、CH3COOH三种单体在一定条件下发生加成、酯化反应即可得到
B
本节内容结束
