第3章有机合成及其应用合成高分子化合物测试卷(含答案)2022-2023学年高二下学期化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 第3章有机合成及其应用合成高分子化合物测试卷(含答案)2022-2023学年高二下学期化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 00:00:00 | ||
图片预览



文档简介
第3章 有机合成及其应用 合成高分子化合物 测试卷
一、单选题
1.下列说法正确的是
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗的氧气多
C.CH4和C2H4的混合气体与足量O2完全反应,反应前后气体体积一定不变(气体体积在同一温度和压强下测量)
D.相同质量的烃完全燃烧,烃中氢的百分含量越高,消耗O2越多
2.某有机物的结构简式为HOCH2CH=CHCH2COOH,下列关于该有机物的说法错误的是
A.该有机物含有3种官能团
B.该有机物能使溴水和酸性高锰酸钾溶液褪色,其褪色原理一样
C.该有机物能发生氧化反应、加成反应、加聚反应、酯化反应
D.1mol该有机物能与2molNa或1molNaOH发生反应
3.高分子M广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如图:
下列说法正确的是
A.物质A是C2H4
B.属于物质B的同系物且相对分子质量比B大14的有机物有4种
C.物质C与乙醇也可以发生缩聚反应
D.合成M的整个过程均发生的是理想的原子经济性反应
4.下列说法正确的是
A.聚合物的单体是
B.反式聚异戊二烯的结构简式为
C.(涤纶)可通过加聚反应制得
D.聚乙烯能使酸性溶液褪色
5.我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列关于黄芩素的说法不正确的是
A.黄芩素可在空气中长时间存放
B.1mol黄芩素可与8mol发生反应
C.黄芩素可使酸性高锰酸钾溶液褪色
D.黄芩素可与NaOH溶液和溶液发生反应
6.山梨酸是一种常用的食品防腐剂,其结构简式为CH3—CH==CH—CH==CH—COOH。下列关于山梨酸性质的叙述中,不正确的是
A.可与钠反应 B.可与碳酸钠溶液反应
C.可与溴的四氯化碳溶液发生取代反应 D.可生成高分子化合物
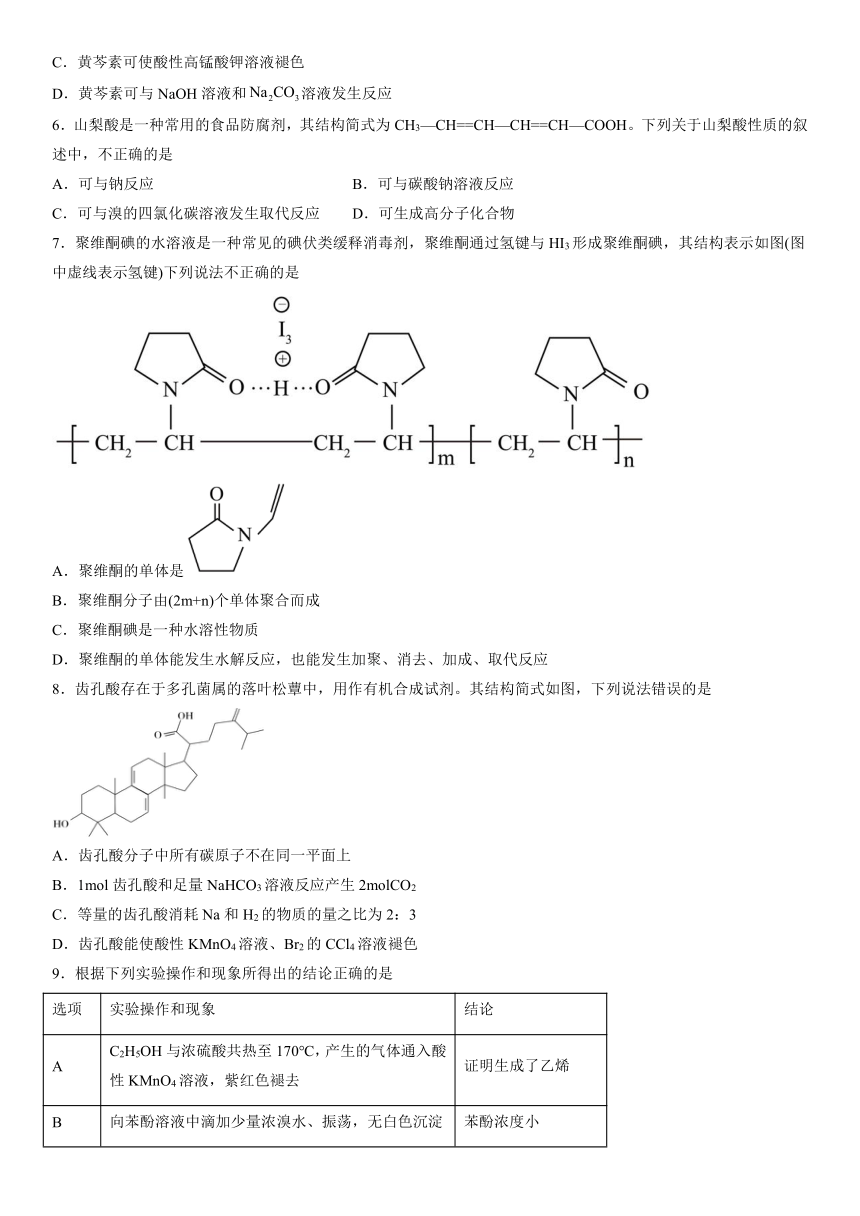
7.聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图(图中虚线表示氢键)下列说法不正确的是
A.聚维酮的单体是
B.聚维酮分子由(2m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质
D.聚维酮的单体能发生水解反应,也能发生加聚、消去、加成、取代反应
8.齿孔酸存在于多孔菌属的落叶松蕈中,用作有机合成试剂。其结构简式如图,下列说法错误的是
A.齿孔酸分子中所有碳原子不在同一平面上
B.1mol齿孔酸和足量NaHCO3溶液反应产生2molCO2
C.等量的齿孔酸消耗Na和H2的物质的量之比为2:3
D.齿孔酸能使酸性KMnO4溶液、Br2的CCl4溶液褪色
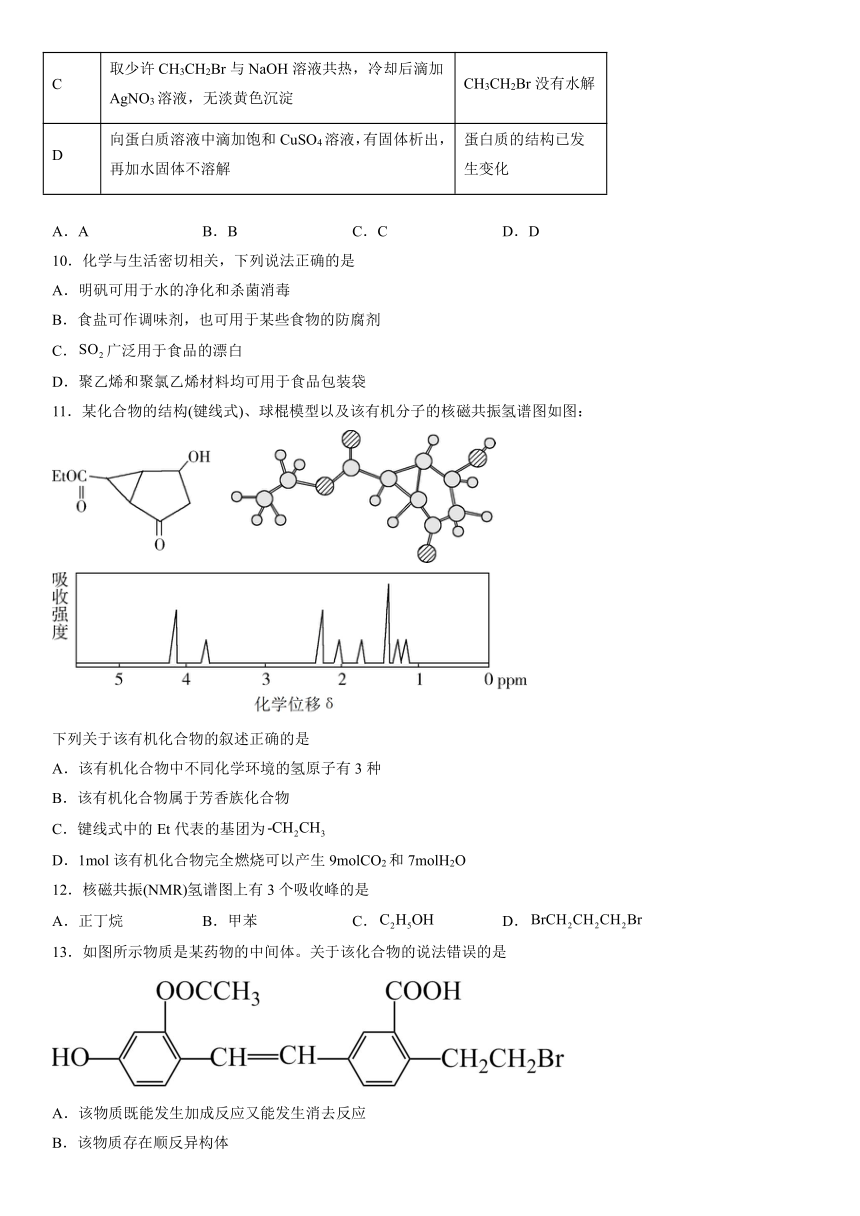
9.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A C2H5OH与浓硫酸共热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 证明生成了乙烯
B 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 苯酚浓度小
C 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,无淡黄色沉淀 CH3CH2Br没有水解
D 向蛋白质溶液中滴加饱和CuSO4溶液,有固体析出,再加水固体不溶解 蛋白质的结构已发生变化
A.A B.B C.C D.D
10.化学与生活密切相关,下列说法正确的是
A.明矾可用于水的净化和杀菌消毒
B.食盐可作调味剂,也可用于某些食物的防腐剂
C.广泛用于食品的漂白
D.聚乙烯和聚氯乙烯材料均可用于食品包装袋
11.某化合物的结构(键线式)、球棍模型以及该有机分子的核磁共振氢谱图如图:
下列关于该有机化合物的叙述正确的是
A.该有机化合物中不同化学环境的氢原子有3种
B.该有机化合物属于芳香族化合物
C.键线式中的Et代表的基团为
D.1mol该有机化合物完全燃烧可以产生9molCO2和7molH2O
12.核磁共振(NMR)氢谱图上有3个吸收峰的是
A.正丁烷 B.甲苯 C. D.
13.如图所示物质是某药物的中间体。关于该化合物的说法错误的是
A.该物质既能发生加成反应又能发生消去反应
B.该物质存在顺反异构体
C.分子中含有3种含氧官能团
D.1mol该物质最多能与4molNaOH反应
14.有科学研究提出:锂电池负极材料(Li)由于生成LiH而不利于电池容量的保持。一定温度下,利用足量重水(D2O)与含LiH的Li负极材料反应,通过测定n(D2)/n(HD)可以获知 n(Li)/n(LiH)。
已知:①LiH+H2O=LiOH+H2↑
②2Li(s)+H2 2LiH △H<0
下列说法不正确的是
A.可用质谱区分D2和HD
B.Li与D2O的反应:2Li+2D2O=2LiOD+D2↑
C.若n(Li)/n(LiH)越大,则n(D2)/n(HD)越小
D.80℃反应所得n(D2)/n(HD)比25℃反应所得n(D2)/n(HD)大
二、填空题
15.碳、氢元素可形成种类繁多的烃类物质。
(1)如图表示某些烃分子的模型:
①c分子中的一个氢原子被C6H5-取代后的物质共直线的原子最多有_______个。
②取等质量的上述三种烃充分燃烧,耗氧量最大的是_______(填分子式)。
③25℃和101kPa时,取a、b和c组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了56mL,则原混合烃中c的体积分数为_______。
(2)现有分子式是C11H16的烷基取代苯,它可以被氧化为的同分异构体共有_______种,并写出一种不能被氧化为的同分异构体的结构简式_______。
16.已知,I是一种有机物形成的盐,则I的结构简式为_______
17.1,4-二氧杂环己烷(又称1,4-二氧六环或1,4-二恶烷,)是一种常用的溶剂,在医药、化妆品、香料等精细化学品的生产中有广泛应用。请以乙烯为基础原料,使用逆合成分析法设计它的合成路线____________。(提示:参考乙醇分子间脱水生成乙醚的反应。)
18.已知:。参照上述合成路线,以和为原料,设计合成的路线_______(无机试剂任选)。
19.按要求回答下列问题:
(1)中含有官能团的名称为___________;
(2)2-甲基-1-丁烯的结构简式___________;
(3)相对分子质量为72且一氯代物只有一种的烷烃的结构简式___________;
(4)的分子式为___________。
(5)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是___________;
A.红外光谱 B.核磁共振氢谱 C.元素分析仪 D.与钠反应
(6)在物质鉴别时,常用溴水来鉴别烷烃和烯烃,请写出乙烯使溴水褪色的反应方程式: ___________
20.0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol。请回答下列问题:
(1)烃A的分子式为_______。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为_______。
(3)若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。
①A的结构简式为_______;名称是_______。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式_______。
(4)若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:_______。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有_______种(不考虑顺反异构),其中只含有一个甲基的结构简式为_______。
21.为了测定某饱和卤代烃的分子中卤素原子的种类和数目,可按如图步骤进行实验:
回答下列问题:
(1)加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤素原子是_______。
(2)已知此卤代烃液体的密度是1.65 g·mL-1,其蒸气对甲烷的相对密度是11.75,则每个此卤代烃分子中卤素原子的数目为_______;此卤代烃的结构简式为_______。
22.某芳香烃A的质谱图如图所示:
(1)A的名称为___________。
(2)A的一氯代物共有___________种。
(3)A分子中最多有___________个原子共平面。
(4)已知9.2gA在足量中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重___________g、___________g。
(5)A分子的核磁共振氢谱有___________组峰,峰面积之比为___________。
23.糖类、蛋白质属于营养物质。
(1)蔗糖是重要的二糖,在一定条件下会发生水解反应。
①为检验蔗糖的水解产物,需要配制银氨溶液,实验室由2%的液和2%的氨水配制银氨溶液的过程为______。
②补充完整验证蔗糖水解产物中含有葡萄糖的实验方案:取少量的10%的蔗糖溶液于试管中,向其中滴加10%的溶液,______。(实验中须使用的试剂有:10%的NaOH溶液、银氨溶液、pH试纸)
(2)氨基酸是构成蛋白质的基石,天然蛋白质水解所得氨基酸为α-氨基酸。写出最简单的α-氨基酸的结构简式:______。
(3)利用李比希法、现代分析仪器测定等可以确定有机物的结构。1.16g有机物A(只含C、H、O三种元素中的两种或三种)在过量氧气中燃烧,将燃烧后的产物依次通过浓硫酸和碱石灰,测得浓硫酸和碱石灰的增重分别为1.08g和2.64g。
①有机物A的最简式为______。
②有机物A的质谱图、核磁共振氢谱图分别如下图所示:
有机物A的结构简式为______。
参考答案:
1.D
【详解】A.有机物燃烧只生成CO2和H2O,且二者物质的量相等,只能说明有机物的组成中碳氢原子个数比为1∶2,不能确定有无氧元素,选项A错误;
B.1mol乙烯和1mol乙醇完全燃烧都消耗3mol氧气,完全燃烧消耗的氧气一样多,故B错误;
C.高于100℃条件下,水为气体,烃中的H原子数为4时,反应前后气体体积不变,则在高于100°C条件下,燃烧甲烷和乙烯的混合气体,前后气体体积不变;低于100℃条件下,水为液体,则反应前后的体积会变化,C错误;
D.12g碳可以消耗1mol氢气,4g氢可以消耗1mol氢气,所以质量相同时,氢元素的质量分数越高消耗的氧气越多,D正确;
故选D。
2.B
【详解】A.由有机物HOCH2CH=CHCH2COOH的结构简式可知,该有机物含有羟基、碳碳双键、羧基3种官能团,故A正确;
B.该有机物能使溴水和酸性高锰酸钾溶液褪色,其褪色原理不一样,前者发生加成反应,后者发生氧化反应,故B错误;
C.由有机物HOCH2CH=CHCH2COOH的结构简式可知,该有机物含有羟基、碳碳双键和羧基,因此该有机物能发生氧化反应、加成反应、加聚反应、酯化反应,故C正确;
D.羟基和羧基与都能与金属钠反应生成氢气,所以1molHOCH2CH=CHCH2COOH能与2molNa、1molNaOH发生反应,故D正确;
故答案:B。
3.B
【详解】A.由流程分析可知,M的单体B为CH2=CHOCH3,A和甲醇加成生成B,则A为乙炔,化学式为C2H2,A错误;
B.同系物是指结构相似、分子组成相差若干个“CH2”原子团的有机化合物;属于物质B的同系物且相对分子质量比B大14的有机物有CH2=C(CH3)OCH3、CH2=CHCH2OCH3、CH3CH=CHOCH3、CH2=CHOCHCH3,共4种,B正确;
C.乙醇分子中只有1个羟基,不能和C发生缩聚反应,C错误;
D.C脱水的过程中生成水,部分氢氧原子没有被利用,故不是理想的原子经济性反应,D错误;
故选B。
4.A
【详解】A. 聚合物的单体是,故A正确;
B. 为顺式聚异戊二烯的结构简式,故B错误;
C. (涤纶)可通过缩聚反应制得,反应产物中生成小分子水,故C错误;
D. 聚乙烯中没有不饱和键,不能使酸性溶液褪色,故D错误;
故选A。
5.A
【详解】A.黄芩素含有酚羟基,易被氧化,不能在空气中长时间存放,故A错误;
B.黄芩素中的碳碳双键、碳氧双键和苯环都能与氢气发生加成反应,故1mol黄芩素可与8mol发生反应,故B正确;
C.黄芩素中含有碳碳双键,能被酸性高能酸钾溶液氧化,故C正确;
D.黄芩素含有酚羟基,能与NaOH溶液和溶液发生反应,故D正确;
故选A。
6.C
【详解】A.分子中含—COOH,与Na反应生成氢气,故A不选;
B.分子中含—COOH,与碳酸钠反应生成二氧化碳,B不选;
C.分子中含碳碳双键,与溴的四氯化碳溶液发生加成反应,C可选;
D.分子中含碳碳双键,可发生加聚反应生成高分子化合物,D不选;
故选C。
7.D
【详解】A.由聚维酮碘的分子结构知,聚维酮由加聚反应制得,其单体为,选项A正确;
B.由聚维酮碘的分子结构知,聚维酮分子中左侧链节由2个单体构成,因此,聚维酮分子由2m+n个单体聚合而成,选项B正确;
C.由题干信息“聚维酮碘的水溶液”知,聚维酮碘能溶于水,选项C正确;
D.由聚维酮碘的分子结构知,聚维酮由加聚反应制得,其单体为,该单体分子中含有碳碳双键、肽键,能发生水解反应,也能发生加聚反应、加成反应、取代反应,但不能发生消去反应,选项D不正确;
答案选D。
8.B
【详解】A.分子中含有四面体碳原子,所以分子中所有碳原子不在同一平面上,故A正确;
B.1个齿孔酸分子中含有1个羧基,1mol齿孔酸和足量溶液反应产生1mol,故B错误;
C.羟基、羧基能与钠反应,1mol齿孔酸消耗2molNa,碳碳双键能与发生加成反应,1mol齿孔酸消耗3mol,故C正确;
D.齿孔酸中的碳碳双键和醇羟基能使酸性溶液褪色,齿孔酸中的碳碳双键能使的溶液褪色,故D正确;
选B。
9.D
【详解】A.反应中生成杂质气体二氧化硫也能使酸性高锰酸钾溶液褪色,故不能证明生成了乙烯,A错误;
B.向苯酚溶液中滴加少量浓溴水、振荡,生成的三溴苯酚溶于苯酚,观察不到白色沉淀,B错误;
C.过量氢氧化钠也会和硝酸银反应,故应该酸化后滴加硝酸银溶液,C错误;
D.重金属盐能使蛋白质变性,向蛋白质溶液中滴加饱和CuSO4溶液,有固体析出,再加水固体不溶解,则蛋白质的结构已发生变化,D正确;
故选D。
10.B
【详解】A.明矾水解产生氢氧化铝胶体可用于水的净化,但不能杀菌消毒,A错误;
B.食盐可用于调味,也可用于某些食物的防腐剂,用食盐腌制食物延长保质期,B正确;
C.SO2广泛用于草帽纸浆等的漂白,但食品中不能广泛使用,C错误;
D.聚氯乙烯材料不可用于食品包装袋,D错误;
答案选B。
11.C
【详解】A.由题图可知,该有机化合物分子的核磁共振氢谱图中有8组峰,故含有8种化学环境的H原子,A错误;
B.根据该有机化合物的键线式可知分子中不含苯环,不属于芳香族化合物,B错误;
C.由键线式及球棍模型可知,Et代表-CH2CH3,C正确;
D.该有机化合物的分子式为C9H12O4,1molC9H12O4, 1 mol该有机化合物完全燃烧可以产生9 molCO2和6 mol H2O,D错误。
答案选C。
12.C
【详解】A.CH3CH2CH2CH3中有2种氢原子,核磁共振氢谱中有2个吸收峰,A错误;
B.中有4种氢原子,核磁共振氢谱中有4个吸收峰,B错误;
C.中有3种氢原子,核磁共振氢谱中有3个吸收峰,C正确;
D.中有2种氢原子,核磁共振氢谱中有2个吸收峰,D错误;
故选C。
13.D
【详解】A.该物质含有碳碳双键,能发生加成反应,含有溴原子且溴原子链接的碳原子的邻位碳上有氢原子,所以能发生消去反应,A正确,不符合题意;
B.形成碳碳双键的碳原子都链接不同的部分,所以有顺反异构体,B正确,不符合题意;
C.含有羟基,和酯基和羧基三种含氧官能团,C正确,不符合题意;
D.酚羟基和羧基能和氢氧化钠反应,酯基水解都出酚羟基和羧基都能和氢氧化钠反应,溴原子也能和氢氧化钠发生反应,故1mol该物质最多能与5molNaOH反应,D错误,符合题意;
故选D。
14.C
【详解】A.D2和HD的相对分子质量不同,可以用质谱区分,A正确;
B.类似于钠和水的反应, Li与D2O反应生成LiOD与D2,化学方程式是2Li+2D2O=2LiOD+D2↑,B正确;
C.D2由Li与D2O反应生成,HD 通过反应LiH+D2O=LiOD+HD, n(D2)/n(HD)越大,n(Li)/n(LiH)越大,C不正确;
D.升温,2LiH 2Li+H2 △H>0平衡右移,Li增多LiH 减少,则结合选项C可知:80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD) ,D正确;
答案为:C。
15.(1) 6 CH4 50%
(2) 8
【解析】(1)
①乙炔分子四原子共直线,苯分子中存在对顶角两个碳原子和两个氢原子共四原子共直线,所以乙炔分子中的一个氢原子被C6H5—取代后的物质共直线的原子最多有6个;
②等质量的烃含氢质量分数越大,耗氧量越大,所以等质量的甲烷、乙烯和乙炔充分燃烧,耗氧量最大的是CH4;
③25℃和101kPa时,根据烃CxHy燃烧通式,
,解得y=3,因为CH4和C2H4都含有4个碳原子,C2H2含有2个碳原子,设C2H2所占的体积分数为x,则CH4和C2H4占(1-x),所以4(1-x)+2x=3,解得x=0.5,即原混合烃中c的体积分数为50%;
因此,本题正确答案为:6;CH4;50%;
(2)
分子式为的烷基一取代苯,R基为,其结构可能为、、、、、、、,共8种。其中不能被氧化为苯甲酸的有一种,即,可以被氧化为苯甲酸的同分异构体共7种。
16.
【详解】对比G的结构简式和H的分子式可知,H中引入了1个,而少了1个O和1个H,G和H的不饱和度没有变化,结合反应条件为“、甲苯”,再观察J的结构简式可以推出是被取代的过程,即H的结构简式为,再结合J的结构简式和I的分子式可知,J的右半部分为I反应后的结果,根据题干信息“I是一种有机物形成的盐”,故I的结构简式为;故答案为。
17.CH2=CH2CH2BrCH2BrHOCH2CH2OH
【详解】以乙烯为原料制备1,4-二氧六环,可由乙二醇发生取代反应得到,乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,其合成路线为CH2=CH2CH2BrCH2BrHOCH2CH2OH。
18.
【详解】参照合成路线,在一定条件下与氢气发生加成反应生成,在铜的催化下与氧气发生氧化反应生成,与在碱性条件下与反应生成,在碱的作用下转化为,合成路线如下:。
19. 羟基、酯基 C6H12 C CH2=CH2+Br2CH2BrCH2Br
【详解】(1)由结构简式 可知含有官能团的名称为羟基、酯基;故答案为:羟基、酯基;
(2)由系统命名法可知2-甲基-1-丁烯的结构简式为 ;故答案为: ;
(3)由烷烃的通式CnH2n+2可得相对分子质量为72的烷烃为C5H12,同分异构体有CH3CH2CH2CH2CH3,(CH3)2CHCH2CH3,,一氯代物只有一种的烷烃的结构简式为;故答案为:;
(4)的分子式为C6H12;故答案为:C6H12;
(5) A.红外光谱可以测定官能团的种类,乙醇和甲醚所含官能团不同,可以用此法区别,故A不合题意;
B.核磁共振氢谱可以测定氢原子的种类和个数,乙醇和甲醚所含氢原子种类不同,可以用此法区别,故B不合题意;
C.元素分析仪是分析元素的种类,乙醇和甲醚都是含有C、H、O三种元素,不能用元素分析仪区别,故C符合题意;
D.乙醇可以与钠反应,甲醚和钠不反应,可以用钠区别二者,故D不符合题意;
故答案为C;
(6) 乙烯使溴水褪色是因为发生加成反应,反应方程式为:CH2=CH2+Br2CH2BrCH2Br;故答案为:CH2=CH2+Br2CH2BrCH2Br。
20. C6H12 2,3-二甲基-2-丁烯 n (CH3)2C=C(CH3)2→ (CH3CH2)2C=CH2 3种 CH2=CHCH2CH3
【分析】(1)0.2mol烃A在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则1mol烃中含有6molC,12molH原子,A分子式为C6H12;(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷;若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。说明该烯烃结构对称,分子中只有一种氢原子,根据题给条件来分析(4)、(5)题。
【详解】(1)烃含有C、H两种元素,0.2mol烃A在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,根据原子守恒可知1mol烃中含有6molC,12molH原子,则A的分子式为C6H12,故答案为:C6H12;
(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷,结构简式为,故答案为:;
(3) 若烃A可与HBr加成,说明分子内含有双键,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种,说明结构对称,只有一种氢原子,①则其结构简式为,其名称为2,3-二甲基-2-丁烯
②A在一定条件下能发生加聚反应,其化学方程式为 n(CH3)2C=C(CH3)2→,故答案为 2,3-二甲基-2-丁烯 n(CH3)2C=C(CH3)2→;
(4) 若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:CH3CH2CH=CHCH2CH3或(CH3CH2)2C=CH2,故答案为:(CH3CH2)2C=CH2;
(5) 比A少两个碳原子的A的烯烃同系物是丁烯,其同分异构体共有3种,其结构简式为CH2=CHCH2CH3, CH3CH=CHCH3,CH2=C(CH3) 2,不考虑顺反异构),其中只含有一个甲基的结构简式为CH2=CHCH2CH3,故答案为 3 CH2=CHCH2CH3
21. 溴原子 2 CH2BrCH2Br或CH3CHBr2
【分析】测定某饱和卤代烃的分子中卤素原子的种类和数目思路:取卤代烃加NaOH水溶液共热使其水解产生卤素离子,加过量硝酸溶液中和NaOH并制造酸性环境,然后加硝酸银产生卤化银,根据卤化银的颜色判断卤代烃中卤素原子种类,再通过卤化银物质的量和卤代烃物质的量关系确定卤代烃中卤素原子的个数。
【详解】(1)因加入AgNO3溶液时产生的沉淀为浅黄色,故卤代烃中卤素原子为溴原子;
(2)溴代烃的质量为11.40 mL×1.65 g·mL-1=18.81 g,摩尔质量为16×11.75 g·mol-1=188g·mol-1,因此溴代烃的物质的量为≈0.1 mol。n(AgBr)==0.2 mol。故每个卤代烃分子中溴原子数目为2;根据相对分子质量判断其分子式为C2H4Br2,其结构简式可能为CH2BrCH2Br或CH3CHBr2。
22. 甲苯 4 13 30.8 4 1:2:2:3
【详解】(1)根据A为芳香烃可知A含苯环,根据质荷比最大值为92可知A的相对分子质量为92,用商余法知A的分子式为C7H8,A为甲苯。故答案为:甲苯;
(2)甲苯中苯环上的一氯代物有3种,即氯原子取代与甲基相邻、相间、相对的位置上的氢原子,甲基上还有1种,即氯原子取代甲基上的氢原子,共4种。故答案为:4;
(3)苯的所有原子共平面,甲烷分子中与碳原子共平面的氢原子最多有两个,甲苯是由甲基取代苯的一个氢原子构成的,所以最多有13个原子共平面。故答案为:13;
(4)9.2 g甲苯的物质的量是0.1mol,完全燃烧可得和,即和。故答案为:7.2;30.8;
(5)甲苯分子中有4种氢,A分子的核磁共振氢谱有4组峰,峰面积之比为1:2:2:3。故答案为:4;1:2:2:3。
23. 向2%的AgNO3液中逐滴滴加2%的氨水,至生成的沉淀恰好完全溶解 (水浴)加热一段时间,向溶液中加入10%的NaOH溶液至用pH试纸测得溶液呈碱性,向溶液加入银氨溶液,水浴加热,试管壁上出现光亮的银镜 H2NCH2COOH C3H6O CH3COCH3
【详解】(1)①氨水和硝酸银反应生成AgOH,AgOH继续与氨水反应生成银氨络离子,所以配制银氨溶液的操作为:向2%的AgNO3液中逐滴滴加2%的氨水,至生成的沉淀恰好完全溶解;
②银镜反应需要在碱性环境中进行,所以实验方案为:取少量的10%的蔗糖溶液于试管中,向其中滴加10%的H2SO4溶液(水浴)加热一段时间,向溶液中加入10%的NaOH溶液至用pH试纸测得溶液呈碱性,向溶液加入银氨溶液,水浴加热,试管壁上出现光亮的银镜;
(2)根据α-氨基酸的定义可知最简单的α-氨基酸为H2NCH2COOH;
(3)①浓硫酸的增重即为燃烧生成水的质量,所以有机物中n(H)==0.12mol,m(H)=0.12g,碱石灰的增重为燃烧生成的CO2的质量,所以有机物中n(C)==0.06mol,m(C)=0.72g,0.12g+0.72g=0.84g<1.16g,则有机物中还含有O元素,且n(O)==0.02mol,所以有机物A中n(C):n(H):n(O)=0.06mol:0.12mol:0.02mol=3:6:1,所以有机物A的最简式为C3H6O;
②根据质谱图可知该物质的相对分子质量为60,则最简式即为该物质的分子式,核磁共振氢谱显示只有一种环境的氢原子,所以该物质的结构简式为CH3COCH3。
一、单选题
1.下列说法正确的是
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗的氧气多
C.CH4和C2H4的混合气体与足量O2完全反应,反应前后气体体积一定不变(气体体积在同一温度和压强下测量)
D.相同质量的烃完全燃烧,烃中氢的百分含量越高,消耗O2越多
2.某有机物的结构简式为HOCH2CH=CHCH2COOH,下列关于该有机物的说法错误的是
A.该有机物含有3种官能团
B.该有机物能使溴水和酸性高锰酸钾溶液褪色,其褪色原理一样
C.该有机物能发生氧化反应、加成反应、加聚反应、酯化反应
D.1mol该有机物能与2molNa或1molNaOH发生反应
3.高分子M广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如图:
下列说法正确的是
A.物质A是C2H4
B.属于物质B的同系物且相对分子质量比B大14的有机物有4种
C.物质C与乙醇也可以发生缩聚反应
D.合成M的整个过程均发生的是理想的原子经济性反应
4.下列说法正确的是
A.聚合物的单体是
B.反式聚异戊二烯的结构简式为
C.(涤纶)可通过加聚反应制得
D.聚乙烯能使酸性溶液褪色
5.我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列关于黄芩素的说法不正确的是
A.黄芩素可在空气中长时间存放
B.1mol黄芩素可与8mol发生反应
C.黄芩素可使酸性高锰酸钾溶液褪色
D.黄芩素可与NaOH溶液和溶液发生反应
6.山梨酸是一种常用的食品防腐剂,其结构简式为CH3—CH==CH—CH==CH—COOH。下列关于山梨酸性质的叙述中,不正确的是
A.可与钠反应 B.可与碳酸钠溶液反应
C.可与溴的四氯化碳溶液发生取代反应 D.可生成高分子化合物
7.聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图(图中虚线表示氢键)下列说法不正确的是
A.聚维酮的单体是
B.聚维酮分子由(2m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质
D.聚维酮的单体能发生水解反应,也能发生加聚、消去、加成、取代反应
8.齿孔酸存在于多孔菌属的落叶松蕈中,用作有机合成试剂。其结构简式如图,下列说法错误的是
A.齿孔酸分子中所有碳原子不在同一平面上
B.1mol齿孔酸和足量NaHCO3溶液反应产生2molCO2
C.等量的齿孔酸消耗Na和H2的物质的量之比为2:3
D.齿孔酸能使酸性KMnO4溶液、Br2的CCl4溶液褪色
9.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A C2H5OH与浓硫酸共热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 证明生成了乙烯
B 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 苯酚浓度小
C 取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液,无淡黄色沉淀 CH3CH2Br没有水解
D 向蛋白质溶液中滴加饱和CuSO4溶液,有固体析出,再加水固体不溶解 蛋白质的结构已发生变化
A.A B.B C.C D.D
10.化学与生活密切相关,下列说法正确的是
A.明矾可用于水的净化和杀菌消毒
B.食盐可作调味剂,也可用于某些食物的防腐剂
C.广泛用于食品的漂白
D.聚乙烯和聚氯乙烯材料均可用于食品包装袋
11.某化合物的结构(键线式)、球棍模型以及该有机分子的核磁共振氢谱图如图:
下列关于该有机化合物的叙述正确的是
A.该有机化合物中不同化学环境的氢原子有3种
B.该有机化合物属于芳香族化合物
C.键线式中的Et代表的基团为
D.1mol该有机化合物完全燃烧可以产生9molCO2和7molH2O
12.核磁共振(NMR)氢谱图上有3个吸收峰的是
A.正丁烷 B.甲苯 C. D.
13.如图所示物质是某药物的中间体。关于该化合物的说法错误的是
A.该物质既能发生加成反应又能发生消去反应
B.该物质存在顺反异构体
C.分子中含有3种含氧官能团
D.1mol该物质最多能与4molNaOH反应
14.有科学研究提出:锂电池负极材料(Li)由于生成LiH而不利于电池容量的保持。一定温度下,利用足量重水(D2O)与含LiH的Li负极材料反应,通过测定n(D2)/n(HD)可以获知 n(Li)/n(LiH)。
已知:①LiH+H2O=LiOH+H2↑
②2Li(s)+H2 2LiH △H<0
下列说法不正确的是
A.可用质谱区分D2和HD
B.Li与D2O的反应:2Li+2D2O=2LiOD+D2↑
C.若n(Li)/n(LiH)越大,则n(D2)/n(HD)越小
D.80℃反应所得n(D2)/n(HD)比25℃反应所得n(D2)/n(HD)大
二、填空题
15.碳、氢元素可形成种类繁多的烃类物质。
(1)如图表示某些烃分子的模型:
①c分子中的一个氢原子被C6H5-取代后的物质共直线的原子最多有_______个。
②取等质量的上述三种烃充分燃烧,耗氧量最大的是_______(填分子式)。
③25℃和101kPa时,取a、b和c组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了56mL,则原混合烃中c的体积分数为_______。
(2)现有分子式是C11H16的烷基取代苯,它可以被氧化为的同分异构体共有_______种,并写出一种不能被氧化为的同分异构体的结构简式_______。
16.已知,I是一种有机物形成的盐,则I的结构简式为_______
17.1,4-二氧杂环己烷(又称1,4-二氧六环或1,4-二恶烷,)是一种常用的溶剂,在医药、化妆品、香料等精细化学品的生产中有广泛应用。请以乙烯为基础原料,使用逆合成分析法设计它的合成路线____________。(提示:参考乙醇分子间脱水生成乙醚的反应。)
18.已知:。参照上述合成路线,以和为原料,设计合成的路线_______(无机试剂任选)。
19.按要求回答下列问题:
(1)中含有官能团的名称为___________;
(2)2-甲基-1-丁烯的结构简式___________;
(3)相对分子质量为72且一氯代物只有一种的烷烃的结构简式___________;
(4)的分子式为___________。
(5)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是___________;
A.红外光谱 B.核磁共振氢谱 C.元素分析仪 D.与钠反应
(6)在物质鉴别时,常用溴水来鉴别烷烃和烯烃,请写出乙烯使溴水褪色的反应方程式: ___________
20.0.2mol某烃A在氧气中充分燃烧后,生成化合物B、C各1.2mol。请回答下列问题:
(1)烃A的分子式为_______。
(2)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则烃A的结构简式为_______。
(3)若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。
①A的结构简式为_______;名称是_______。
②A在一定条件下能发生加聚反应,写出该反应的化学方程式_______。
(4)若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:_______。
(5)比A少两个碳原子的A的烯烃同系物的同分异构体共有_______种(不考虑顺反异构),其中只含有一个甲基的结构简式为_______。
21.为了测定某饱和卤代烃的分子中卤素原子的种类和数目,可按如图步骤进行实验:
回答下列问题:
(1)加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤素原子是_______。
(2)已知此卤代烃液体的密度是1.65 g·mL-1,其蒸气对甲烷的相对密度是11.75,则每个此卤代烃分子中卤素原子的数目为_______;此卤代烃的结构简式为_______。
22.某芳香烃A的质谱图如图所示:
(1)A的名称为___________。
(2)A的一氯代物共有___________种。
(3)A分子中最多有___________个原子共平面。
(4)已知9.2gA在足量中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重___________g、___________g。
(5)A分子的核磁共振氢谱有___________组峰,峰面积之比为___________。
23.糖类、蛋白质属于营养物质。
(1)蔗糖是重要的二糖,在一定条件下会发生水解反应。
①为检验蔗糖的水解产物,需要配制银氨溶液,实验室由2%的液和2%的氨水配制银氨溶液的过程为______。
②补充完整验证蔗糖水解产物中含有葡萄糖的实验方案:取少量的10%的蔗糖溶液于试管中,向其中滴加10%的溶液,______。(实验中须使用的试剂有:10%的NaOH溶液、银氨溶液、pH试纸)
(2)氨基酸是构成蛋白质的基石,天然蛋白质水解所得氨基酸为α-氨基酸。写出最简单的α-氨基酸的结构简式:______。
(3)利用李比希法、现代分析仪器测定等可以确定有机物的结构。1.16g有机物A(只含C、H、O三种元素中的两种或三种)在过量氧气中燃烧,将燃烧后的产物依次通过浓硫酸和碱石灰,测得浓硫酸和碱石灰的增重分别为1.08g和2.64g。
①有机物A的最简式为______。
②有机物A的质谱图、核磁共振氢谱图分别如下图所示:
有机物A的结构简式为______。
参考答案:
1.D
【详解】A.有机物燃烧只生成CO2和H2O,且二者物质的量相等,只能说明有机物的组成中碳氢原子个数比为1∶2,不能确定有无氧元素,选项A错误;
B.1mol乙烯和1mol乙醇完全燃烧都消耗3mol氧气,完全燃烧消耗的氧气一样多,故B错误;
C.高于100℃条件下,水为气体,烃中的H原子数为4时,反应前后气体体积不变,则在高于100°C条件下,燃烧甲烷和乙烯的混合气体,前后气体体积不变;低于100℃条件下,水为液体,则反应前后的体积会变化,C错误;
D.12g碳可以消耗1mol氢气,4g氢可以消耗1mol氢气,所以质量相同时,氢元素的质量分数越高消耗的氧气越多,D正确;
故选D。
2.B
【详解】A.由有机物HOCH2CH=CHCH2COOH的结构简式可知,该有机物含有羟基、碳碳双键、羧基3种官能团,故A正确;
B.该有机物能使溴水和酸性高锰酸钾溶液褪色,其褪色原理不一样,前者发生加成反应,后者发生氧化反应,故B错误;
C.由有机物HOCH2CH=CHCH2COOH的结构简式可知,该有机物含有羟基、碳碳双键和羧基,因此该有机物能发生氧化反应、加成反应、加聚反应、酯化反应,故C正确;
D.羟基和羧基与都能与金属钠反应生成氢气,所以1molHOCH2CH=CHCH2COOH能与2molNa、1molNaOH发生反应,故D正确;
故答案:B。
3.B
【详解】A.由流程分析可知,M的单体B为CH2=CHOCH3,A和甲醇加成生成B,则A为乙炔,化学式为C2H2,A错误;
B.同系物是指结构相似、分子组成相差若干个“CH2”原子团的有机化合物;属于物质B的同系物且相对分子质量比B大14的有机物有CH2=C(CH3)OCH3、CH2=CHCH2OCH3、CH3CH=CHOCH3、CH2=CHOCHCH3,共4种,B正确;
C.乙醇分子中只有1个羟基,不能和C发生缩聚反应,C错误;
D.C脱水的过程中生成水,部分氢氧原子没有被利用,故不是理想的原子经济性反应,D错误;
故选B。
4.A
【详解】A. 聚合物的单体是,故A正确;
B. 为顺式聚异戊二烯的结构简式,故B错误;
C. (涤纶)可通过缩聚反应制得,反应产物中生成小分子水,故C错误;
D. 聚乙烯中没有不饱和键,不能使酸性溶液褪色,故D错误;
故选A。
5.A
【详解】A.黄芩素含有酚羟基,易被氧化,不能在空气中长时间存放,故A错误;
B.黄芩素中的碳碳双键、碳氧双键和苯环都能与氢气发生加成反应,故1mol黄芩素可与8mol发生反应,故B正确;
C.黄芩素中含有碳碳双键,能被酸性高能酸钾溶液氧化,故C正确;
D.黄芩素含有酚羟基,能与NaOH溶液和溶液发生反应,故D正确;
故选A。
6.C
【详解】A.分子中含—COOH,与Na反应生成氢气,故A不选;
B.分子中含—COOH,与碳酸钠反应生成二氧化碳,B不选;
C.分子中含碳碳双键,与溴的四氯化碳溶液发生加成反应,C可选;
D.分子中含碳碳双键,可发生加聚反应生成高分子化合物,D不选;
故选C。
7.D
【详解】A.由聚维酮碘的分子结构知,聚维酮由加聚反应制得,其单体为,选项A正确;
B.由聚维酮碘的分子结构知,聚维酮分子中左侧链节由2个单体构成,因此,聚维酮分子由2m+n个单体聚合而成,选项B正确;
C.由题干信息“聚维酮碘的水溶液”知,聚维酮碘能溶于水,选项C正确;
D.由聚维酮碘的分子结构知,聚维酮由加聚反应制得,其单体为,该单体分子中含有碳碳双键、肽键,能发生水解反应,也能发生加聚反应、加成反应、取代反应,但不能发生消去反应,选项D不正确;
答案选D。
8.B
【详解】A.分子中含有四面体碳原子,所以分子中所有碳原子不在同一平面上,故A正确;
B.1个齿孔酸分子中含有1个羧基,1mol齿孔酸和足量溶液反应产生1mol,故B错误;
C.羟基、羧基能与钠反应,1mol齿孔酸消耗2molNa,碳碳双键能与发生加成反应,1mol齿孔酸消耗3mol,故C正确;
D.齿孔酸中的碳碳双键和醇羟基能使酸性溶液褪色,齿孔酸中的碳碳双键能使的溶液褪色,故D正确;
选B。
9.D
【详解】A.反应中生成杂质气体二氧化硫也能使酸性高锰酸钾溶液褪色,故不能证明生成了乙烯,A错误;
B.向苯酚溶液中滴加少量浓溴水、振荡,生成的三溴苯酚溶于苯酚,观察不到白色沉淀,B错误;
C.过量氢氧化钠也会和硝酸银反应,故应该酸化后滴加硝酸银溶液,C错误;
D.重金属盐能使蛋白质变性,向蛋白质溶液中滴加饱和CuSO4溶液,有固体析出,再加水固体不溶解,则蛋白质的结构已发生变化,D正确;
故选D。
10.B
【详解】A.明矾水解产生氢氧化铝胶体可用于水的净化,但不能杀菌消毒,A错误;
B.食盐可用于调味,也可用于某些食物的防腐剂,用食盐腌制食物延长保质期,B正确;
C.SO2广泛用于草帽纸浆等的漂白,但食品中不能广泛使用,C错误;
D.聚氯乙烯材料不可用于食品包装袋,D错误;
答案选B。
11.C
【详解】A.由题图可知,该有机化合物分子的核磁共振氢谱图中有8组峰,故含有8种化学环境的H原子,A错误;
B.根据该有机化合物的键线式可知分子中不含苯环,不属于芳香族化合物,B错误;
C.由键线式及球棍模型可知,Et代表-CH2CH3,C正确;
D.该有机化合物的分子式为C9H12O4,1molC9H12O4, 1 mol该有机化合物完全燃烧可以产生9 molCO2和6 mol H2O,D错误。
答案选C。
12.C
【详解】A.CH3CH2CH2CH3中有2种氢原子,核磁共振氢谱中有2个吸收峰,A错误;
B.中有4种氢原子,核磁共振氢谱中有4个吸收峰,B错误;
C.中有3种氢原子,核磁共振氢谱中有3个吸收峰,C正确;
D.中有2种氢原子,核磁共振氢谱中有2个吸收峰,D错误;
故选C。
13.D
【详解】A.该物质含有碳碳双键,能发生加成反应,含有溴原子且溴原子链接的碳原子的邻位碳上有氢原子,所以能发生消去反应,A正确,不符合题意;
B.形成碳碳双键的碳原子都链接不同的部分,所以有顺反异构体,B正确,不符合题意;
C.含有羟基,和酯基和羧基三种含氧官能团,C正确,不符合题意;
D.酚羟基和羧基能和氢氧化钠反应,酯基水解都出酚羟基和羧基都能和氢氧化钠反应,溴原子也能和氢氧化钠发生反应,故1mol该物质最多能与5molNaOH反应,D错误,符合题意;
故选D。
14.C
【详解】A.D2和HD的相对分子质量不同,可以用质谱区分,A正确;
B.类似于钠和水的反应, Li与D2O反应生成LiOD与D2,化学方程式是2Li+2D2O=2LiOD+D2↑,B正确;
C.D2由Li与D2O反应生成,HD 通过反应LiH+D2O=LiOD+HD, n(D2)/n(HD)越大,n(Li)/n(LiH)越大,C不正确;
D.升温,2LiH 2Li+H2 △H>0平衡右移,Li增多LiH 减少,则结合选项C可知:80℃下的n(D2)/n(HD)大于25℃下的n(D2)/n(HD) ,D正确;
答案为:C。
15.(1) 6 CH4 50%
(2) 8
【解析】(1)
①乙炔分子四原子共直线,苯分子中存在对顶角两个碳原子和两个氢原子共四原子共直线,所以乙炔分子中的一个氢原子被C6H5—取代后的物质共直线的原子最多有6个;
②等质量的烃含氢质量分数越大,耗氧量越大,所以等质量的甲烷、乙烯和乙炔充分燃烧,耗氧量最大的是CH4;
③25℃和101kPa时,根据烃CxHy燃烧通式,
,解得y=3,因为CH4和C2H4都含有4个碳原子,C2H2含有2个碳原子,设C2H2所占的体积分数为x,则CH4和C2H4占(1-x),所以4(1-x)+2x=3,解得x=0.5,即原混合烃中c的体积分数为50%;
因此,本题正确答案为:6;CH4;50%;
(2)
分子式为的烷基一取代苯,R基为,其结构可能为、、、、、、、,共8种。其中不能被氧化为苯甲酸的有一种,即,可以被氧化为苯甲酸的同分异构体共7种。
16.
【详解】对比G的结构简式和H的分子式可知,H中引入了1个,而少了1个O和1个H,G和H的不饱和度没有变化,结合反应条件为“、甲苯”,再观察J的结构简式可以推出是被取代的过程,即H的结构简式为,再结合J的结构简式和I的分子式可知,J的右半部分为I反应后的结果,根据题干信息“I是一种有机物形成的盐”,故I的结构简式为;故答案为。
17.CH2=CH2CH2BrCH2BrHOCH2CH2OH
【详解】以乙烯为原料制备1,4-二氧六环,可由乙二醇发生取代反应得到,乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成乙二醇,其合成路线为CH2=CH2CH2BrCH2BrHOCH2CH2OH。
18.
【详解】参照合成路线,在一定条件下与氢气发生加成反应生成,在铜的催化下与氧气发生氧化反应生成,与在碱性条件下与反应生成,在碱的作用下转化为,合成路线如下:。
19. 羟基、酯基 C6H12 C CH2=CH2+Br2CH2BrCH2Br
【详解】(1)由结构简式 可知含有官能团的名称为羟基、酯基;故答案为:羟基、酯基;
(2)由系统命名法可知2-甲基-1-丁烯的结构简式为 ;故答案为: ;
(3)由烷烃的通式CnH2n+2可得相对分子质量为72的烷烃为C5H12,同分异构体有CH3CH2CH2CH2CH3,(CH3)2CHCH2CH3,,一氯代物只有一种的烷烃的结构简式为;故答案为:;
(4)的分子式为C6H12;故答案为:C6H12;
(5) A.红外光谱可以测定官能团的种类,乙醇和甲醚所含官能团不同,可以用此法区别,故A不合题意;
B.核磁共振氢谱可以测定氢原子的种类和个数,乙醇和甲醚所含氢原子种类不同,可以用此法区别,故B不合题意;
C.元素分析仪是分析元素的种类,乙醇和甲醚都是含有C、H、O三种元素,不能用元素分析仪区别,故C符合题意;
D.乙醇可以与钠反应,甲醚和钠不反应,可以用钠区别二者,故D不符合题意;
故答案为C;
(6) 乙烯使溴水褪色是因为发生加成反应,反应方程式为:CH2=CH2+Br2CH2BrCH2Br;故答案为:CH2=CH2+Br2CH2BrCH2Br。
20. C6H12 2,3-二甲基-2-丁烯 n (CH3)2C=C(CH3)2→ (CH3CH2)2C=CH2 3种 CH2=CHCH2CH3
【分析】(1)0.2mol烃A在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则1mol烃中含有6molC,12molH原子,A分子式为C6H12;(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷;若烃A可与HBr加成,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种。说明该烯烃结构对称,分子中只有一种氢原子,根据题给条件来分析(4)、(5)题。
【详解】(1)烃含有C、H两种元素,0.2mol烃A在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,根据原子守恒可知1mol烃中含有6molC,12molH原子,则A的分子式为C6H12,故答案为:C6H12;
(2)若烃A不能使溴水褪色,说明有机物中不含碳碳双键,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,应为环己烷,结构简式为,故答案为:;
(3) 若烃A可与HBr加成,说明分子内含有双键,与HBr加成后只能得到一种产物,且烃A的一氯代物只有一种,说明结构对称,只有一种氢原子,①则其结构简式为,其名称为2,3-二甲基-2-丁烯
②A在一定条件下能发生加聚反应,其化学方程式为 n(CH3)2C=C(CH3)2→,故答案为 2,3-二甲基-2-丁烯 n(CH3)2C=C(CH3)2→;
(4) 若核磁共振氢谱显示链烃A中有三组峰,峰面积比为3∶2∶1,且无顺反异构。写出A的结构简式:CH3CH2CH=CHCH2CH3或(CH3CH2)2C=CH2,故答案为:(CH3CH2)2C=CH2;
(5) 比A少两个碳原子的A的烯烃同系物是丁烯,其同分异构体共有3种,其结构简式为CH2=CHCH2CH3, CH3CH=CHCH3,CH2=C(CH3) 2,不考虑顺反异构),其中只含有一个甲基的结构简式为CH2=CHCH2CH3,故答案为 3 CH2=CHCH2CH3
21. 溴原子 2 CH2BrCH2Br或CH3CHBr2
【分析】测定某饱和卤代烃的分子中卤素原子的种类和数目思路:取卤代烃加NaOH水溶液共热使其水解产生卤素离子,加过量硝酸溶液中和NaOH并制造酸性环境,然后加硝酸银产生卤化银,根据卤化银的颜色判断卤代烃中卤素原子种类,再通过卤化银物质的量和卤代烃物质的量关系确定卤代烃中卤素原子的个数。
【详解】(1)因加入AgNO3溶液时产生的沉淀为浅黄色,故卤代烃中卤素原子为溴原子;
(2)溴代烃的质量为11.40 mL×1.65 g·mL-1=18.81 g,摩尔质量为16×11.75 g·mol-1=188g·mol-1,因此溴代烃的物质的量为≈0.1 mol。n(AgBr)==0.2 mol。故每个卤代烃分子中溴原子数目为2;根据相对分子质量判断其分子式为C2H4Br2,其结构简式可能为CH2BrCH2Br或CH3CHBr2。
22. 甲苯 4 13 30.8 4 1:2:2:3
【详解】(1)根据A为芳香烃可知A含苯环,根据质荷比最大值为92可知A的相对分子质量为92,用商余法知A的分子式为C7H8,A为甲苯。故答案为:甲苯;
(2)甲苯中苯环上的一氯代物有3种,即氯原子取代与甲基相邻、相间、相对的位置上的氢原子,甲基上还有1种,即氯原子取代甲基上的氢原子,共4种。故答案为:4;
(3)苯的所有原子共平面,甲烷分子中与碳原子共平面的氢原子最多有两个,甲苯是由甲基取代苯的一个氢原子构成的,所以最多有13个原子共平面。故答案为:13;
(4)9.2 g甲苯的物质的量是0.1mol,完全燃烧可得和,即和。故答案为:7.2;30.8;
(5)甲苯分子中有4种氢,A分子的核磁共振氢谱有4组峰,峰面积之比为1:2:2:3。故答案为:4;1:2:2:3。
23. 向2%的AgNO3液中逐滴滴加2%的氨水,至生成的沉淀恰好完全溶解 (水浴)加热一段时间,向溶液中加入10%的NaOH溶液至用pH试纸测得溶液呈碱性,向溶液加入银氨溶液,水浴加热,试管壁上出现光亮的银镜 H2NCH2COOH C3H6O CH3COCH3
【详解】(1)①氨水和硝酸银反应生成AgOH,AgOH继续与氨水反应生成银氨络离子,所以配制银氨溶液的操作为:向2%的AgNO3液中逐滴滴加2%的氨水,至生成的沉淀恰好完全溶解;
②银镜反应需要在碱性环境中进行,所以实验方案为:取少量的10%的蔗糖溶液于试管中,向其中滴加10%的H2SO4溶液(水浴)加热一段时间,向溶液中加入10%的NaOH溶液至用pH试纸测得溶液呈碱性,向溶液加入银氨溶液,水浴加热,试管壁上出现光亮的银镜;
(2)根据α-氨基酸的定义可知最简单的α-氨基酸为H2NCH2COOH;
(3)①浓硫酸的增重即为燃烧生成水的质量,所以有机物中n(H)==0.12mol,m(H)=0.12g,碱石灰的增重为燃烧生成的CO2的质量,所以有机物中n(C)==0.06mol,m(C)=0.72g,0.12g+0.72g=0.84g<1.16g,则有机物中还含有O元素,且n(O)==0.02mol,所以有机物A中n(C):n(H):n(O)=0.06mol:0.12mol:0.02mol=3:6:1,所以有机物A的最简式为C3H6O;
②根据质谱图可知该物质的相对分子质量为60,则最简式即为该物质的分子式,核磁共振氢谱显示只有一种环境的氢原子,所以该物质的结构简式为CH3COCH3。
