河北省唐山市2022-2023学年高一上学期期末学业水平调研考试化学试题(含答案)
文档属性
| 名称 | 河北省唐山市2022-2023学年高一上学期期末学业水平调研考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 960.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 09:33:36 | ||
图片预览


文档简介
唐山市2022-2023学年高一上学期期末学业水平调研考试
化学
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 S—32 Cl—35.5 Cu—64
Ba—137
卷Ⅰ(选择题共50分)
一、单项选择题(本题共10小题,每题3分,共30分,每小题只有1个选项符合题意)
1.下列物质与对应标识不匹配的是( )
A B C D
氯气 浓硫酸 钠 苏打
A.A B.B C.C D.D
2.利用食醋、小苏打、蔗糖和水可以自制简易的碳酸饮料。过程中发生反应:
。下列说法不正确的是( )
A.蔗糖属于非电解质
B.、均属于氧化物
C.该反应类型为氧化还原反应
D.在水中的电离方程式为
3.下图所示的实验操作中,不能达到相应目的的是( )
A.区分胶体和溶液 B.制蒸馏水
C.灼烧干海带 D.检验草木灰中含
4.下列说法正确的是( )
A.含离子键的化合物一定是离子化合物
B.冰分子中存在共价键、氢键两种化学键,故其稳定性大于干冰
C.在元素周期表金属与非金属的分界线处可寻找高效的催化剂
D.两种金属元素,最外层电子数越少则金属性越强
5.下列反应的离子方程式正确的是( )
A.向溶液中加入金属钠:
B.实验室用大理石为原料制备:
C.向澄清石灰水中滴入少量溶液:
D.少量通入NaClO溶液中:
6.除去括号内少量杂质所用试剂和方法不正确的是( )
选项 混合物 试剂 方法
A NaCl溶液(NaBr) 、四氯化碳 萃取、分液
B 溶液() 氯化钡溶液 过滤
C (水蒸气) 浓硫酸 洗气
D (CO) CuO 加热
A.A B.B C.C D.D
7.用表示阿伏加德罗常数的值,下列叙述正确的是( )
A.18g分子中含有的电子数目为
B.100g58.5%的NaCl溶液中含有的NaCl分子数目为
C.14g和的混合物中含有氢原子总数为
D.2.4gMg在空气中燃烧,转移电子数目为
8.工业上制备相关物质,涉及的反应原理及部分流程较为合理的是( )
A.制纯碱:饱和食盐水
B.制取镁:海水Mg
C.制溴:浓缩海水HBr溶液
D.制碘:干海带浸出液碘水
9.下列实验操作、现象和结论都正确的是( )
实验操作 现象 结论
A 将与稀盐酸反应得到的气体通入到澄清石灰水中 澄清石灰水变浑浊 非金属性:Cl>C
B 将气体X通入品红溶液中 品红溶液褪色 X一定是
C 将少量表面被氧化的钠投入蒸馏水中 有气泡产生 钠表面有生成
D 将浓硫酸加入到滴有几滴水的蔗糖中 蔗糖逐渐变黑形成“黑面包”,产生有刺激性气体 浓硫酸的性质:脱水性、强氧化性
A.A B.B C.C D.D
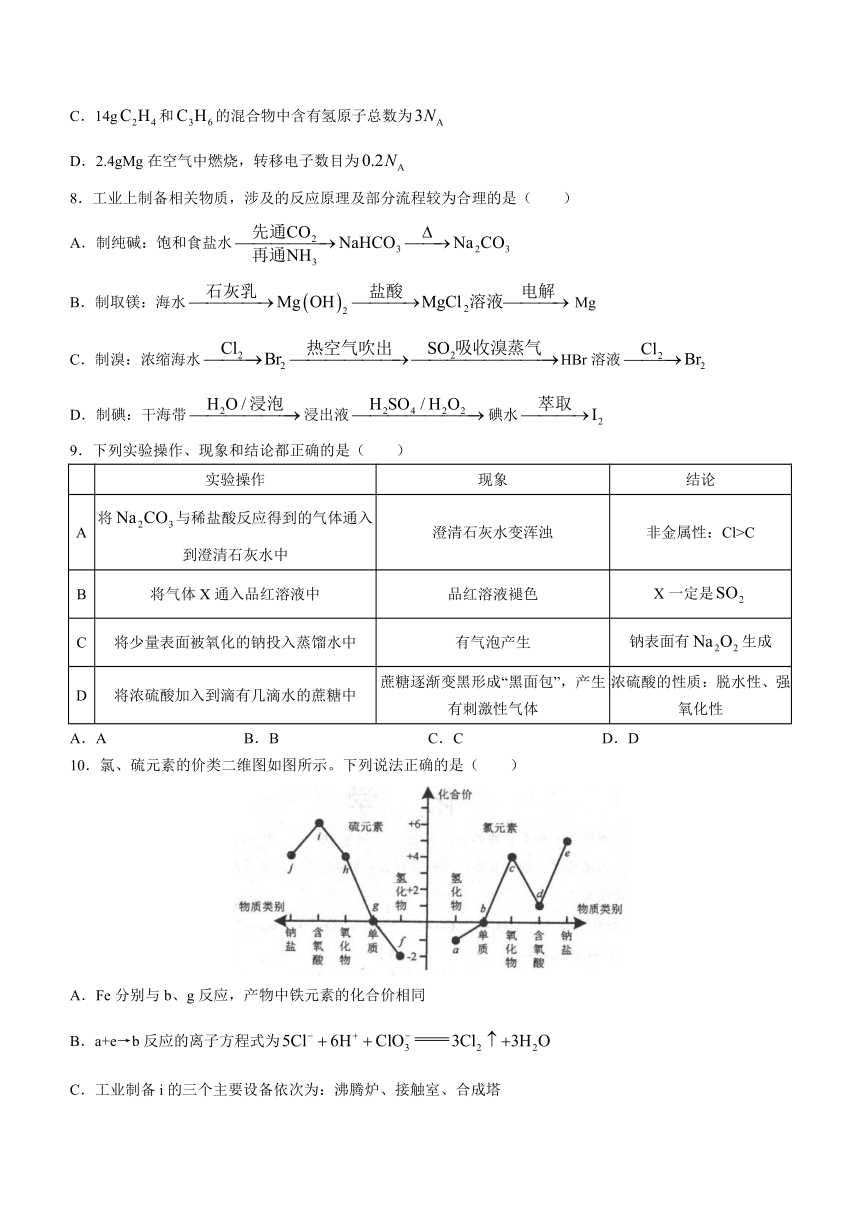
10.氯、硫元素的价类二维图如图所示。下列说法正确的是( )
A.Fe分别与b、g反应,产物中铁元素的化合价相同
B.a+e→b反应的离子方程式为
C.工业制备i的三个主要设备依次为:沸腾炉、接触室、合成塔
D.d、h的水溶液在空气中久置,溶液酸性均减弱
二、不定项选择题(本题共5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分:若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分)
11.常温常压下,向盛有足量溶液A的试管中加入0.1mol固体B,用气球收集产生的气体,并用细线绳扎住,置于无风室内,气球情况如下图所示(忽略线绳和气球质量),表中溶液A、固体B与气球情况的对应关系正确的是( )
溶液A 固体B 气球情况
A 浓盐酸 甲
B 浓硫酸 铁粉 乙
C 稀硫酸 锌粒 乙
D 溶液 甲
A.A B.B C.C D.D
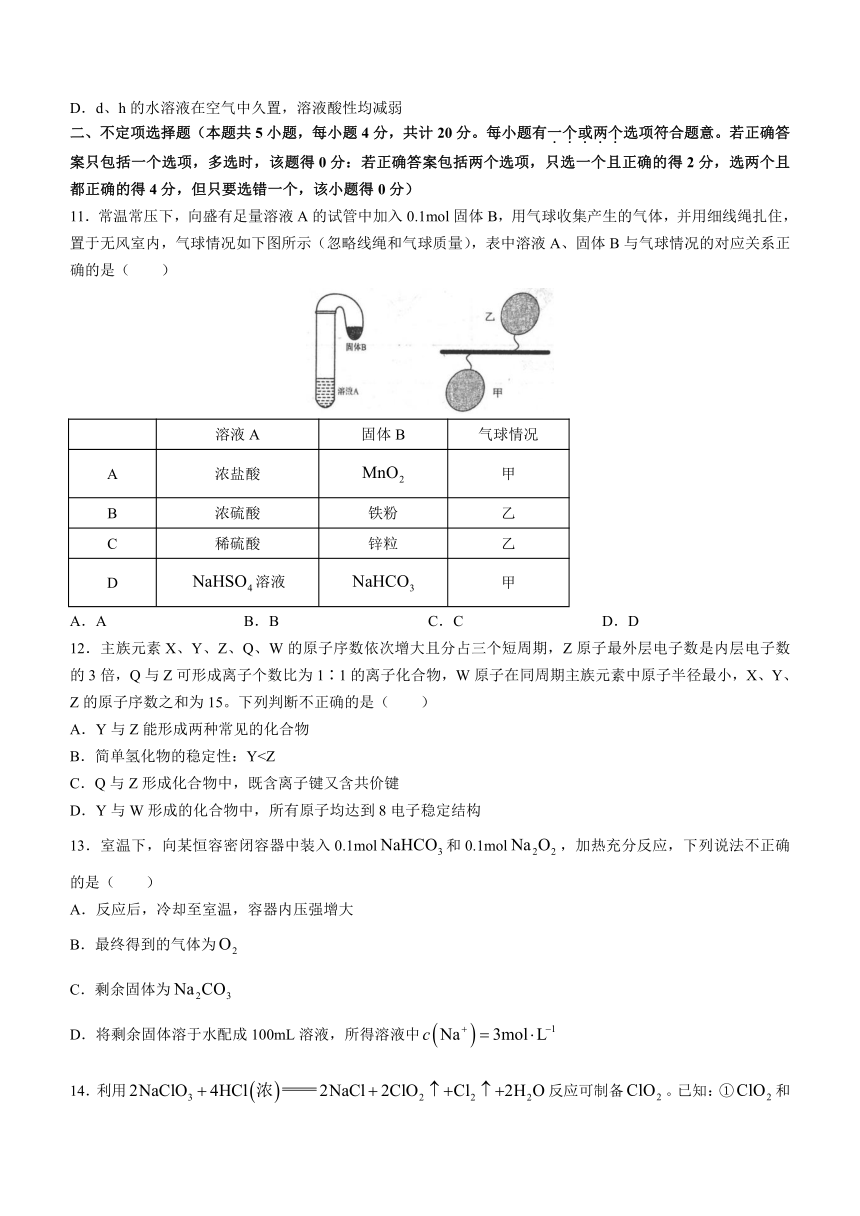
12.主族元素X、Y、Z、Q、W的原子序数依次增大且分占三个短周期,Z原子最外层电子数是内层电子数的3倍,Q与Z可形成离子个数比为1∶1的离子化合物,W原子在同周期主族元素中原子半径最小,X、Y、Z的原子序数之和为15。下列判断不正确的是( )
A.Y与Z能形成两种常见的化合物
B.简单氢化物的稳定性:YC.Q与Z形成化合物中,既含离子键又含共价键
D.Y与W形成的化合物中,所有原子均达到8电子稳定结构
13.室温下,向某恒容密闭容器中装入0.1mol和0.1mol,加热充分反应,下列说法不正确的是( )
A.反应后,冷却至室温,容器内压强增大
B.最终得到的气体为
C.剩余固体为
D.将剩余固体溶于水配成100mL溶液,所得溶液中
14.利用反应可制备。已知:①和常用于饮用水的消毒;②消毒效率常以单位质量的消毒剂得到的电子数表示。下列有关说法正确的是( )
A.和均是氧化产物
B.的氧化性强于
C.等物质的量的消毒效率高于
D.若反应中共转移10mol电子,则被氧化的HCl为2mol
15.石墨烯铜复合材料的电导率高,韧性好,可用于制备高铁的“超级导线”。某化学小组用如下装置测定其中的碳含量(铜、碳以外的成分不与浓硫酸反应)。已知:实验前后,各通入一次,将装置中的气体全部赶入到U型管中。
下列说法不正确的是( )
A.可用足量的溶液代替溶液
B.若撤去盛装浓硫酸的洗气瓶,则测定的结果偏高
C.球型干燥管内碱石灰的作用是防止空气中的水蒸气和二氧化碳进入U型管
D.实验结束后,U型管增重mg,则碳含量为
卷Ⅱ(非选择题,共50分)
三、实验题(本题包括2小题,共21分)
16.(9分)配制一定物质的量的浓度的溶液,对生产和科学研究有着重要意义。
(1)配制95mL溶液。
①需要电子天平称量的质量为______g。
②选用容量瓶的规格为xxmL,xx代表的数值为______。
③配制过程如图,其操作的顺序为b→a→______(填字母)。若操作d俯视,会使所配制溶液中溶质的物质的量浓度______(填“偏低”、“偏高”或“无影响”,下同);操作g后,发现液面低于刻度线,继续加水至溶液的凹液面与刻度线相切,会使所配制溶液中溶质的物质的量浓度______。
(2)若用溶液配制所需溶液,需量取的体积为______ml。
17.(12分)1774年,舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取的化学方程式为______;实验员常用代替软锰矿,反应中氧化剂与还原剂的物质的量之比为______。
(2)将舍勒法得到的,按照净化、收集、性质检验及尾气处理的顺序进行实验。
①下列装置(“→”表示气流方向)不能达到实验目的的是______(填字母)。
②根据C装置中现象为“干燥红布条不褪色、湿润的红布条褪色”,可得出的结论为______;若将通入到紫色石蕊试液中,可观察到的现象为______。
(3)日常生活中使用的漂白粉可由制得,其化学反应方程式为______,漂白粉的有效成分为______。
四、填空题(本题包括2小题,共19分)
18.(9分)
Ⅰ.下列物质中:①钠,②硫酸,③氨水,④,⑤干燥的空气,⑥氯气,⑦石墨,⑧硫酸钡
(1)属于混合物的是______(填序号,下同)。
(2)属于电解质的是______。
(3)能导电的是______。
(4)离子晶体的是______。
(5)属于共价化合物的是______。
Ⅱ.下列几组物质中:①和,②金刚石和,③和,④和,⑤和,⑥T和D,⑦氯气和液氯,⑧和
(1)互为同位素的是______(填序号,下同)。
(2)互为同素异形体的是______。
(3)互为同分异构体的是______。
(4)属于同一种物质且状态不同的是______。
19.(10分)V、W、X、Y、Z四种短周期元素在元素周期表中的位置如下表所示:已知①元素V最高正化合价与最低负化合价的代数和为0;②X的最高正价与Z的最高正价的代数和为8。
…… V W
X …… Y Z
结合所学知识,回答下列问题:
(1)V位于元素周期表中的位置为______。
(2)W的单质与水反应的化学方程式为______。
(3)Y的原子结构示意图为______;比Z原子序数大、与Z同主族且与Z相邻周期的元素其原子序数是______。
(4)X的单质与水反应的离子方程式为______。
(5)W、X、Y离子半径由大到小的顺序为:______。(填离子符号)
(6)用电子式表示化合物XZ的形成过程______。
五、计算题(本题包括1小题,共10分)
20.(10分)某工厂使用的煤中硫的质量分数为3.2%,假设该工厂每天燃烧煤10t,试计算:
(1)若煤中硫全部转化为,该厂每天产生的在标况下的体积为______。
(2)若用1.5mol/L、的NaOH溶液来吸收每天产生的,则所得溶液中溶质的成分(填化学式)和物质的量为______。
(3)若把每年(按365天计)产生的全部用来生产硫酸,理论上可得98%的浓硫酸的质量为______t。
唐山市2022-2023学年高一上学期期末学业水平调研考试
化学参考答案及评分标准
选择题评分标准:1-10题单选,每小题3分,共30分;11-15题,不固定选项,每小题4分,共20分,漏选得2分,错选得0分
题号 1 2 3 4 5 6 7 8 9 10
答案 D C D A C B D C D B
题号 11 12 13 14 15
答案 CD C C BC A
三、实验题(本题包括2小题,共21分)
16.(本题共9分)
(1)①28.6000(2分,有效数字不做要求)②100(1分)③cefdg(2分)偏高(1分)偏低(1分)
(2)20.0(2分)
17.(本题共12分)
(1)(2分) 1∶5(2分)
(2)①AD(2分)②无漂白性(1分)与水反应生成的HClO有漂白性(1分)
溶液先变为红色,后褪色(1分)
(3)(2)(1分)
四、填空题(本题包括2小题,共19分)
18.(本题共9分)
Ⅰ.(1)③⑤(1分) (2)②⑧(1分) (3)①③⑦(1分)
(4)⑧(1分) (5)②④(1分)
Ⅱ.(1)⑥(1分) (2)②(1分)
(3)③⑧(1分) (4)⑦(1分)(多选、漏选、错选均不得分)
19.(本题共10分)
(1)第二周期第ⅣA族(2分) (2)(2分)
(3)(1分)35(1分) (4) (2分)
(5)(1分) (6)(1分)
五、计算题(本题包括1小题,共10分)
20.(本题共10分)
(1) (3分)
(2)、(2分);、(2分) (3)365(3分)
化学
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 S—32 Cl—35.5 Cu—64
Ba—137
卷Ⅰ(选择题共50分)
一、单项选择题(本题共10小题,每题3分,共30分,每小题只有1个选项符合题意)
1.下列物质与对应标识不匹配的是( )
A B C D
氯气 浓硫酸 钠 苏打
A.A B.B C.C D.D
2.利用食醋、小苏打、蔗糖和水可以自制简易的碳酸饮料。过程中发生反应:
。下列说法不正确的是( )
A.蔗糖属于非电解质
B.、均属于氧化物
C.该反应类型为氧化还原反应
D.在水中的电离方程式为
3.下图所示的实验操作中,不能达到相应目的的是( )
A.区分胶体和溶液 B.制蒸馏水
C.灼烧干海带 D.检验草木灰中含
4.下列说法正确的是( )
A.含离子键的化合物一定是离子化合物
B.冰分子中存在共价键、氢键两种化学键,故其稳定性大于干冰
C.在元素周期表金属与非金属的分界线处可寻找高效的催化剂
D.两种金属元素,最外层电子数越少则金属性越强
5.下列反应的离子方程式正确的是( )
A.向溶液中加入金属钠:
B.实验室用大理石为原料制备:
C.向澄清石灰水中滴入少量溶液:
D.少量通入NaClO溶液中:
6.除去括号内少量杂质所用试剂和方法不正确的是( )
选项 混合物 试剂 方法
A NaCl溶液(NaBr) 、四氯化碳 萃取、分液
B 溶液() 氯化钡溶液 过滤
C (水蒸气) 浓硫酸 洗气
D (CO) CuO 加热
A.A B.B C.C D.D
7.用表示阿伏加德罗常数的值,下列叙述正确的是( )
A.18g分子中含有的电子数目为
B.100g58.5%的NaCl溶液中含有的NaCl分子数目为
C.14g和的混合物中含有氢原子总数为
D.2.4gMg在空气中燃烧,转移电子数目为
8.工业上制备相关物质,涉及的反应原理及部分流程较为合理的是( )
A.制纯碱:饱和食盐水
B.制取镁:海水Mg
C.制溴:浓缩海水HBr溶液
D.制碘:干海带浸出液碘水
9.下列实验操作、现象和结论都正确的是( )
实验操作 现象 结论
A 将与稀盐酸反应得到的气体通入到澄清石灰水中 澄清石灰水变浑浊 非金属性:Cl>C
B 将气体X通入品红溶液中 品红溶液褪色 X一定是
C 将少量表面被氧化的钠投入蒸馏水中 有气泡产生 钠表面有生成
D 将浓硫酸加入到滴有几滴水的蔗糖中 蔗糖逐渐变黑形成“黑面包”,产生有刺激性气体 浓硫酸的性质:脱水性、强氧化性
A.A B.B C.C D.D
10.氯、硫元素的价类二维图如图所示。下列说法正确的是( )
A.Fe分别与b、g反应,产物中铁元素的化合价相同
B.a+e→b反应的离子方程式为
C.工业制备i的三个主要设备依次为:沸腾炉、接触室、合成塔
D.d、h的水溶液在空气中久置,溶液酸性均减弱
二、不定项选择题(本题共5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分:若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题得0分)
11.常温常压下,向盛有足量溶液A的试管中加入0.1mol固体B,用气球收集产生的气体,并用细线绳扎住,置于无风室内,气球情况如下图所示(忽略线绳和气球质量),表中溶液A、固体B与气球情况的对应关系正确的是( )
溶液A 固体B 气球情况
A 浓盐酸 甲
B 浓硫酸 铁粉 乙
C 稀硫酸 锌粒 乙
D 溶液 甲
A.A B.B C.C D.D
12.主族元素X、Y、Z、Q、W的原子序数依次增大且分占三个短周期,Z原子最外层电子数是内层电子数的3倍,Q与Z可形成离子个数比为1∶1的离子化合物,W原子在同周期主族元素中原子半径最小,X、Y、Z的原子序数之和为15。下列判断不正确的是( )
A.Y与Z能形成两种常见的化合物
B.简单氢化物的稳定性:Y
D.Y与W形成的化合物中,所有原子均达到8电子稳定结构
13.室温下,向某恒容密闭容器中装入0.1mol和0.1mol,加热充分反应,下列说法不正确的是( )
A.反应后,冷却至室温,容器内压强增大
B.最终得到的气体为
C.剩余固体为
D.将剩余固体溶于水配成100mL溶液,所得溶液中
14.利用反应可制备。已知:①和常用于饮用水的消毒;②消毒效率常以单位质量的消毒剂得到的电子数表示。下列有关说法正确的是( )
A.和均是氧化产物
B.的氧化性强于
C.等物质的量的消毒效率高于
D.若反应中共转移10mol电子,则被氧化的HCl为2mol
15.石墨烯铜复合材料的电导率高,韧性好,可用于制备高铁的“超级导线”。某化学小组用如下装置测定其中的碳含量(铜、碳以外的成分不与浓硫酸反应)。已知:实验前后,各通入一次,将装置中的气体全部赶入到U型管中。
下列说法不正确的是( )
A.可用足量的溶液代替溶液
B.若撤去盛装浓硫酸的洗气瓶,则测定的结果偏高
C.球型干燥管内碱石灰的作用是防止空气中的水蒸气和二氧化碳进入U型管
D.实验结束后,U型管增重mg,则碳含量为
卷Ⅱ(非选择题,共50分)
三、实验题(本题包括2小题,共21分)
16.(9分)配制一定物质的量的浓度的溶液,对生产和科学研究有着重要意义。
(1)配制95mL溶液。
①需要电子天平称量的质量为______g。
②选用容量瓶的规格为xxmL,xx代表的数值为______。
③配制过程如图,其操作的顺序为b→a→______(填字母)。若操作d俯视,会使所配制溶液中溶质的物质的量浓度______(填“偏低”、“偏高”或“无影响”,下同);操作g后,发现液面低于刻度线,继续加水至溶液的凹液面与刻度线相切,会使所配制溶液中溶质的物质的量浓度______。
(2)若用溶液配制所需溶液,需量取的体积为______ml。
17.(12分)1774年,舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取的化学方程式为______;实验员常用代替软锰矿,反应中氧化剂与还原剂的物质的量之比为______。
(2)将舍勒法得到的,按照净化、收集、性质检验及尾气处理的顺序进行实验。
①下列装置(“→”表示气流方向)不能达到实验目的的是______(填字母)。
②根据C装置中现象为“干燥红布条不褪色、湿润的红布条褪色”,可得出的结论为______;若将通入到紫色石蕊试液中,可观察到的现象为______。
(3)日常生活中使用的漂白粉可由制得,其化学反应方程式为______,漂白粉的有效成分为______。
四、填空题(本题包括2小题,共19分)
18.(9分)
Ⅰ.下列物质中:①钠,②硫酸,③氨水,④,⑤干燥的空气,⑥氯气,⑦石墨,⑧硫酸钡
(1)属于混合物的是______(填序号,下同)。
(2)属于电解质的是______。
(3)能导电的是______。
(4)离子晶体的是______。
(5)属于共价化合物的是______。
Ⅱ.下列几组物质中:①和,②金刚石和,③和,④和,⑤和,⑥T和D,⑦氯气和液氯,⑧和
(1)互为同位素的是______(填序号,下同)。
(2)互为同素异形体的是______。
(3)互为同分异构体的是______。
(4)属于同一种物质且状态不同的是______。
19.(10分)V、W、X、Y、Z四种短周期元素在元素周期表中的位置如下表所示:已知①元素V最高正化合价与最低负化合价的代数和为0;②X的最高正价与Z的最高正价的代数和为8。
…… V W
X …… Y Z
结合所学知识,回答下列问题:
(1)V位于元素周期表中的位置为______。
(2)W的单质与水反应的化学方程式为______。
(3)Y的原子结构示意图为______;比Z原子序数大、与Z同主族且与Z相邻周期的元素其原子序数是______。
(4)X的单质与水反应的离子方程式为______。
(5)W、X、Y离子半径由大到小的顺序为:______。(填离子符号)
(6)用电子式表示化合物XZ的形成过程______。
五、计算题(本题包括1小题,共10分)
20.(10分)某工厂使用的煤中硫的质量分数为3.2%,假设该工厂每天燃烧煤10t,试计算:
(1)若煤中硫全部转化为,该厂每天产生的在标况下的体积为______。
(2)若用1.5mol/L、的NaOH溶液来吸收每天产生的,则所得溶液中溶质的成分(填化学式)和物质的量为______。
(3)若把每年(按365天计)产生的全部用来生产硫酸,理论上可得98%的浓硫酸的质量为______t。
唐山市2022-2023学年高一上学期期末学业水平调研考试
化学参考答案及评分标准
选择题评分标准:1-10题单选,每小题3分,共30分;11-15题,不固定选项,每小题4分,共20分,漏选得2分,错选得0分
题号 1 2 3 4 5 6 7 8 9 10
答案 D C D A C B D C D B
题号 11 12 13 14 15
答案 CD C C BC A
三、实验题(本题包括2小题,共21分)
16.(本题共9分)
(1)①28.6000(2分,有效数字不做要求)②100(1分)③cefdg(2分)偏高(1分)偏低(1分)
(2)20.0(2分)
17.(本题共12分)
(1)(2分) 1∶5(2分)
(2)①AD(2分)②无漂白性(1分)与水反应生成的HClO有漂白性(1分)
溶液先变为红色,后褪色(1分)
(3)(2)(1分)
四、填空题(本题包括2小题,共19分)
18.(本题共9分)
Ⅰ.(1)③⑤(1分) (2)②⑧(1分) (3)①③⑦(1分)
(4)⑧(1分) (5)②④(1分)
Ⅱ.(1)⑥(1分) (2)②(1分)
(3)③⑧(1分) (4)⑦(1分)(多选、漏选、错选均不得分)
19.(本题共10分)
(1)第二周期第ⅣA族(2分) (2)(2分)
(3)(1分)35(1分) (4) (2分)
(5)(1分) (6)(1分)
五、计算题(本题包括1小题,共10分)
20.(本题共10分)
(1) (3分)
(2)、(2分);、(2分) (3)365(3分)
同课章节目录
