广东省揭阳市揭东区2022-2023学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 广东省揭阳市揭东区2022-2023学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 15:54:06 | ||
图片预览




文档简介
揭阳市揭东区2022-2023学年高二上学期期末考试
化学科试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Si 28 P 31 S 32 Cl 35.5 V 51
Fe 56 Cu 64 Zn 65 Br 80 Mo 96
一、单项选择题:(本题包括16小题,1-10题每小题2分,11-16题每小题4分,共44分。每小题给出的四个选项中,只有一个选项符合题目要求,多选、错选均不得分。)
1.下列各能层,不包含d能级的是( )
A.L能层 B.M能层 C.N能层 D.O能层
2.下列轨道表示式能表示基态硫原子最外层结构的是( )
A. B. C. D.
3.下列各个能级轨道数为3的是( )
A.s B.p C.d D.f
4.下列有关叙述中,不正确的是( )
A.金属性:Na>Mg>Al B.电负性:NaC.第一电离能:NaMg>Al
5.某反应过程能量变化如图所示,下列说法不正确的是( )
A.该反应为放热反应,热效应等于 B.有催化剂条件下,反应的活化能等于
C.改变催化剂,可改变该反应的活化能 D.反应过程b有催化剂参与
6.氢气是人类最理想的能源。已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )
A.
B.
C.
D.
7.下列物质溶解于水时,电离出的阳离子能使水的电离平衡向右移动的是( )
A. B. C. D.
8.为了除去酸性溶液中的,可在加热搅拌的条件下加入一种试剂,过滤后,再向溶液中加入适量的盐酸,这种试剂不能是( )
A.NaOH B.MgO C. D.
9.下列说法中正确的是( )
A.在100℃时,pH约为6的纯水呈酸性
B.将1mL盐酸稀释1000mL,所得溶液的pH为9
C.物质的量浓度相同的①溶液②溶液,:①<②
D.在常温下,当水电离出的为时,此溶液的pH可能为2或12
10.根据甲醇在艐性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,正极上发生的反应为( )
A. B.
C. D.
11.常温下,下列各组离子一定能大量共存的是( )
A.由水电离出的的溶液中:、、、
B.在含大量的溶液中:、、、
C.与Al反应能放出的溶液中:、、、
D.在的溶液中:、、、
12.设为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L由和组成的混合气体中含有的氧原子数为
B.1L0.1mol/L醋酸溶液含有的数目为
C.25℃时pH=12的氨水中的数目为
D.1L0.1mol/L碳酸钠溶液中所含的阴离子数目小于
13.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是( )
A.负极反両中有生成 B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区 D.电池总反应为
14.支撑海港码头基础的钢管桩,常采用图1、图2所示进行防腐,其中图1中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.高硅铸铁的作用是作为损耗阳极材料和传递电流
B.两图中钢管桩均作为电子流入的电极
C.图1该钢管桩的保护原理为外加电流的阴极保护法
D.图1中,当海水的腐蚀性较强时,可适当增大外加电流的强度
15.在常温下,有关下列4种溶液的叙述中错误的是( )
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
A.分别取1mL稀释至10mL,四种溶液的pH:①>②>④>③
B.在溶液①、②中分别加入适量的氯化铵晶体,两种溶液的pH均减小
C.将aL溶液②与bL溶液③混合后,若所得溶液的pH=7,则a∶b=1∶1
D.将溶液①、④等体积混合,所得溶液中:
16.下列实验操作、现象、结论均正确的是( )
实验操作 实验现象 实验结论
A 将铜与浓反应生成的气体收集后用冰水混合物冷却 气体颜色加深
B 向含有酚酞的溶液中滴入溶液,观察溶液颜色的变化 溶液颜色变浅 证明溶液中存在水解平衡
C 取2mL0.1mol/L溶液,先滴加3滴0.1mol/LNaCl溶液,后滴加5滴0.1mol/LKI溶液,观察沉淀情况 先生成白色沉淀,后变为黄色沉淀
D 已知 ,向饱和硼酸溶液中滴加碳酸钠溶液 无明显现象 与碳酸钠不反应
A.A B.B C.C D.D
二、非选择题:(本题包括5小题,共56分。)
17.(10分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)③原子的核外电子轨道表示式是______。
(2)写出元素⑩的一价离子的核外电子排布式:______,该元素属于______区元素。
(3)在标号的主族元素中,电负性最大的是______(填元素符号)。
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:______(填化学式)。
(5)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式______。
18.(11分)化学是一门以实验为基础的学科。
Ⅰ.工业上是一种重要的绿色氧化还原试剂,某小组对的催化分解实验进行探究。在同浓度的催化下,探究浓度对分解反应速率的影响。实验装置如图所示:
(1)写出溶液在催化下分解的化学方程式______;除了图中所示仪器之外,该实验还必需的仪器是______。
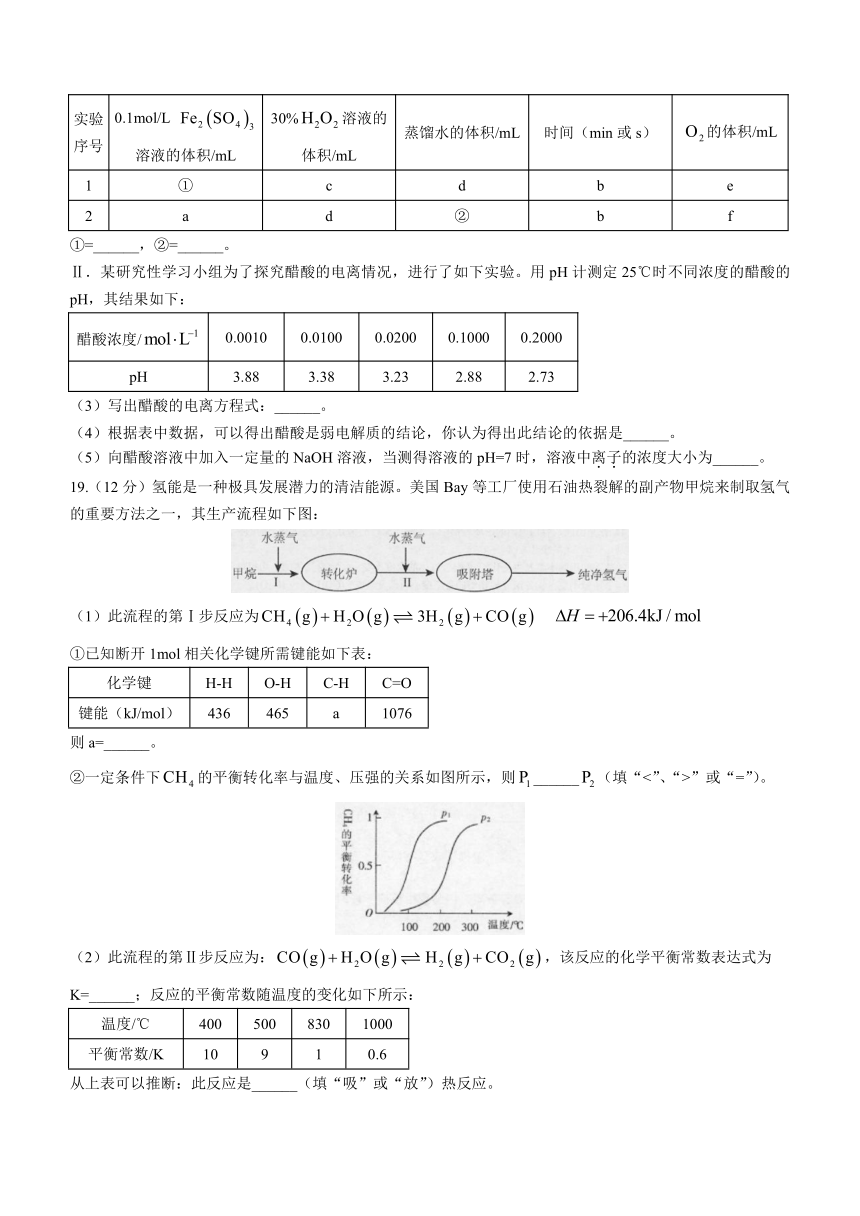
(2)请写出下面表格中①、②的实验记录数据:
实验序号 0.1mol/L 溶液的体积/mL 30%溶液的体积/mL 蒸馏水的体积/mL 时间(min或s) 的体积/mL
1 ① c d b e
2 a d ② b f
①=______,②=______。
Ⅱ.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/ 0.0010 0.0100 0.0200 0.1000 0.2000
pH 3.88 3.38 3.23 2.88 2.73
(3)写出醋酸的电离方程式:______。
(4)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______。
(5)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为______。
19.(12分)氢能是一种极具发展潜力的清洁能源。美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气的重要方法之一,其生产流程如下图:
(1)此流程的第Ⅰ步反应为
①已知断开1mol相关化学键所需键能如下表:
化学键 H-H O-H C-H C=O
键能(kJ/mol) 436 465 a 1076
则a=______。
②一定条件下的平衡转化率与温度、压强的关系如图所示,则______(填“<”、“>”或“=”)。
(2)此流程的第Ⅱ步反应为:,该反应的化学平衡常数表达式为K=______;反应的平衡常数随温度的变化如下所示:
温度/℃ 400 500 830 1000
平衡常数/K 10 9 1 0.6
从上表可以推断:此反应是______(填“吸”或“放”)热反应。
(3)此流程的第Ⅱ步反应,回答下列问题:
①在1000℃时,某时刻反应混合物中CO、、、的物质量浓度分别为2mol/L、2mol/L、1mol/L、1mol/L,则此时反应朝______(填“正反应方向”或“逆反应方向”)进行;
②欲提高反应中CO的平衡转化率,理论上可以采取的措施为______。
A.增大压强 B.升高温度 C.加入催化剂 D.通入过量水蒸气
③830℃时,在容积为1L的密闭容器中,将2molCO与2mol混合加热到830℃。反应达平衡时CO的转化率为______。
(4)在某温度、容积恒定的密闭容器中,判断此流程的第Ⅱ步反应达到平衡的标志是______(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变 ⑤
20.(11分)如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)通入氧气的电极为______(填“正极”或“负极”),负极的电极反应式为______。
(2)铁电极为______(填“阳极”或“阴极”),石墨电极(C)的电极反应式为______。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为______(用为阿伏加德罗常数的值表示)。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为______。
21.(12分)某铬盐厂净化含废水并提取的一种工艺流程如图所示。
已知:
(1)步骤Ⅰ中,发生的反应为,随着酸的浓度增大B中的浓度会______(“增大”或“减小”)。
(2)当清液中的浓度时,可认为已达铬的排放标准。此时清液的______
(3)步骤Ⅱ还可用作还原剂,配平下列离子方程式。
(4)已知溶液显酸性,则溶液中浓度大小关系:______(填“>”或“<”)。
(5)化学需氧量(COD)可量度水体受有机物污染的程度。它是在强酸并加热条件下,用作强氧化剂处理水样时所消耗的的量,换算成相当于的含量(以mol/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取VamL水样于锥形瓶,加入10.00mL0.2500mol/L溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用cmol/L的硫酸亚铁铵溶液滴定。终点时消耗硫酸亚铁铵溶液VbmL(此步操作的目的是用把多余的反应成)。
(1)Ⅰ中,量取溶液的仪器是______;
(2)Ⅱ中,碎瓷片的作用是______;
(3)该水样的化学需氧量______(用含c、Va、Vb的表达式表示)。
揭阳市揭东区2022-2023学年高二上学期期末考试
化 学
一、单项选择题:本题包括16小题,1-10题每小题2分,11-16题每小题4分,共44分。每小题给出的四个选项中,只有一个选项符合题目要求,多选、错选均不得分。
题号 1 2 3 4 5 6 7 8 9 10
答案 A D B C B C C D C B
.
题号 11 12 13 14 15 16
答案 D A C C C B
第Ⅱ卷
二、非选择题:本题包括5小题,共56分。
17.(10分)
(1)(2分)
(2)1s22s22p63s23p63d10或[Ar]3d10(2分) ds(1分)
(3)O(1分)
(4)H2O>H2S>PH3(2分)
(5)Be(OH)2+2NaOH=Na2BeO2+2H2O(2分)
18.(11分)
(1)(2分) 秒表或计时器(1分)
(2)a(1分) c(1分)
(3)CH3COOHCH3COO-+H+(2分)
(4)当醋酸浓度为0.001mol/L时,溶液中的氢离子浓度小于0.001mol/L或pH>3(后面数据均可利用,合理答案即可)(2分)
(5)c(Na+)=c(CH3COO—)>c(OH—)=c(H+)(2分)
19.(12分)
(1)①415.1(2分) ②<(1分)
(2)(2分) 放(1分)
(3)①正反应方向(1分) ②D(1分) ③50%(2分)
(4)④⑤(2分)
20.(11分)
(1)正极(1分) H2+2OH--2e-=2H2O(2分)
(2)阴极(1分) 2Cl--2e-=C12↑(2分)
(3)减小(1分)
(4)0.2NA(2分)
(5)b%>a%>c%(2分)
21.(12分)
(1)增大(1分)
(2)6(2分)
(3)__1__Cr2O72-+__6__Fe2++___14__H+=__2_Cr3++___6_Fe3++__7__H2O(2分)
(4)<(2分)
(5)①酸式滴定管(或移液管)(2分) ②防止暴沸(1分) ③(2分)
化学科试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Si 28 P 31 S 32 Cl 35.5 V 51
Fe 56 Cu 64 Zn 65 Br 80 Mo 96
一、单项选择题:(本题包括16小题,1-10题每小题2分,11-16题每小题4分,共44分。每小题给出的四个选项中,只有一个选项符合题目要求,多选、错选均不得分。)
1.下列各能层,不包含d能级的是( )
A.L能层 B.M能层 C.N能层 D.O能层
2.下列轨道表示式能表示基态硫原子最外层结构的是( )
A. B. C. D.
3.下列各个能级轨道数为3的是( )
A.s B.p C.d D.f
4.下列有关叙述中,不正确的是( )
A.金属性:Na>Mg>Al B.电负性:Na
5.某反应过程能量变化如图所示,下列说法不正确的是( )
A.该反应为放热反应,热效应等于 B.有催化剂条件下,反应的活化能等于
C.改变催化剂,可改变该反应的活化能 D.反应过程b有催化剂参与
6.氢气是人类最理想的能源。已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )
A.
B.
C.
D.
7.下列物质溶解于水时,电离出的阳离子能使水的电离平衡向右移动的是( )
A. B. C. D.
8.为了除去酸性溶液中的,可在加热搅拌的条件下加入一种试剂,过滤后,再向溶液中加入适量的盐酸,这种试剂不能是( )
A.NaOH B.MgO C. D.
9.下列说法中正确的是( )
A.在100℃时,pH约为6的纯水呈酸性
B.将1mL盐酸稀释1000mL,所得溶液的pH为9
C.物质的量浓度相同的①溶液②溶液,:①<②
D.在常温下,当水电离出的为时,此溶液的pH可能为2或12
10.根据甲醇在艐性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,正极上发生的反应为( )
A. B.
C. D.
11.常温下,下列各组离子一定能大量共存的是( )
A.由水电离出的的溶液中:、、、
B.在含大量的溶液中:、、、
C.与Al反应能放出的溶液中:、、、
D.在的溶液中:、、、
12.设为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L由和组成的混合气体中含有的氧原子数为
B.1L0.1mol/L醋酸溶液含有的数目为
C.25℃时pH=12的氨水中的数目为
D.1L0.1mol/L碳酸钠溶液中所含的阴离子数目小于
13.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是( )
A.负极反両中有生成 B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区 D.电池总反应为
14.支撑海港码头基础的钢管桩,常采用图1、图2所示进行防腐,其中图1中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.高硅铸铁的作用是作为损耗阳极材料和传递电流
B.两图中钢管桩均作为电子流入的电极
C.图1该钢管桩的保护原理为外加电流的阴极保护法
D.图1中,当海水的腐蚀性较强时,可适当增大外加电流的强度
15.在常温下,有关下列4种溶液的叙述中错误的是( )
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
pH 11 11 3 3
A.分别取1mL稀释至10mL,四种溶液的pH:①>②>④>③
B.在溶液①、②中分别加入适量的氯化铵晶体,两种溶液的pH均减小
C.将aL溶液②与bL溶液③混合后,若所得溶液的pH=7,则a∶b=1∶1
D.将溶液①、④等体积混合,所得溶液中:
16.下列实验操作、现象、结论均正确的是( )
实验操作 实验现象 实验结论
A 将铜与浓反应生成的气体收集后用冰水混合物冷却 气体颜色加深
B 向含有酚酞的溶液中滴入溶液,观察溶液颜色的变化 溶液颜色变浅 证明溶液中存在水解平衡
C 取2mL0.1mol/L溶液,先滴加3滴0.1mol/LNaCl溶液,后滴加5滴0.1mol/LKI溶液,观察沉淀情况 先生成白色沉淀,后变为黄色沉淀
D 已知 ,向饱和硼酸溶液中滴加碳酸钠溶液 无明显现象 与碳酸钠不反应
A.A B.B C.C D.D
二、非选择题:(本题包括5小题,共56分。)
17.(10分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)③原子的核外电子轨道表示式是______。
(2)写出元素⑩的一价离子的核外电子排布式:______,该元素属于______区元素。
(3)在标号的主族元素中,电负性最大的是______(填元素符号)。
(4)元素④⑥⑦的气态氢化物热稳定性由强到弱的顺序为:______(填化学式)。
(5)已知周期表中存在对角相似规则,如②与⑤在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑨的氢氧化物反应的化学方程式______。
18.(11分)化学是一门以实验为基础的学科。
Ⅰ.工业上是一种重要的绿色氧化还原试剂,某小组对的催化分解实验进行探究。在同浓度的催化下,探究浓度对分解反应速率的影响。实验装置如图所示:
(1)写出溶液在催化下分解的化学方程式______;除了图中所示仪器之外,该实验还必需的仪器是______。
(2)请写出下面表格中①、②的实验记录数据:
实验序号 0.1mol/L 溶液的体积/mL 30%溶液的体积/mL 蒸馏水的体积/mL 时间(min或s) 的体积/mL
1 ① c d b e
2 a d ② b f
①=______,②=______。
Ⅱ.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/ 0.0010 0.0100 0.0200 0.1000 0.2000
pH 3.88 3.38 3.23 2.88 2.73
(3)写出醋酸的电离方程式:______。
(4)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______。
(5)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为______。
19.(12分)氢能是一种极具发展潜力的清洁能源。美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气的重要方法之一,其生产流程如下图:
(1)此流程的第Ⅰ步反应为
①已知断开1mol相关化学键所需键能如下表:
化学键 H-H O-H C-H C=O
键能(kJ/mol) 436 465 a 1076
则a=______。
②一定条件下的平衡转化率与温度、压强的关系如图所示,则______(填“<”、“>”或“=”)。
(2)此流程的第Ⅱ步反应为:,该反应的化学平衡常数表达式为K=______;反应的平衡常数随温度的变化如下所示:
温度/℃ 400 500 830 1000
平衡常数/K 10 9 1 0.6
从上表可以推断:此反应是______(填“吸”或“放”)热反应。
(3)此流程的第Ⅱ步反应,回答下列问题:
①在1000℃时,某时刻反应混合物中CO、、、的物质量浓度分别为2mol/L、2mol/L、1mol/L、1mol/L,则此时反应朝______(填“正反应方向”或“逆反应方向”)进行;
②欲提高反应中CO的平衡转化率,理论上可以采取的措施为______。
A.增大压强 B.升高温度 C.加入催化剂 D.通入过量水蒸气
③830℃时,在容积为1L的密闭容器中,将2molCO与2mol混合加热到830℃。反应达平衡时CO的转化率为______。
(4)在某温度、容积恒定的密闭容器中,判断此流程的第Ⅱ步反应达到平衡的标志是______(填序号)。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变 ⑤
20.(11分)如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)通入氧气的电极为______(填“正极”或“负极”),负极的电极反应式为______。
(2)铁电极为______(填“阳极”或“阴极”),石墨电极(C)的电极反应式为______。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为______(用为阿伏加德罗常数的值表示)。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为______。
21.(12分)某铬盐厂净化含废水并提取的一种工艺流程如图所示。
已知:
(1)步骤Ⅰ中,发生的反应为,随着酸的浓度增大B中的浓度会______(“增大”或“减小”)。
(2)当清液中的浓度时,可认为已达铬的排放标准。此时清液的______
(3)步骤Ⅱ还可用作还原剂,配平下列离子方程式。
(4)已知溶液显酸性,则溶液中浓度大小关系:______(填“>”或“<”)。
(5)化学需氧量(COD)可量度水体受有机物污染的程度。它是在强酸并加热条件下,用作强氧化剂处理水样时所消耗的的量,换算成相当于的含量(以mol/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取VamL水样于锥形瓶,加入10.00mL0.2500mol/L溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用cmol/L的硫酸亚铁铵溶液滴定。终点时消耗硫酸亚铁铵溶液VbmL(此步操作的目的是用把多余的反应成)。
(1)Ⅰ中,量取溶液的仪器是______;
(2)Ⅱ中,碎瓷片的作用是______;
(3)该水样的化学需氧量______(用含c、Va、Vb的表达式表示)。
揭阳市揭东区2022-2023学年高二上学期期末考试
化 学
一、单项选择题:本题包括16小题,1-10题每小题2分,11-16题每小题4分,共44分。每小题给出的四个选项中,只有一个选项符合题目要求,多选、错选均不得分。
题号 1 2 3 4 5 6 7 8 9 10
答案 A D B C B C C D C B
.
题号 11 12 13 14 15 16
答案 D A C C C B
第Ⅱ卷
二、非选择题:本题包括5小题,共56分。
17.(10分)
(1)(2分)
(2)1s22s22p63s23p63d10或[Ar]3d10(2分) ds(1分)
(3)O(1分)
(4)H2O>H2S>PH3(2分)
(5)Be(OH)2+2NaOH=Na2BeO2+2H2O(2分)
18.(11分)
(1)(2分) 秒表或计时器(1分)
(2)a(1分) c(1分)
(3)CH3COOHCH3COO-+H+(2分)
(4)当醋酸浓度为0.001mol/L时,溶液中的氢离子浓度小于0.001mol/L或pH>3(后面数据均可利用,合理答案即可)(2分)
(5)c(Na+)=c(CH3COO—)>c(OH—)=c(H+)(2分)
19.(12分)
(1)①415.1(2分) ②<(1分)
(2)(2分) 放(1分)
(3)①正反应方向(1分) ②D(1分) ③50%(2分)
(4)④⑤(2分)
20.(11分)
(1)正极(1分) H2+2OH--2e-=2H2O(2分)
(2)阴极(1分) 2Cl--2e-=C12↑(2分)
(3)减小(1分)
(4)0.2NA(2分)
(5)b%>a%>c%(2分)
21.(12分)
(1)增大(1分)
(2)6(2分)
(3)__1__Cr2O72-+__6__Fe2++___14__H+=__2_Cr3++___6_Fe3++__7__H2O(2分)
(4)<(2分)
(5)①酸式滴定管(或移液管)(2分) ②防止暴沸(1分) ③(2分)
同课章节目录
