高一化学(人教版)-必修第一册与第二册总复习课件(共70张ppt)
文档属性
| 名称 | 高一化学(人教版)-必修第一册与第二册总复习课件(共70张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 00:00:00 | ||
图片预览







文档简介
(共70张PPT)
必修第一册与第二册总复习
高一年级 化学
必修第一册的目录必修第二册的目录必修课程
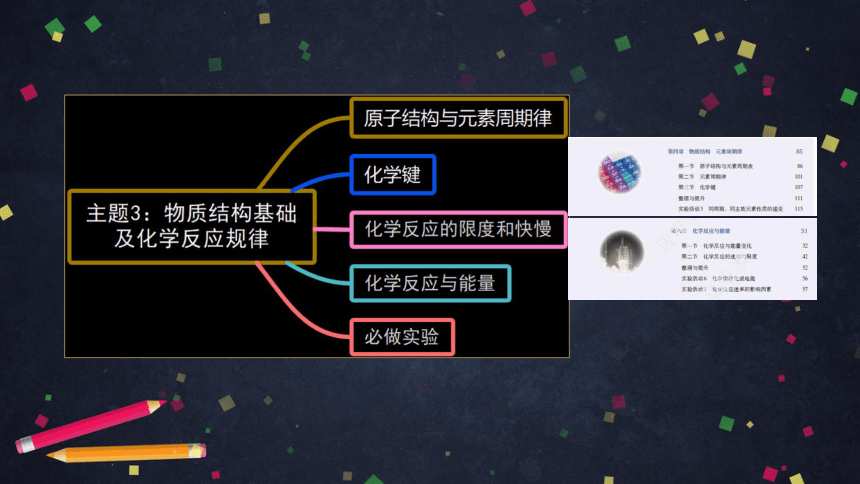
主题3:物质结构基础与化学反应规律
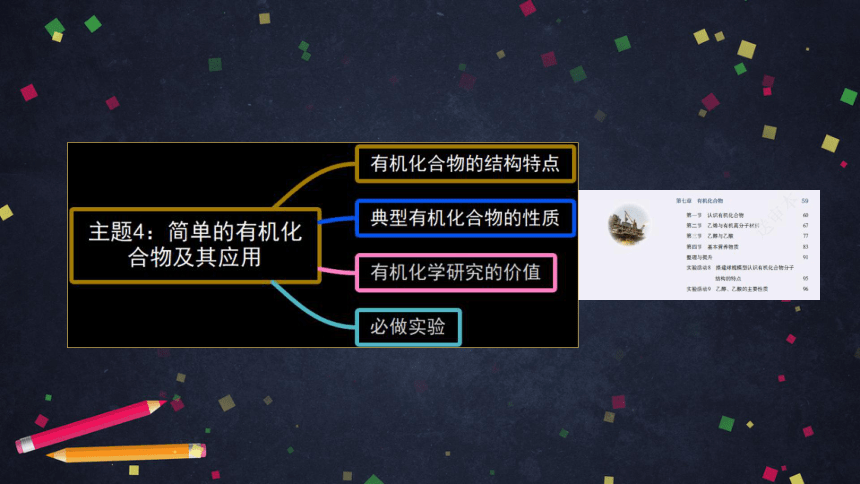
主题4:简单的有机化合物及其应用
主题5:化学与社会发展
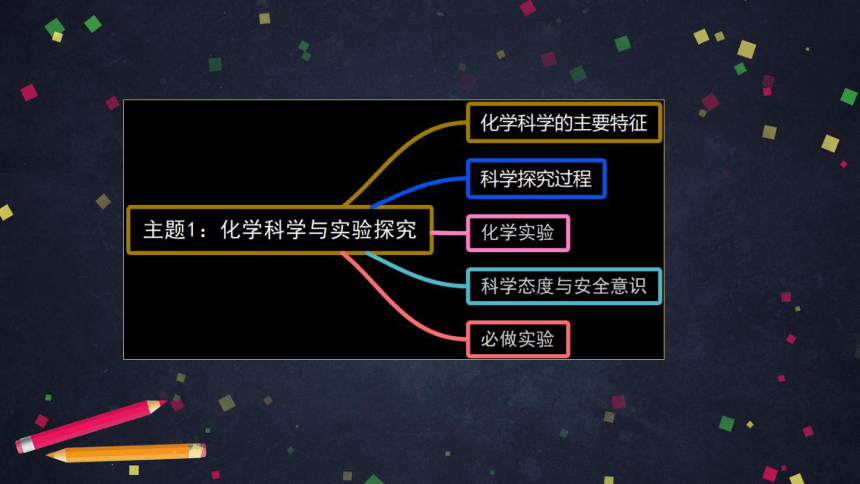
主题1:化学科学与实验探究
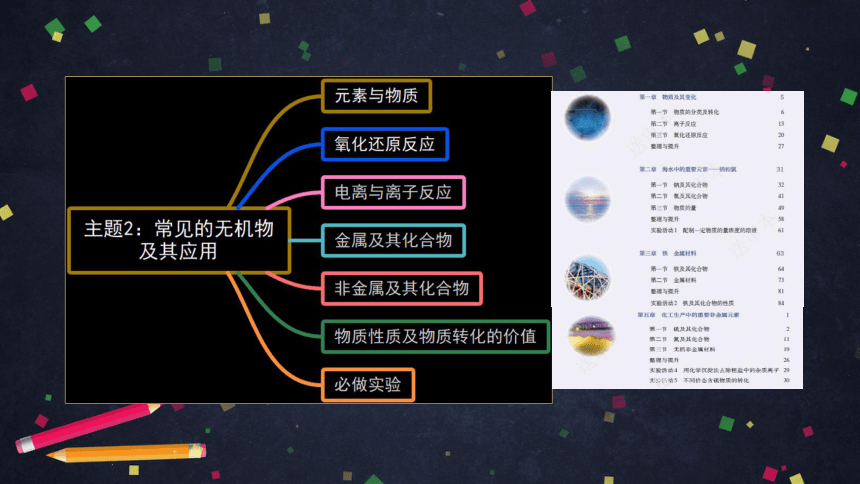
主题2:常见的无机物及其应用
主题5:化学与社会发展
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
主题3:物质结构基础与化学反应规律
同学1:物质的性质多样,如何才能记得全面?
同学2:物质之间的转化复杂,怎样才能记住?
SO2的化学性质
1.能与水反应
3.能与碱性氧化物反应
4.能与O2、Cl2等氧化剂反应
5.能与H2S反应
6.有漂白性
酸性氧化物
硫元素的价态
2.能与碱反应
特性
硫及其化合物
-2
0
+4
+6
化合价
物质类别
H2S
S2-
S
SO2
SO3
H2SO4
H2SO3
-2
0
+4
+6
化合价
物质类别
H2S
S2-
S
SO2
SO3
H2SO4
H2SO3
氧化反应
硫及其化合物
H2S
S
SO2
O2 点燃
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
O2或Cl2+H2O
O2 催化剂 △
SO2
H2SO3
Na2SO3
化合价
硫及其化合物
-2
0
+4
+6
化合价
物质类别
H2S
S2-
S
SO2
SO3
H2SO4
H2SO3
还原反应
硫及其化合物
H2S
S
SO2
H2
O2 点燃
H2S
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
O2或Cl2+H2O
△ C或Cu
O2 催化剂 △
SO2
H2SO3
Na2SO3
化合价
硫及其化合物
H2S
S
SO2
H2
H2S
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
SO2
H2SO3
Na2SO3
FeS
Fe △
Na △
Na2S
化合价
Cu2S
Cu △
硫及其化合物
O2 点燃
O2或Cl2+H2O
△ C或Cu
O2 催化剂 △
H2S
S
SO2
H2
H2S
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
SO2
H2SO3
Na2SO3
FeS
Cu2S
H2SO4
Fe,△
Cu,△
NaOH
HCl
Na2S
Na2SO3
H2O
H2O
NaOH
BaSO4
BaCl2或Ba(OH)2
Na,△
物质类别
NaOH
H2SO4
硫及其化合物
O2 点燃
O2或Cl2+H2O
△ C或Cu
O2 催化剂 △
(2)如何设计实验验证你的猜想?
【思考】
(1)硫化钠长时间放置会变质,可能生成什么?
物质类别
-2
0
+4
+6
化合价
Na2S
?
(2)如何设计实验验证你的猜想?
【思考】
(1)硫化钠长时间放置会变质,可能生成什么?
假设1:变质生成Na2SO4
假设2:变质生成Na2SO3
……
【思考】
(1)硫化钠长时间放置会变质,可能生成什么?
(2)如何设计实验验证你的猜想?
假设3:变质生成S
物质类别
化合价变化
物质性质及转化的认识角度
抓住物质的一般性质和特殊性质
建构不同类别物质之间的转化关系
判断物质有氧化性或者还原性
建构不同价态含同种元素的物质之间的转化关系
单质、氧化物、酸、碱、盐之间的转化关系
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO3
Na2SO3
物质类别
化合价变化
物质性质及转化的认识角度
抓住物质的一般性质和特殊性质
建构不同类别物质之间的转化关系
判断物质有氧化性或者还原性
建构不同价态含同种元素的物质之间的转化关系
化学反应
离子反应
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应的基本概念
氧化还原反应的基本概念
失去
还原性
氧化
氧化性
还原
得到
常见的氧化剂与还原剂
1.常见氧化剂:
X-
常见的氧化剂与还原剂
1.常见氧化剂:
1.常见氧化剂:
1.常见氧化剂:
Fe2+或Fe
NO或NO2
SO2
Mn2+
1.常见氧化剂:
2.常见还原剂:
包括活泼的金属单质、某些非金属单质、元素处于低价态时的物质(化合物、低价态金属阳离子、非金属阴离子、氢化物等)。如
2.常见还原剂:
包括活泼的金属单质、某些非金属单质、元素处于低价态时的物质(化合物、低价态金属阳离子、非金属阴离子、氢化物等)。如
Zn2+
H+
CO2
Fe3+
S
I2
H2
O2
H2O
NH3·H2O
N2
NH3
NO
NO2
HNO3
O2
O2
H2O
H2O
氮及其化合物
Cu
Cu
△
OH-
H+
△
物质类别
化合价
催化剂,△
△
NaCl
HCl
Cl2
HClO
NaClO
MnO2 △
HCl
NaOH
H2O
NaOH
H2 点燃
氯及其化合物
NaOH
Cl-
I-、Br-、 Fe2+ 、 SO2等
Na
Na2O
NaOH
Na2CO3和NaHCO3
单质
氧化物
碱
盐
化学性质
物理性质
制法
用途
……
反应的分类
物质的分类
……
物质类别
钠及其化合物
研究内容
研究视角
金属单质及其化合物
Na2S
Na
NaOH
Na2CO3
Na2O
Na2O2
NaCl
NaHCO3
S
O2
H2O
H2O
H2O
CO2
CO2
HCl
Ca(OH)2
Cl2 点燃
△
CO2+H2O
O2 △
钠及其化合物
CO2
△
铁及其化合物
Fe
Fe3O4
FeO
Fe2O3
亚铁盐
铁盐
Fe(OH)2
Fe(OH)3
红色溶液
H+
OH-
O2或H2O
C或CO
加KSCN
溶液
CO
CO
O2+H2O
还原
氧化
O2
H+
H+
OH-
Fe3+
H+
△
H+
H+
H+
元素周期表
主族元素性质递变规律
几种非金属元素性质比较
几种金属元素性质比较
“位、构、性”之间的关系
位置
结构
性质
反 映
决 定
反 映
决 定
推测
推测
周期
族
(1)原子核
(2)核外电子
元素性质
单质性质
化合物性质
离子性质
主族元素砷(As)的部分信息如图所示。
i.砷(As)在周期表中的位置是_____________________。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. N的气态氢化物的还原性大于砷的气态氢化物的还原性
思考
第4周期,ⅤA族
主族元素砷(As)的部分信息如图所示。
i.砷(As)在周期表中的位置是_____________________。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. N的气态氢化物的还原性大于砷的气态氢化物的还原性
思考
第4周期,ⅤA族
b
主族元素砷(As)的部分信息如图所示。
i.砷(As)在周期表中的位置是_____________________。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. N的气态氢化物的还原性大于砷的气态氢化物的还原性
思考
主族元素性质递变规律
化学反应中为什么会有能量变化?
化学反应中为什么会有能量变化?
化学反应中能量变化的本质原因
化学反应中能量变化的本质原因
为什么氢气在氧气中燃烧会放出热量?
2H2 + O2
2H2O
点燃
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
化合价
物质类别
主题3:物质结构基础与化学反应规律
主题5:化学与社会发展
主题3:物质结构基础与化学反应规律
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
主题4:简单的有机化合物及其应用
官能团
碳骨架
主题5:化学与社会发展
有机化合物
结构
性质
用途
碳原子的成键特点
官能团
碳骨架
基本营养物质
高分子材料
物理性质、化学性质
决定
分类
甲烷
乙烯
乙醇
乙酸
烃
不饱和烃
饱和烃(烷烃)
链状烷烃
环状烷烃
甲烷、乙烷等
环己烷等
烯烃
炔烃
芳香烃
有机化合物
结构
性质
用途
碳原子的成键特点
官能团
碳骨架
基本营养物质
高分子材料
物理性质、化学性质
决定
分类
甲烷
乙烯
乙醇
乙酸
常见的有机化合物类别
常见的有机化合物类别
甲烷与氯气,光照条件下发生反应
乙烯与溴、水等发生反应
乙烯发生加聚反应
乙醇与氧气发生催化氧化反应
乙醇与乙酸发生酯化反应
几种有机化学反应
有机化合物的转化
已知A是乙烯,请写出B-F的结构简式。
已知A是乙烯,请写出B-F的结构简式。
B: CH3CH2OH C: CH3CHO
D: CH3COOH E: CH3COOCH2CH3
F: CH3CH2Cl G:
[ CH2—CH2 ]n
有机化合物
结构
性质
用途
碳原子的成键特点
官能团
碳骨架
基本营养物质
高分子材料
物理性质、化学性质
决定
分类
甲烷
乙烯
乙醇
乙酸
必修课程
主题3:物质结构基础与化学反应规律
主题4:简单的有机化合物及其应用
主题5:化学与社会发展
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
必修第一册与第二册总复习
高一年级 化学
必修第一册的目录必修第二册的目录必修课程
主题3:物质结构基础与化学反应规律
主题4:简单的有机化合物及其应用
主题5:化学与社会发展
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
主题5:化学与社会发展
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
主题3:物质结构基础与化学反应规律
同学1:物质的性质多样,如何才能记得全面?
同学2:物质之间的转化复杂,怎样才能记住?
SO2的化学性质
1.能与水反应
3.能与碱性氧化物反应
4.能与O2、Cl2等氧化剂反应
5.能与H2S反应
6.有漂白性
酸性氧化物
硫元素的价态
2.能与碱反应
特性
硫及其化合物
-2
0
+4
+6
化合价
物质类别
H2S
S2-
S
SO2
SO3
H2SO4
H2SO3
-2
0
+4
+6
化合价
物质类别
H2S
S2-
S
SO2
SO3
H2SO4
H2SO3
氧化反应
硫及其化合物
H2S
S
SO2
O2 点燃
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
O2或Cl2+H2O
O2 催化剂 △
SO2
H2SO3
Na2SO3
化合价
硫及其化合物
-2
0
+4
+6
化合价
物质类别
H2S
S2-
S
SO2
SO3
H2SO4
H2SO3
还原反应
硫及其化合物
H2S
S
SO2
H2
O2 点燃
H2S
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
O2或Cl2+H2O
△ C或Cu
O2 催化剂 △
SO2
H2SO3
Na2SO3
化合价
硫及其化合物
H2S
S
SO2
H2
H2S
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
SO2
H2SO3
Na2SO3
FeS
Fe △
Na △
Na2S
化合价
Cu2S
Cu △
硫及其化合物
O2 点燃
O2或Cl2+H2O
△ C或Cu
O2 催化剂 △
H2S
S
SO2
H2
H2S
H2SO4
SO3
Na2SO4
O2或Cl2+H2O
O2或Cl2+H2O
SO2
H2SO3
Na2SO3
FeS
Cu2S
H2SO4
Fe,△
Cu,△
NaOH
HCl
Na2S
Na2SO3
H2O
H2O
NaOH
BaSO4
BaCl2或Ba(OH)2
Na,△
物质类别
NaOH
H2SO4
硫及其化合物
O2 点燃
O2或Cl2+H2O
△ C或Cu
O2 催化剂 △
(2)如何设计实验验证你的猜想?
【思考】
(1)硫化钠长时间放置会变质,可能生成什么?
物质类别
-2
0
+4
+6
化合价
Na2S
?
(2)如何设计实验验证你的猜想?
【思考】
(1)硫化钠长时间放置会变质,可能生成什么?
假设1:变质生成Na2SO4
假设2:变质生成Na2SO3
……
【思考】
(1)硫化钠长时间放置会变质,可能生成什么?
(2)如何设计实验验证你的猜想?
假设3:变质生成S
物质类别
化合价变化
物质性质及转化的认识角度
抓住物质的一般性质和特殊性质
建构不同类别物质之间的转化关系
判断物质有氧化性或者还原性
建构不同价态含同种元素的物质之间的转化关系
单质、氧化物、酸、碱、盐之间的转化关系
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO3
Na2SO3
物质类别
化合价变化
物质性质及转化的认识角度
抓住物质的一般性质和特殊性质
建构不同类别物质之间的转化关系
判断物质有氧化性或者还原性
建构不同价态含同种元素的物质之间的转化关系
化学反应
离子反应
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应的基本概念
氧化还原反应的基本概念
失去
还原性
氧化
氧化性
还原
得到
常见的氧化剂与还原剂
1.常见氧化剂:
X-
常见的氧化剂与还原剂
1.常见氧化剂:
1.常见氧化剂:
1.常见氧化剂:
Fe2+或Fe
NO或NO2
SO2
Mn2+
1.常见氧化剂:
2.常见还原剂:
包括活泼的金属单质、某些非金属单质、元素处于低价态时的物质(化合物、低价态金属阳离子、非金属阴离子、氢化物等)。如
2.常见还原剂:
包括活泼的金属单质、某些非金属单质、元素处于低价态时的物质(化合物、低价态金属阳离子、非金属阴离子、氢化物等)。如
Zn2+
H+
CO2
Fe3+
S
I2
H2
O2
H2O
NH3·H2O
N2
NH3
NO
NO2
HNO3
O2
O2
H2O
H2O
氮及其化合物
Cu
Cu
△
OH-
H+
△
物质类别
化合价
催化剂,△
△
NaCl
HCl
Cl2
HClO
NaClO
MnO2 △
HCl
NaOH
H2O
NaOH
H2 点燃
氯及其化合物
NaOH
Cl-
I-、Br-、 Fe2+ 、 SO2等
Na
Na2O
NaOH
Na2CO3和NaHCO3
单质
氧化物
碱
盐
化学性质
物理性质
制法
用途
……
反应的分类
物质的分类
……
物质类别
钠及其化合物
研究内容
研究视角
金属单质及其化合物
Na2S
Na
NaOH
Na2CO3
Na2O
Na2O2
NaCl
NaHCO3
S
O2
H2O
H2O
H2O
CO2
CO2
HCl
Ca(OH)2
Cl2 点燃
△
CO2+H2O
O2 △
钠及其化合物
CO2
△
铁及其化合物
Fe
Fe3O4
FeO
Fe2O3
亚铁盐
铁盐
Fe(OH)2
Fe(OH)3
红色溶液
H+
OH-
O2或H2O
C或CO
加KSCN
溶液
CO
CO
O2+H2O
还原
氧化
O2
H+
H+
OH-
Fe3+
H+
△
H+
H+
H+
元素周期表
主族元素性质递变规律
几种非金属元素性质比较
几种金属元素性质比较
“位、构、性”之间的关系
位置
结构
性质
反 映
决 定
反 映
决 定
推测
推测
周期
族
(1)原子核
(2)核外电子
元素性质
单质性质
化合物性质
离子性质
主族元素砷(As)的部分信息如图所示。
i.砷(As)在周期表中的位置是_____________________。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. N的气态氢化物的还原性大于砷的气态氢化物的还原性
思考
第4周期,ⅤA族
主族元素砷(As)的部分信息如图所示。
i.砷(As)在周期表中的位置是_____________________。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. N的气态氢化物的还原性大于砷的气态氢化物的还原性
思考
第4周期,ⅤA族
b
主族元素砷(As)的部分信息如图所示。
i.砷(As)在周期表中的位置是_____________________。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. N的气态氢化物的还原性大于砷的气态氢化物的还原性
思考
主族元素性质递变规律
化学反应中为什么会有能量变化?
化学反应中为什么会有能量变化?
化学反应中能量变化的本质原因
化学反应中能量变化的本质原因
为什么氢气在氧气中燃烧会放出热量?
2H2 + O2
2H2O
点燃
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
化合价
物质类别
主题3:物质结构基础与化学反应规律
主题5:化学与社会发展
主题3:物质结构基础与化学反应规律
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
主题4:简单的有机化合物及其应用
官能团
碳骨架
主题5:化学与社会发展
有机化合物
结构
性质
用途
碳原子的成键特点
官能团
碳骨架
基本营养物质
高分子材料
物理性质、化学性质
决定
分类
甲烷
乙烯
乙醇
乙酸
烃
不饱和烃
饱和烃(烷烃)
链状烷烃
环状烷烃
甲烷、乙烷等
环己烷等
烯烃
炔烃
芳香烃
有机化合物
结构
性质
用途
碳原子的成键特点
官能团
碳骨架
基本营养物质
高分子材料
物理性质、化学性质
决定
分类
甲烷
乙烯
乙醇
乙酸
常见的有机化合物类别
常见的有机化合物类别
甲烷与氯气,光照条件下发生反应
乙烯与溴、水等发生反应
乙烯发生加聚反应
乙醇与氧气发生催化氧化反应
乙醇与乙酸发生酯化反应
几种有机化学反应
有机化合物的转化
已知A是乙烯,请写出B-F的结构简式。
已知A是乙烯,请写出B-F的结构简式。
B: CH3CH2OH C: CH3CHO
D: CH3COOH E: CH3COOCH2CH3
F: CH3CH2Cl G:
[ CH2—CH2 ]n
有机化合物
结构
性质
用途
碳原子的成键特点
官能团
碳骨架
基本营养物质
高分子材料
物理性质、化学性质
决定
分类
甲烷
乙烯
乙醇
乙酸
必修课程
主题3:物质结构基础与化学反应规律
主题4:简单的有机化合物及其应用
主题5:化学与社会发展
主题1:化学科学与实验探究
主题2:常见的无机物及其应用
同课章节目录
