化学人教版(2019)选择性必修3 1.1.2 有机化合物中的共价键、同分异构现象(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.1.2 有机化合物中的共价键、同分异构现象(共38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 08:19:01 | ||
图片预览


文档简介
(共38张PPT)
第一章
有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
课时2 有机化合物中的共价键、同分异构现象
新人教化学选择性必修3《有机化学基础》
学习目标
1.认识有机化合物分子结构中共价键极性。
2.能初步根据有机化合物的分子结构特点对其化学性质和有机反应规律进行分析预测。
3. 认识有机化合物的同分异构现象,能辨识常见有机化合物的碳架异构、位置异构和官能团异构。
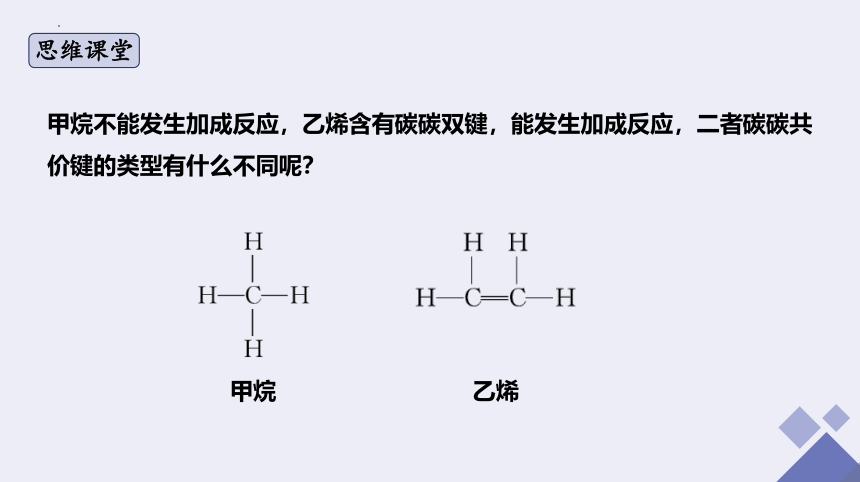
甲烷不能发生加成反应,乙烯含有碳碳双键,能发生加成反应,二者碳碳共价键的类型有什么不同呢?
甲烷
乙烯
共价键的类型
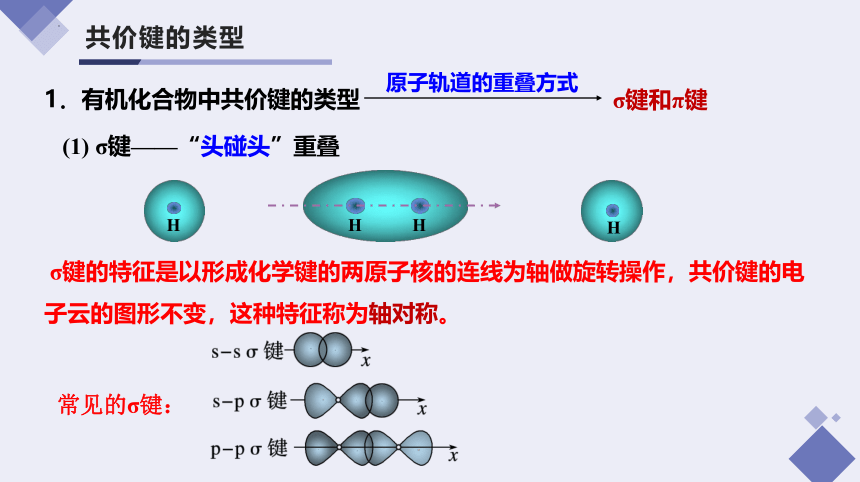
1.有机化合物中共价键的类型
原子轨道的重叠方式
σ键和π键
(1) σ键——“头碰头”重叠
σ键的特征是以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称。
常见的σ键:
H
H
H
H
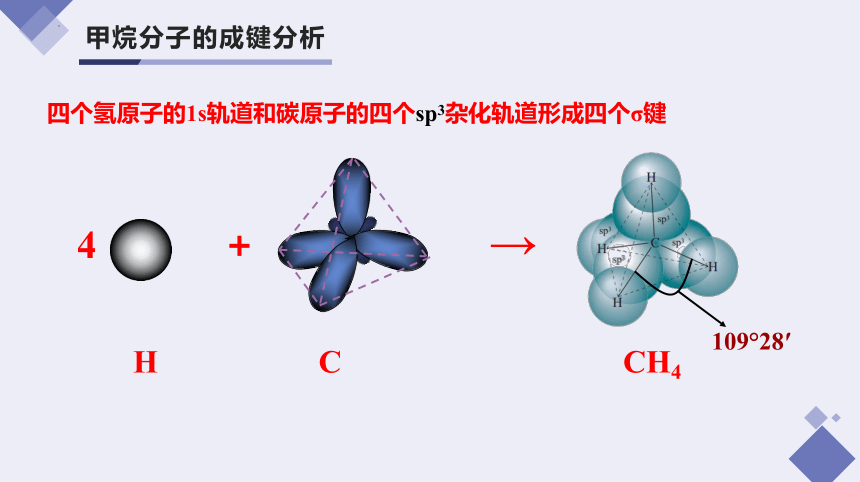
甲烷分子的成键分析
109°28′
四个氢原子的1s轨道和碳原子的四个sp3杂化轨道形成四个σ键
4 + →
H C CH4
共价键的类型
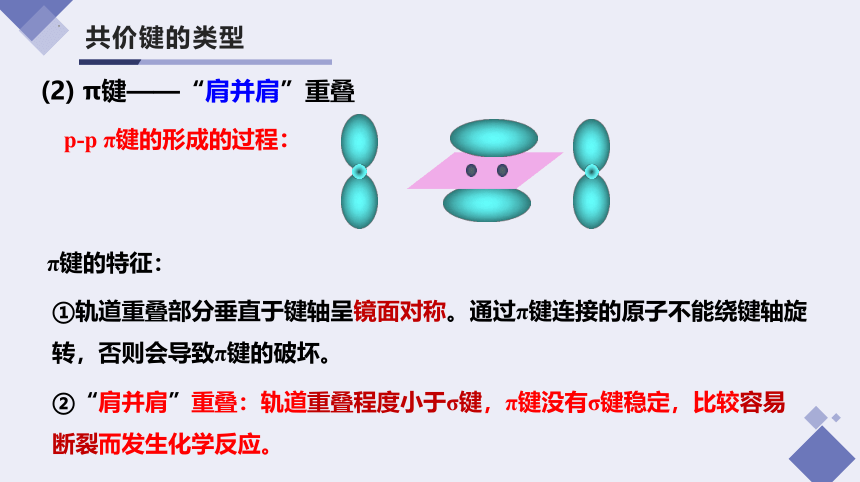
p-p π键的形成的过程:
(2) π键——“肩并肩”重叠
②“肩并肩”重叠:轨道重叠程度小于σ键,π键没有σ键稳定,比较容易断裂而发生化学反应。
π键的特征:
①轨道重叠部分垂直于键轴呈镜面对称。通过π键连接的原子不能绕键轴旋转,否则会导致π键的破坏。
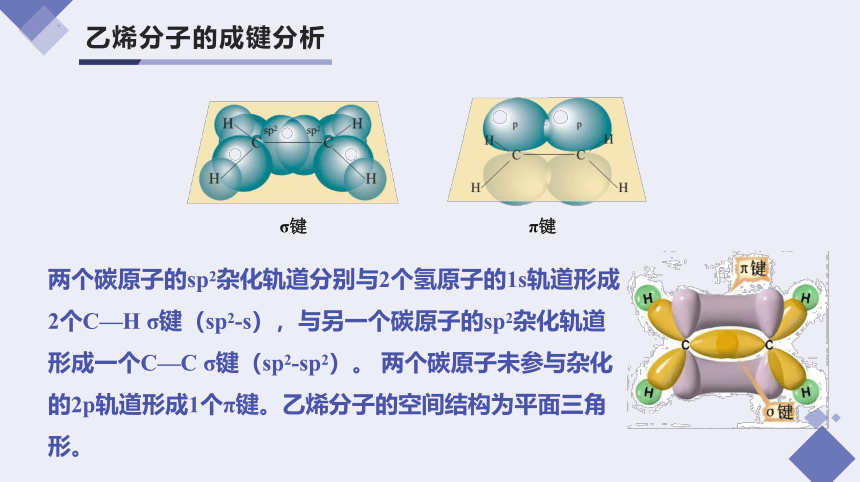
乙烯分子的成键分析
两个碳原子的sp2杂化轨道分别与2个氢原子的1s轨道形成2个C—H σ键(sp2-s),与另一个碳原子的sp2杂化轨道形成一个C—C σ键(sp2-sp2)。 两个碳原子未参与杂化的2p轨道形成1个π键。乙烯分子的空间结构为平面三角形。
σ键
π键
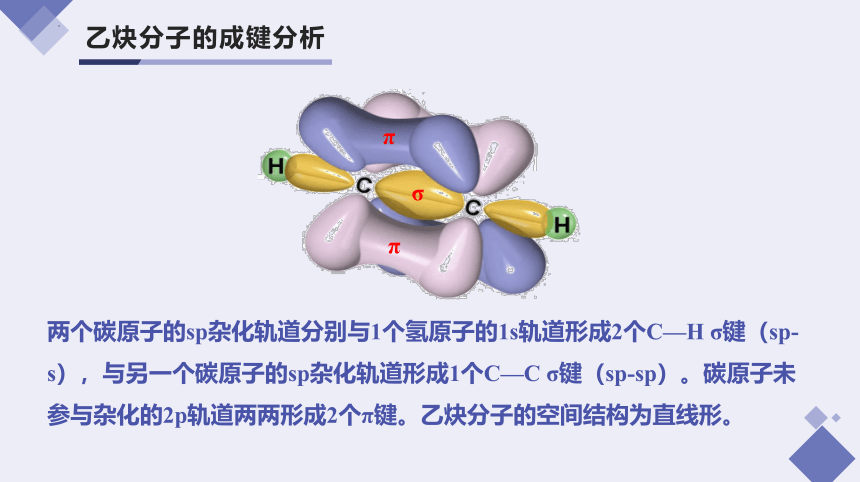
乙炔分子的成键分析
两个碳原子的sp杂化轨道分别与1个氢原子的1s轨道形成2个C—H σ键(sp-s),与另一个碳原子的sp杂化轨道形成1个C—C σ键(sp-sp)。碳原子未参与杂化的2p轨道两两形成2个π键。乙炔分子的空间结构为直线形。
σ
π
π
共价键的类型
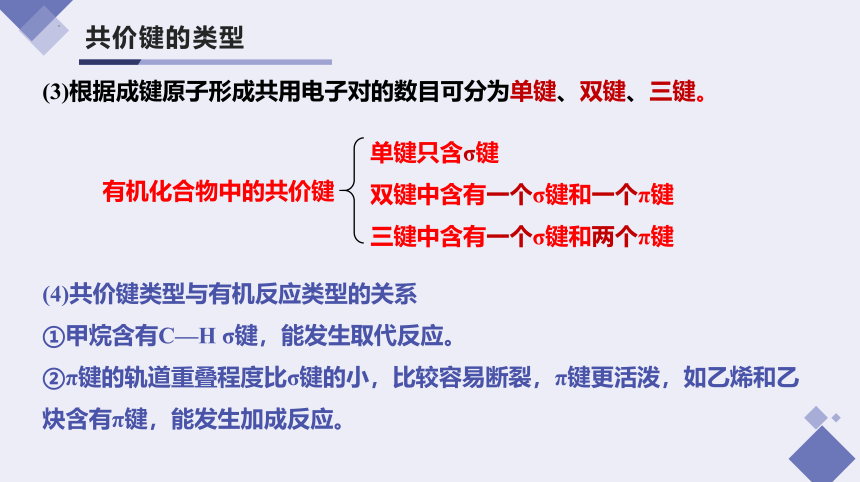
(3)根据成键原子形成共用电子对的数目可分为单键、双键、三键。
(4)共价键类型与有机反应类型的关系
①甲烷含有C—H σ键,能发生取代反应。
②π键的轨道重叠程度比σ键的小,比较容易断裂,π键更活泼,如乙烯和乙炔含有π键,能发生加成反应。
有机化合物中的共价键
单键只含σ键
双键中含有一个σ键和一个π键
三键中含有一个σ键和两个π键
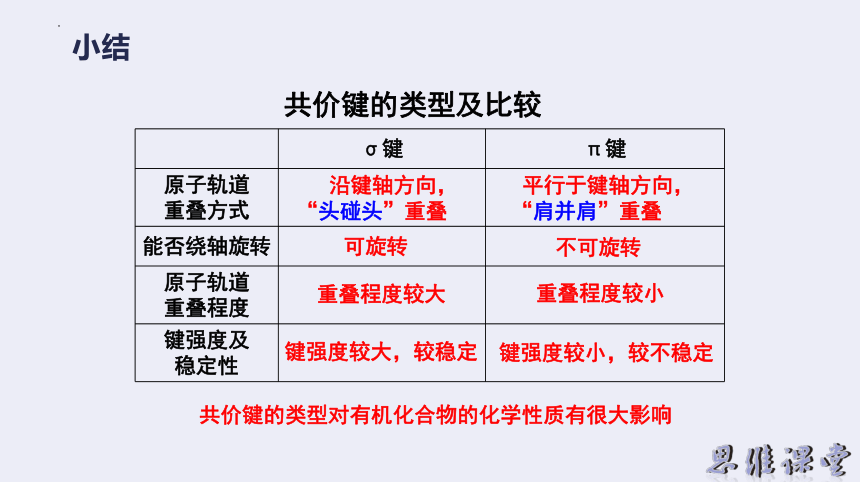
σ键 π键
原子轨道 重叠方式
能否绕轴旋转
原子轨道 重叠程度
键强度及 稳定性
平行于键轴方向,
“肩并肩”重叠
沿键轴方向,
“头碰头”重叠
可旋转
不可旋转
重叠程度较大
重叠程度较小
键强度较大,较稳定
键强度较小,较不稳定
共价键的类型对有机化合物的化学性质有很大影响
共价键的类型及比较
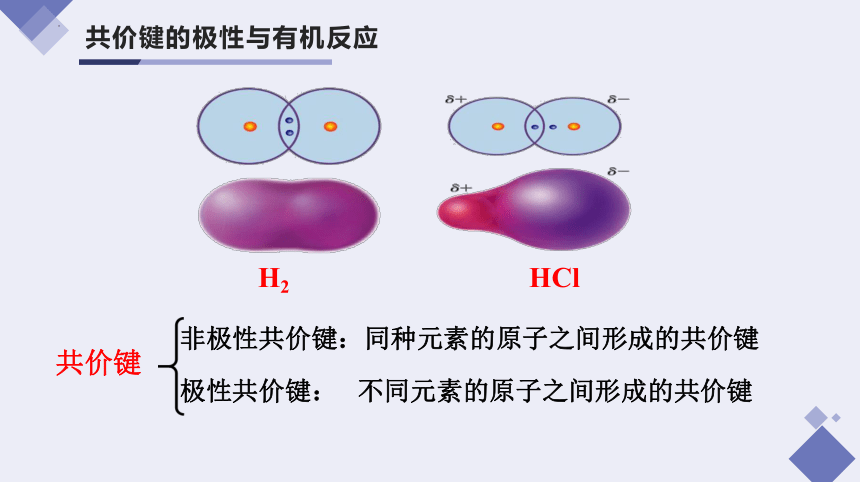
共价键的极性与有机反应
H2
HCl
非极性共价键:同种元素的原子之间形成的共价键
极性共价键: 不同元素的原子之间形成的共价键
共价键
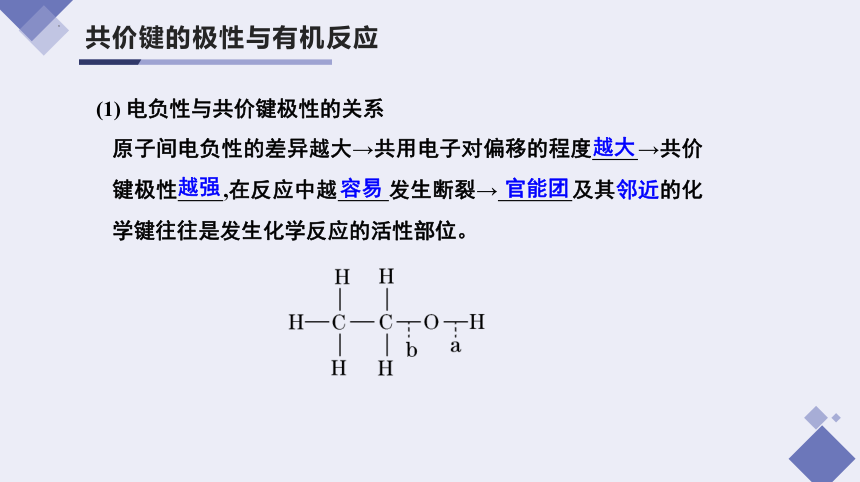
共价键的极性与有机反应
(1) 电负性与共价键极性的关系
原子间电负性的差异越大→共用电子对偏移的程度 →共价键极性 ,在反应中越 发生断裂→ 及其邻近的化学键往往是发生化学反应的活性部位。
越大
越强
容易
官能团
共价键的极性与有机反应
邻近基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
有机化合物分子中共价键断裂的位置存在多种可能。因此相对无机反应,有机反应的副反应较多,产物比较复杂,速率也比较慢。
(2) 基团之间的相互影响
实验——钠与乙醇、水反应的对比
实验操作
现象 都有 ,乙醇与钠的反应的剧烈程度 水与钠的反应
气泡产生
小于
【问题1】乙醇为什么能和金属钠反应?
乙醇分子中的氢氧键极性较强,能够发生断裂。
实验——钠与乙醇、水反应的对比
实验操作
现象 都有 ,乙醇与钠的反应的剧烈程度 水与钠的反应
【问题2】为什么乙醇与钠反应不如水与钠反应剧烈?
氢氧键的极性:水 > 乙醇
气泡产生
小于
实验——钠与乙醇、水反应的对比
羟基中氧原子的电负性 ,乙醇分子中的碳氧键极性也较 , 反应中 , 键发生了断裂。
【问题3】在这个反应中乙醇的断键位置在哪里?
+ H-Br + H2O
较大
强
碳氧
同样条件下,乙酸、无水乙醇、水分别与钠的反应剧烈程度比较?
乙酸 > 水 >乙醇
结论:乙酸分子中的H-O的极性 > 水中的H-O的极性 >乙醇中的H-O的极性
【解释】由于乙酸中羰基的吸电子效应,使其分子中H-O的极性比水中H-O的强,故乙酸具有弱酸性。
试从键的极性强弱角度比较甲酸、乙酸、丙酸的酸性强弱?
烃基为推电子基团,烃基越长推电子效应越大,使羧基中的羟基极性越小,羧酸的酸性越弱。
甲酸>乙酸>丙酸
1.正误判断
(1)σ键比π键牢固,所以不会断裂( )
(2)甲烷分子中只有C—H σ键,只能发生取代反应( )
(3)乙烯分子中含有π键,所以化学性质比甲烷活泼( )
(4)乙酸与钠反应比水与钠反应更剧烈,是因为乙酸分子中氢氧键的极性更强
( )
×
×
√
√
2.下列关于有机化合物中化学键的说法不正确的是
A.烷烃中的化学键均为σ键
B.CH3NH2中C—H的极性比N—H的极性弱
C.乙烯分子中含有极性键和非极性键
D.1个丙炔分子中含有5个σ键和3个π键
√
电负性:N > C
HC≡C—CH3
6个σ键、2个π键
②CH2 CH2 + Br2 CH2Br-CH2Br
3. 分析下列反应中有机化合物的断键情况,并归纳其反应类型。
断C-H,σ键。
①CH4 + Cl2 CH3Cl + HCl
光
断碳碳双键中的π键。
取代反应
加成反应
4. 某有机物分子的结构简式为 ,该分子
中有 个σ键, 个π键, (填“有”或“没有”)非极性键。
根据共价键的类型和极性可推测该物质可发生 反应和
_______反应,与钠反应的剧烈程度比水与钠反应的 。原因是______________________________________________________
_______________________________________________________。
8
2
有
加成
取代
大
CH2==CHCOOH中 —COOH 中的氢氧键受酮羰基影响,
极性更强,更易断裂
戊烷(C5H12)的三种同分异构体的结构如图所示,回忆同分异构体的知识,完成下表。
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点
不同点
CH3CH2CH2CH2CH3
CH3 CH(CH3)CH2CH3
分子式相同,化学性质相似
碳架异构
CH3 C(CH3)2 CH3
物理性质不同,支链越多,沸点越低
同分异构现象 同分异构体
1、同分异构现象
化合物具有相同的分子式,但具有不同的结构的现象。
2、同分异构体
具有同分异构现象的化合物互为同分异构体。
一般情况下,有机化合物分子中的碳原子数目越多,其同分异构体的数目也越多。
碳原子数 1 2 3 4 5 6 7 8 9 10
同分异体数 无 无 无 2 3 5 9 18 35 75
3、烷烃的碳原子数与其对应的同分异构体数
同分异构现象
手性异构
阅读教材p9 表1-2,总结同分异构现象分类
同分异构现象
构造异构
立体异构
顺反异构
对映异构
碳架异构
位置异构
官能团异构
一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称为手性异构体。有手性异构体的分子称为手性分子。
含有手性碳原子的有机物才有对映异构(手性异构)
1. 用“ * ” 标出下列有机物的手性碳,判断其是否为手性分子
*
CH3—CH—CH2—CH3
OH
*
2、下列各组物质中,互为同分异构体的是 ( )
A. 与
B. HC≡C—(CH2)3CH3 与
C. CH3CH2OCH2CH3 与
D. 与
B
3、下列关于同分异构体异构方式的说法中,不正确的是( )
A.CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构
B.H3CC≡CCH3和CH2==CHCH==CH2属于官能团异构
C.CH2==C(CH3)2和CH3CH==CHCH3属于官能团异构
D. 和 属于位置异构
C
在表示有机化合物的组成和结构时,将 元素符号省略,只表示分子中键的连接情况和 ,每个拐点或终点均表示有一个 ,这样得到的式子称为键线式。例如:丙烯可表示为 ,乙醇可表示为 。
碳、氢
官能团
碳原子
有机化合物键线式书写时的注意事项
(1) 一般表示含有3个及3个以上碳原子的有机化合物。
(2) 只忽略C—H,其余的化学键不能忽略。
(3) 碳、氢原子不标注,其余原子必须标注
(含羟基、醛基和羧基中的氢原子)。
(4) 由键线式写分子式时不能忘记两端的碳原子。
4、下列有关物质的表达式正确的是 ( )
A. 乙炔分子的球棍模型:
B. 羟基的电子式:
C. 2-氯丙烷的结构简式:CH3CHClCH3
D. 丙烯的键线式:
C
同分异构体书写方法
1、碳架异构的书写方法
(1)口诀: 主链由长到短,支链由整到散,
位置由心到边,排列由邻到间
(2)注意:
主链上放支链前先找出中心对称线;
支链不能挂端点,支链不能比端基长;
(甲基不能连接在主链的两端,乙基不能连接在两端的第二位)
对称位置上的C原子等效,只能用一个,否则重复。
写出己烷(C6H14)的所有同分异构体的结构简式
(2)主链减少1个碳:主链为5个碳原子,支链有1个甲基
(1)一条直链:
(3)主链减少2个碳: 主链为4个碳原子,支链有1个乙基或2个甲基
同分异构体的书写方法
2、位置异构的书写方法——取代法
方法:写出所有的碳链异构,移动官能团,由心到边,可到端。
尝试应用:写出C4H9Cl的属于卤代烃的同分异构体
①
②
碳架异构
①
②
位置异构
②
③ ④
同分异构体的书写方法
3、官能团异构
尝试应用:写出C4H10O的同分异构体
①碳链异构 C—C—C—C
②位置异构
③官能团异构 C—O—C—C—C、
C—C—O—C—C
方法:首先判断有哪些官能团类别(官能团异构),然后写出
碳链异构,再逐个写同种官能团的位置异构。
等效氢
1、同一碳原子上的氢等效
2、同一碳原子上所连甲基上的氢等效
3、位于处于镜面对称位置上的氢等效
4、苯环上的氢等效
CH3CH2CH2CH2CH3
① ② ③ ② ①
b
b
b
b
a
a
a
a
③
①
②
下列物质的一氯代物有几种?
四同比较
同系物 同分异构体 同素异形体 同位素
定义
对象
性质 化学性质几乎相同,物理性质有差异 化学性质、物理性质可能相似、可能不同 化学性质相似,物理性质有递变性 化学性质相同,物理性质有差异
举例 CH4 CH3CH3 金刚石、石墨 O2 O3 1H 2H 3H
结构相似,组成相差一个或几个CH2
分子式相同,结构不同
同种元素的不同单质
质子数相同,中子数不同
有机物
单质
有机物
原子
CH3CH=CH2
第一章
有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
课时2 有机化合物中的共价键、同分异构现象
新人教化学选择性必修3《有机化学基础》
学习目标
1.认识有机化合物分子结构中共价键极性。
2.能初步根据有机化合物的分子结构特点对其化学性质和有机反应规律进行分析预测。
3. 认识有机化合物的同分异构现象,能辨识常见有机化合物的碳架异构、位置异构和官能团异构。
甲烷不能发生加成反应,乙烯含有碳碳双键,能发生加成反应,二者碳碳共价键的类型有什么不同呢?
甲烷
乙烯
共价键的类型
1.有机化合物中共价键的类型
原子轨道的重叠方式
σ键和π键
(1) σ键——“头碰头”重叠
σ键的特征是以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称。
常见的σ键:
H
H
H
H
甲烷分子的成键分析
109°28′
四个氢原子的1s轨道和碳原子的四个sp3杂化轨道形成四个σ键
4 + →
H C CH4
共价键的类型
p-p π键的形成的过程:
(2) π键——“肩并肩”重叠
②“肩并肩”重叠:轨道重叠程度小于σ键,π键没有σ键稳定,比较容易断裂而发生化学反应。
π键的特征:
①轨道重叠部分垂直于键轴呈镜面对称。通过π键连接的原子不能绕键轴旋转,否则会导致π键的破坏。
乙烯分子的成键分析
两个碳原子的sp2杂化轨道分别与2个氢原子的1s轨道形成2个C—H σ键(sp2-s),与另一个碳原子的sp2杂化轨道形成一个C—C σ键(sp2-sp2)。 两个碳原子未参与杂化的2p轨道形成1个π键。乙烯分子的空间结构为平面三角形。
σ键
π键
乙炔分子的成键分析
两个碳原子的sp杂化轨道分别与1个氢原子的1s轨道形成2个C—H σ键(sp-s),与另一个碳原子的sp杂化轨道形成1个C—C σ键(sp-sp)。碳原子未参与杂化的2p轨道两两形成2个π键。乙炔分子的空间结构为直线形。
σ
π
π
共价键的类型
(3)根据成键原子形成共用电子对的数目可分为单键、双键、三键。
(4)共价键类型与有机反应类型的关系
①甲烷含有C—H σ键,能发生取代反应。
②π键的轨道重叠程度比σ键的小,比较容易断裂,π键更活泼,如乙烯和乙炔含有π键,能发生加成反应。
有机化合物中的共价键
单键只含σ键
双键中含有一个σ键和一个π键
三键中含有一个σ键和两个π键
σ键 π键
原子轨道 重叠方式
能否绕轴旋转
原子轨道 重叠程度
键强度及 稳定性
平行于键轴方向,
“肩并肩”重叠
沿键轴方向,
“头碰头”重叠
可旋转
不可旋转
重叠程度较大
重叠程度较小
键强度较大,较稳定
键强度较小,较不稳定
共价键的类型对有机化合物的化学性质有很大影响
共价键的类型及比较
共价键的极性与有机反应
H2
HCl
非极性共价键:同种元素的原子之间形成的共价键
极性共价键: 不同元素的原子之间形成的共价键
共价键
共价键的极性与有机反应
(1) 电负性与共价键极性的关系
原子间电负性的差异越大→共用电子对偏移的程度 →共价键极性 ,在反应中越 发生断裂→ 及其邻近的化学键往往是发生化学反应的活性部位。
越大
越强
容易
官能团
共价键的极性与有机反应
邻近基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
有机化合物分子中共价键断裂的位置存在多种可能。因此相对无机反应,有机反应的副反应较多,产物比较复杂,速率也比较慢。
(2) 基团之间的相互影响
实验——钠与乙醇、水反应的对比
实验操作
现象 都有 ,乙醇与钠的反应的剧烈程度 水与钠的反应
气泡产生
小于
【问题1】乙醇为什么能和金属钠反应?
乙醇分子中的氢氧键极性较强,能够发生断裂。
实验——钠与乙醇、水反应的对比
实验操作
现象 都有 ,乙醇与钠的反应的剧烈程度 水与钠的反应
【问题2】为什么乙醇与钠反应不如水与钠反应剧烈?
氢氧键的极性:水 > 乙醇
气泡产生
小于
实验——钠与乙醇、水反应的对比
羟基中氧原子的电负性 ,乙醇分子中的碳氧键极性也较 , 反应中 , 键发生了断裂。
【问题3】在这个反应中乙醇的断键位置在哪里?
+ H-Br + H2O
较大
强
碳氧
同样条件下,乙酸、无水乙醇、水分别与钠的反应剧烈程度比较?
乙酸 > 水 >乙醇
结论:乙酸分子中的H-O的极性 > 水中的H-O的极性 >乙醇中的H-O的极性
【解释】由于乙酸中羰基的吸电子效应,使其分子中H-O的极性比水中H-O的强,故乙酸具有弱酸性。
试从键的极性强弱角度比较甲酸、乙酸、丙酸的酸性强弱?
烃基为推电子基团,烃基越长推电子效应越大,使羧基中的羟基极性越小,羧酸的酸性越弱。
甲酸>乙酸>丙酸
1.正误判断
(1)σ键比π键牢固,所以不会断裂( )
(2)甲烷分子中只有C—H σ键,只能发生取代反应( )
(3)乙烯分子中含有π键,所以化学性质比甲烷活泼( )
(4)乙酸与钠反应比水与钠反应更剧烈,是因为乙酸分子中氢氧键的极性更强
( )
×
×
√
√
2.下列关于有机化合物中化学键的说法不正确的是
A.烷烃中的化学键均为σ键
B.CH3NH2中C—H的极性比N—H的极性弱
C.乙烯分子中含有极性键和非极性键
D.1个丙炔分子中含有5个σ键和3个π键
√
电负性:N > C
HC≡C—CH3
6个σ键、2个π键
②CH2 CH2 + Br2 CH2Br-CH2Br
3. 分析下列反应中有机化合物的断键情况,并归纳其反应类型。
断C-H,σ键。
①CH4 + Cl2 CH3Cl + HCl
光
断碳碳双键中的π键。
取代反应
加成反应
4. 某有机物分子的结构简式为 ,该分子
中有 个σ键, 个π键, (填“有”或“没有”)非极性键。
根据共价键的类型和极性可推测该物质可发生 反应和
_______反应,与钠反应的剧烈程度比水与钠反应的 。原因是______________________________________________________
_______________________________________________________。
8
2
有
加成
取代
大
CH2==CHCOOH中 —COOH 中的氢氧键受酮羰基影响,
极性更强,更易断裂
戊烷(C5H12)的三种同分异构体的结构如图所示,回忆同分异构体的知识,完成下表。
物质名称 正戊烷 异戊烷 新戊烷
结构简式
相同点
不同点
CH3CH2CH2CH2CH3
CH3 CH(CH3)CH2CH3
分子式相同,化学性质相似
碳架异构
CH3 C(CH3)2 CH3
物理性质不同,支链越多,沸点越低
同分异构现象 同分异构体
1、同分异构现象
化合物具有相同的分子式,但具有不同的结构的现象。
2、同分异构体
具有同分异构现象的化合物互为同分异构体。
一般情况下,有机化合物分子中的碳原子数目越多,其同分异构体的数目也越多。
碳原子数 1 2 3 4 5 6 7 8 9 10
同分异体数 无 无 无 2 3 5 9 18 35 75
3、烷烃的碳原子数与其对应的同分异构体数
同分异构现象
手性异构
阅读教材p9 表1-2,总结同分异构现象分类
同分异构现象
构造异构
立体异构
顺反异构
对映异构
碳架异构
位置异构
官能团异构
一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称为手性异构体。有手性异构体的分子称为手性分子。
含有手性碳原子的有机物才有对映异构(手性异构)
1. 用“ * ” 标出下列有机物的手性碳,判断其是否为手性分子
*
CH3—CH—CH2—CH3
OH
*
2、下列各组物质中,互为同分异构体的是 ( )
A. 与
B. HC≡C—(CH2)3CH3 与
C. CH3CH2OCH2CH3 与
D. 与
B
3、下列关于同分异构体异构方式的说法中,不正确的是( )
A.CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构
B.H3CC≡CCH3和CH2==CHCH==CH2属于官能团异构
C.CH2==C(CH3)2和CH3CH==CHCH3属于官能团异构
D. 和 属于位置异构
C
在表示有机化合物的组成和结构时,将 元素符号省略,只表示分子中键的连接情况和 ,每个拐点或终点均表示有一个 ,这样得到的式子称为键线式。例如:丙烯可表示为 ,乙醇可表示为 。
碳、氢
官能团
碳原子
有机化合物键线式书写时的注意事项
(1) 一般表示含有3个及3个以上碳原子的有机化合物。
(2) 只忽略C—H,其余的化学键不能忽略。
(3) 碳、氢原子不标注,其余原子必须标注
(含羟基、醛基和羧基中的氢原子)。
(4) 由键线式写分子式时不能忘记两端的碳原子。
4、下列有关物质的表达式正确的是 ( )
A. 乙炔分子的球棍模型:
B. 羟基的电子式:
C. 2-氯丙烷的结构简式:CH3CHClCH3
D. 丙烯的键线式:
C
同分异构体书写方法
1、碳架异构的书写方法
(1)口诀: 主链由长到短,支链由整到散,
位置由心到边,排列由邻到间
(2)注意:
主链上放支链前先找出中心对称线;
支链不能挂端点,支链不能比端基长;
(甲基不能连接在主链的两端,乙基不能连接在两端的第二位)
对称位置上的C原子等效,只能用一个,否则重复。
写出己烷(C6H14)的所有同分异构体的结构简式
(2)主链减少1个碳:主链为5个碳原子,支链有1个甲基
(1)一条直链:
(3)主链减少2个碳: 主链为4个碳原子,支链有1个乙基或2个甲基
同分异构体的书写方法
2、位置异构的书写方法——取代法
方法:写出所有的碳链异构,移动官能团,由心到边,可到端。
尝试应用:写出C4H9Cl的属于卤代烃的同分异构体
①
②
碳架异构
①
②
位置异构
②
③ ④
同分异构体的书写方法
3、官能团异构
尝试应用:写出C4H10O的同分异构体
①碳链异构 C—C—C—C
②位置异构
③官能团异构 C—O—C—C—C、
C—C—O—C—C
方法:首先判断有哪些官能团类别(官能团异构),然后写出
碳链异构,再逐个写同种官能团的位置异构。
等效氢
1、同一碳原子上的氢等效
2、同一碳原子上所连甲基上的氢等效
3、位于处于镜面对称位置上的氢等效
4、苯环上的氢等效
CH3CH2CH2CH2CH3
① ② ③ ② ①
b
b
b
b
a
a
a
a
③
①
②
下列物质的一氯代物有几种?
四同比较
同系物 同分异构体 同素异形体 同位素
定义
对象
性质 化学性质几乎相同,物理性质有差异 化学性质、物理性质可能相似、可能不同 化学性质相似,物理性质有递变性 化学性质相同,物理性质有差异
举例 CH4 CH3CH3 金刚石、石墨 O2 O3 1H 2H 3H
结构相似,组成相差一个或几个CH2
分子式相同,结构不同
同种元素的不同单质
质子数相同,中子数不同
有机物
单质
有机物
原子
CH3CH=CH2
