2.2.1 化学平衡状态 课件(共26张PPT)
文档属性
| 名称 | 2.2.1 化学平衡状态 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 643.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 21:36:10 | ||
图片预览








文档简介
(共26张PPT)
第1课时 化学平衡状态
学习目标
1. 了解可逆反应与不可逆反应
2. 了解化学平衡状态的建立和特征
一是化学反应速率问题
如何在单位时间内提高合成氨的产量
如何使H2和N2 尽可能多转化为NH3,即反应进行程度
二是化学反应平衡研究问题
化工生产要解决的两个问题
对于 N2 + 3H2 2NH3反应应当考虑哪些条件下可有利于生产 ?
思考:
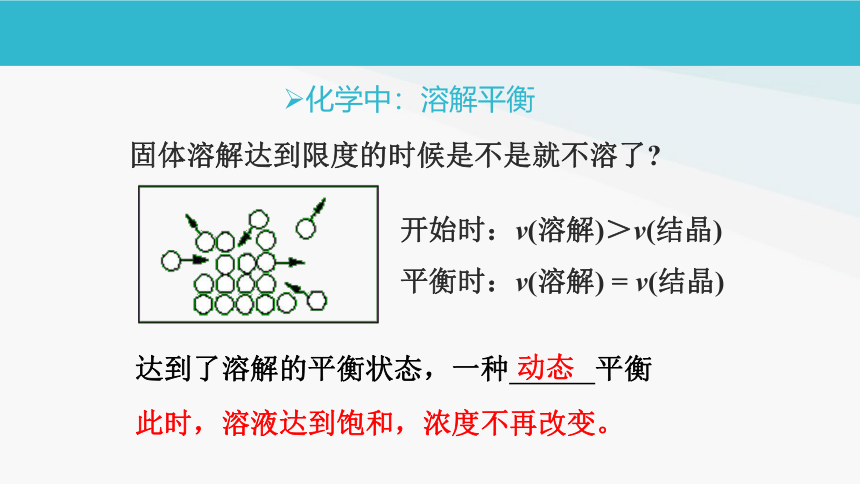
固体溶解达到限度的时候是不是就不溶了
开始时:v(溶解)>v(结晶)
平衡时:v(溶解) = v(结晶)
达到了溶解的平衡状态,一种 平衡
动态
此时,溶液达到饱和,浓度不再改变。
化学中:溶解平衡
一. 可逆反应与不可逆反应
1. 可逆反应的定义:在相同条件下,能同时向正逆反应方向进行的化学反应称为可逆反应。
NH3+H2O
NH3·H2O
NH4++OH-
注意:可逆反应总是不能进行到底,反应物的转化率不能达到100%
得到的总是反应物与生成物的混合物(反应混合物)
在 1 L的容积的密闭容器里,加 1mol CO和 1mol H2O (g) ,能发生什么反应?
CO(g) + H2O(g) CO2(g) + H2 (g)
开始阶段有什么特征?
瞬间过后有什么特征?
以CO与H2O(g)的反应为例来研究化学平衡建立的过程。
开始时c(CO) 、c(H2O)最大,c(CO2) 、c(H2)=0
随着反应的进行, c(CO) 、c(H2O)逐渐减小
c(CO2) 、c(H2)逐渐增大
(1)开始时,v正 v逆= 。
(2)随着反应的进行,v正 ; v逆 。
最大
0
减小
增大
以CO为例,v正为CO的消耗速率;v逆为CO的生成速率
反应进行到一定程度,到了某一时刻,CO的浓度不再改变,v正= v逆≠0 。
其它物质也一样,浓度保持不变,正逆反应速率相等。
这种状态就是-----化学平衡状态
即正反应速率=逆反应速率
正反应速率
逆反应速率
相等
时间
速率
二. 化学平衡状态
1. 定义:
化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
强调
三点
前提条件:
实质:
反应混合物中各组分的浓度保持不变的状态
可逆反应
标志:
v(正)= v(逆) ≠0
2. 化学平衡状态的特征
动态平衡( v(正)≠0,v(逆)≠0 )
反应混合物中各组分的浓度保持不变,各组分的含量一定。
条件改变,原平衡被破坏,在新的条件下建立新的平衡。
(2)动:
(3)等:
(4)定:
(5)变:
v(正)= v(逆)
(1)逆:
正逆反应仍在进行
【例1】 在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
A. C的生成速率与 C分解的速率相等
B. 单位时间生成n mol A,同时生成3n mol B
C. 单位时间生成B的速率,与生成C的速率相等(数值)
D. 单位时间生成n mol A,同时生成2n mol C
AD
怎样理解v(正)= v(逆)?
v正、v逆是指同一化学反应中的同一种物质的消耗或生成,若给出不同物质的数值时,按方程式计量数转换成同一物质进行比较。
3. 判断可逆反应达到平衡状态的标志
可逆反应达到化学平衡状态时有两个主要的特征:
一是正反应速率和逆反应速率相等;
二是反应混合物中各组分的百分含量保持不变。
这两个特征就是判断可逆反应是否达到化学平衡状态的核心性依据。
(1)直接特征:v正=v逆,要求大小相等,方向相反。
a. 速率特征:指“等”,即v正=v逆。有两层含义:对于同一物质而言,该物质的生成速率等于它的消耗速率;对于不同的物质而言,速率之比等于方程式中的化学计量数之比,但必须是不同方向的速率。
b. 含量特征:指“定”,即反应混合物中各组分的含量保持不变。
(2)间接特征:指所表述的内容并非直接而是间接反映“等”和“定”的意义。
a. 反应物的转化率保持不变。
b. 产物的产率保持不变。
c. 平衡体系的颜色保持不变。
d. 绝热的恒容反应体系中的温度保持不变。
(3)“特殊”特征:指所表述的内容并不能表明所有反应均已达到平衡状态,只是在某些特定的情况下才能表示反应已经达到化学平衡状态。
a. 体系中气体物质的总质量保持不变。
b. 体系中气体物质的总物质的量(或体积或分子个数)保持不变。
c. 体系中气体物质的平均相对分子质量保持不变。
d. 气体的总压强不再发生改变。
e. 体系中气体的密度不再发生改变。
以上五项中,对于Δn≠0的可逆反应,如2NO(g)+O2(g) 2NO2(g)来说,除①外均可作为判断平衡的特征;但对于Δn=0的可逆反应如H2(g)+I2(g)
2HI(g)来说,此五项均不能作为判断平衡的特征。
【例2】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC
课时总结
一. 可逆反应判断及特点:
1. 相同条件下,正、逆反应同时进行
2. 反应物转化率不能达到100%,即平衡时反应物不为0,形成反应物与生成物共存状态
2. 两种判断:
①速率是否相等:v正=v逆(同种物质表示)
②数据是否改变:各组分浓度、体积分数、分压等是否改变,混合气体总mol、总压、平均分子量或气体密度是否改变。
1. 五大特点:逆、等、动、定、变
二. 化学平衡状态特点及判断
【例3】 在一定温度下,下列叙述是可逆反应A(g)+3B(g) 2C(g)+2D(s)达到平衡标志的是( )
①C的生成 速率与C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B ③A、B、C的浓度不再变化 ④A、B、C的分压强不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化 ⑦单位时间内消耗a mol A,同时生成 3a mol B ⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
C
A. SO2的消耗速率等于SO3的生成速率
B. SO2的生成速率等于SO3的生成速率
C. SO2的消耗速率等于O2消耗速率的2倍
D. SO3的生成速率等于O2生成速率的2倍
B
当堂检测
1. 在500℃、钒触媒的作用下,某密闭容器中反应 2SO2+O2 2SO3达到化学平衡状态时的标志是( )
2. (双选)可逆反应N2(g)+3H2(g) 2NH3(g),500℃时在 容积为10 L的密闭容器中进行,开始时加入 2 molN2 和 2mol H2,则达到平衡时,NH3的浓度不可能达到的值是 ( )
A.0.1 mol·L—1 B.0.2 mol·L—1
C.0.05 mol·L—1 D.0.15 mol·L—1
BD
3. 下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
AC
4. (双选)密闭容器中进行如下反应:X2(g)+3Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol·L-1、0.6mol·L-1、0.4mol·L-1,当平衡时,下列数据肯定不对的是 ( )
A.X2为0.4mol·L-1,Y2为1.2mol·L-1
B.Y2为1.0mol·L-1
C.X2为0.3mol·L-1,Z为0.2mol·L-1
D.Z为1.0mol·L-1
AD
本节内容结束
第1课时 化学平衡状态
学习目标
1. 了解可逆反应与不可逆反应
2. 了解化学平衡状态的建立和特征
一是化学反应速率问题
如何在单位时间内提高合成氨的产量
如何使H2和N2 尽可能多转化为NH3,即反应进行程度
二是化学反应平衡研究问题
化工生产要解决的两个问题
对于 N2 + 3H2 2NH3反应应当考虑哪些条件下可有利于生产 ?
思考:
固体溶解达到限度的时候是不是就不溶了
开始时:v(溶解)>v(结晶)
平衡时:v(溶解) = v(结晶)
达到了溶解的平衡状态,一种 平衡
动态
此时,溶液达到饱和,浓度不再改变。
化学中:溶解平衡
一. 可逆反应与不可逆反应
1. 可逆反应的定义:在相同条件下,能同时向正逆反应方向进行的化学反应称为可逆反应。
NH3+H2O
NH3·H2O
NH4++OH-
注意:可逆反应总是不能进行到底,反应物的转化率不能达到100%
得到的总是反应物与生成物的混合物(反应混合物)
在 1 L的容积的密闭容器里,加 1mol CO和 1mol H2O (g) ,能发生什么反应?
CO(g) + H2O(g) CO2(g) + H2 (g)
开始阶段有什么特征?
瞬间过后有什么特征?
以CO与H2O(g)的反应为例来研究化学平衡建立的过程。
开始时c(CO) 、c(H2O)最大,c(CO2) 、c(H2)=0
随着反应的进行, c(CO) 、c(H2O)逐渐减小
c(CO2) 、c(H2)逐渐增大
(1)开始时,v正 v逆= 。
(2)随着反应的进行,v正 ; v逆 。
最大
0
减小
增大
以CO为例,v正为CO的消耗速率;v逆为CO的生成速率
反应进行到一定程度,到了某一时刻,CO的浓度不再改变,v正= v逆≠0 。
其它物质也一样,浓度保持不变,正逆反应速率相等。
这种状态就是-----化学平衡状态
即正反应速率=逆反应速率
正反应速率
逆反应速率
相等
时间
速率
二. 化学平衡状态
1. 定义:
化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
强调
三点
前提条件:
实质:
反应混合物中各组分的浓度保持不变的状态
可逆反应
标志:
v(正)= v(逆) ≠0
2. 化学平衡状态的特征
动态平衡( v(正)≠0,v(逆)≠0 )
反应混合物中各组分的浓度保持不变,各组分的含量一定。
条件改变,原平衡被破坏,在新的条件下建立新的平衡。
(2)动:
(3)等:
(4)定:
(5)变:
v(正)= v(逆)
(1)逆:
正逆反应仍在进行
【例1】 在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )
A. C的生成速率与 C分解的速率相等
B. 单位时间生成n mol A,同时生成3n mol B
C. 单位时间生成B的速率,与生成C的速率相等(数值)
D. 单位时间生成n mol A,同时生成2n mol C
AD
怎样理解v(正)= v(逆)?
v正、v逆是指同一化学反应中的同一种物质的消耗或生成,若给出不同物质的数值时,按方程式计量数转换成同一物质进行比较。
3. 判断可逆反应达到平衡状态的标志
可逆反应达到化学平衡状态时有两个主要的特征:
一是正反应速率和逆反应速率相等;
二是反应混合物中各组分的百分含量保持不变。
这两个特征就是判断可逆反应是否达到化学平衡状态的核心性依据。
(1)直接特征:v正=v逆,要求大小相等,方向相反。
a. 速率特征:指“等”,即v正=v逆。有两层含义:对于同一物质而言,该物质的生成速率等于它的消耗速率;对于不同的物质而言,速率之比等于方程式中的化学计量数之比,但必须是不同方向的速率。
b. 含量特征:指“定”,即反应混合物中各组分的含量保持不变。
(2)间接特征:指所表述的内容并非直接而是间接反映“等”和“定”的意义。
a. 反应物的转化率保持不变。
b. 产物的产率保持不变。
c. 平衡体系的颜色保持不变。
d. 绝热的恒容反应体系中的温度保持不变。
(3)“特殊”特征:指所表述的内容并不能表明所有反应均已达到平衡状态,只是在某些特定的情况下才能表示反应已经达到化学平衡状态。
a. 体系中气体物质的总质量保持不变。
b. 体系中气体物质的总物质的量(或体积或分子个数)保持不变。
c. 体系中气体物质的平均相对分子质量保持不变。
d. 气体的总压强不再发生改变。
e. 体系中气体的密度不再发生改变。
以上五项中,对于Δn≠0的可逆反应,如2NO(g)+O2(g) 2NO2(g)来说,除①外均可作为判断平衡的特征;但对于Δn=0的可逆反应如H2(g)+I2(g)
2HI(g)来说,此五项均不能作为判断平衡的特征。
【例2】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC
课时总结
一. 可逆反应判断及特点:
1. 相同条件下,正、逆反应同时进行
2. 反应物转化率不能达到100%,即平衡时反应物不为0,形成反应物与生成物共存状态
2. 两种判断:
①速率是否相等:v正=v逆(同种物质表示)
②数据是否改变:各组分浓度、体积分数、分压等是否改变,混合气体总mol、总压、平均分子量或气体密度是否改变。
1. 五大特点:逆、等、动、定、变
二. 化学平衡状态特点及判断
【例3】 在一定温度下,下列叙述是可逆反应A(g)+3B(g) 2C(g)+2D(s)达到平衡标志的是( )
①C的生成 速率与C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B ③A、B、C的浓度不再变化 ④A、B、C的分压强不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化 ⑦单位时间内消耗a mol A,同时生成 3a mol B ⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
C
A. SO2的消耗速率等于SO3的生成速率
B. SO2的生成速率等于SO3的生成速率
C. SO2的消耗速率等于O2消耗速率的2倍
D. SO3的生成速率等于O2生成速率的2倍
B
当堂检测
1. 在500℃、钒触媒的作用下,某密闭容器中反应 2SO2+O2 2SO3达到化学平衡状态时的标志是( )
2. (双选)可逆反应N2(g)+3H2(g) 2NH3(g),500℃时在 容积为10 L的密闭容器中进行,开始时加入 2 molN2 和 2mol H2,则达到平衡时,NH3的浓度不可能达到的值是 ( )
A.0.1 mol·L—1 B.0.2 mol·L—1
C.0.05 mol·L—1 D.0.15 mol·L—1
BD
3. 下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成
AC
4. (双选)密闭容器中进行如下反应:X2(g)+3Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.2mol·L-1、0.6mol·L-1、0.4mol·L-1,当平衡时,下列数据肯定不对的是 ( )
A.X2为0.4mol·L-1,Y2为1.2mol·L-1
B.Y2为1.0mol·L-1
C.X2为0.3mol·L-1,Z为0.2mol·L-1
D.Z为1.0mol·L-1
AD
本节内容结束
