2.2.3 浓度、压强对化学平衡移动的影响 课件(共26张PPT)
文档属性
| 名称 | 2.2.3 浓度、压强对化学平衡移动的影响 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 576.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 21:39:32 | ||
图片预览






文档简介
(共26张PPT)
第3课时
浓度、压强对化学平衡移动的影响
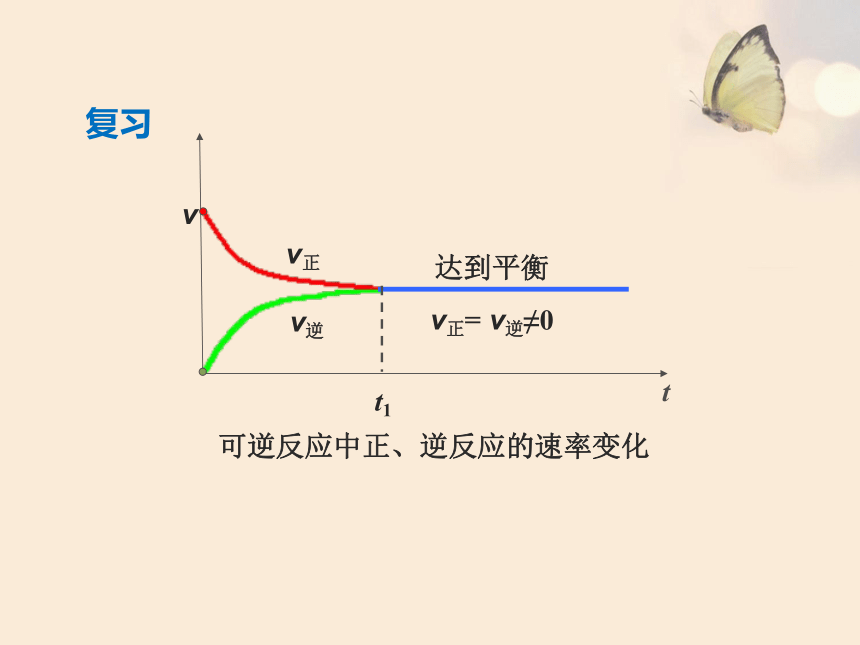
复习
可逆反应中正、逆反应的速率变化
v
t
t1
达到平衡
v正= v逆≠0
v正
v逆
化学平衡
逆:
等:
动:
定:
变:
对象,即可逆反应
本质,即v正= v逆
现象,即反应混合物中各组成的浓度保持不变
特点,即平衡是动态的而非静止的,正、逆反应同时进行, v正= v逆≠0
发展,即条件改变时,可能v正≠ v逆,原平衡就要受
到破坏
化学平衡的移动
条件
改变
一定
时间后
化学平衡的移动
一定条件下的化学平衡
本质 v正= v逆
现象 各组分浓度保持一定
平衡被破坏
v正≠ v逆
各组分浓度保持
新的一定
新条件下的
化学平衡
v′正= v′逆
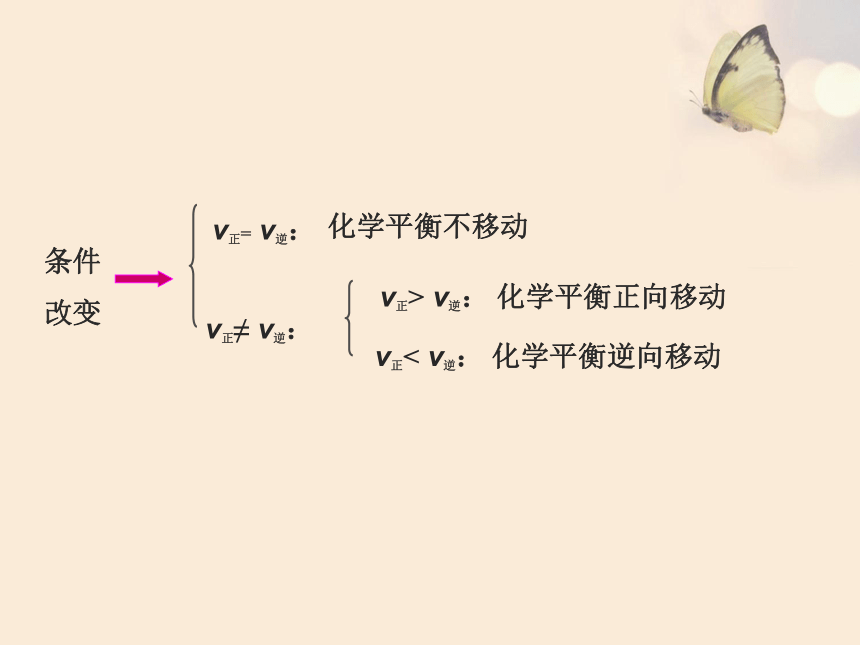
化学平衡的移动:可逆反应中旧化学平衡的破坏、新化学平衡的建立过程。
条件改变
化学平衡不移动
v正< v逆: 化学平衡逆向移动
v正> v逆: 化学平衡正向移动
v正= v逆:
v正≠ v逆:
【实验探究】 硫氰化钾与氯化铁混合溶液中加入铁粉、
硫氰化钾溶液的现象?
FeCl3+3KSCN Fe(SCN)3+3KCl
浅黄色 红色
1.上述实验中化学平衡状态是否改变?
2.能否推知影响化学平衡状态的影响因素?
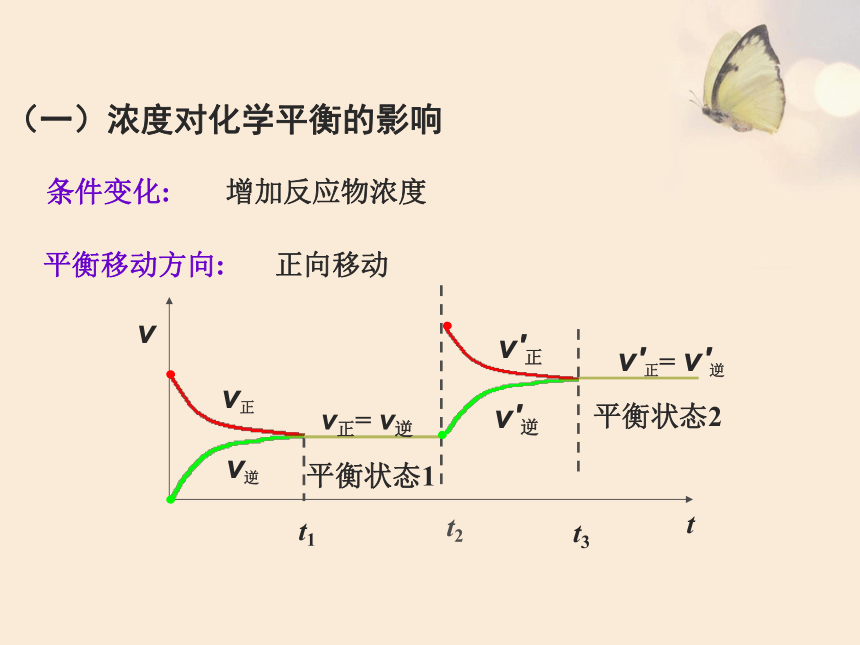
增加反应物浓度
条件变化:
平衡移动方向:
正向移动
v′正= v′逆
平衡状态2
t2
t3
t1
v
t
v正
v逆
v正= v逆
平衡状态1
v′正
v′逆
(一)浓度对化学平衡的影响
结 论:
在其他条件不变的情况下:
增大反应物浓度(或减小生成物浓度)化学平衡正向移动;
减小反应物浓度(或增大生成物浓度)化学平衡逆向移动。
讨论1:对于该反应达到平衡时,按以上方法分析以下情况,化学平衡将如何移动?
(1)减小反应物浓度。 (2)增大生成物浓度。
(3)减小生成物浓度。
注意:
1.增大反应物浓度(或减小生成物浓度),新旧平衡比较:
v ′正= v ′逆 > v正= v逆
减小反应物浓度(或增大生成物浓度),新旧平衡比较:
v′正= v′ 逆 < v正= v逆
2.固体、纯液体(水)浓度为常数,其量的增减不影响
v正、 v逆,故平衡不移动。
(不会)
思考: C(s)+H2O(g) CO (g)+H2 (g) (恒T、V)
增大C的用量,平衡会移动吗?
(1) 10 mL 0.01 mol· L-1FeCl3+ 10 mL 0.01 mol· L-1 KSCN
(2) 10 mL 0.01 mol· L-1FeCl3+
10 mL 0.01 mol· L-1 KSCN + 10 mL H2O
(3) 10 mL 0.01 mol· L-1FeCl3+ 10 mL 1 mol· L-1 KSCN
(4) 20 mL 0.01 mol· L-1FeCl3 + 20 mL 0.01 mol· L-1 KSCN
以上四组溶液颜色由深到浅的顺序为 。
(3) >(4)=(1)>(2)
讨论2:
讨论3:试用“浓度对化学平衡的影响”来解释“用
排饱和食盐水法 收集Cl2可以抑制Cl2的溶解”。
分析: Cl2溶解于水,存在溶解平衡。
溶解的部分Cl2能与水反应: Cl2 + H2O H+ + Cl- + HClO
讨论4:在密闭容器中,给 CO 和水蒸气混合物加热,
800 ℃ 时达到下列平衡:CO(g)+ H2O(g) CO2(g) + H2(g),若用 2 mol CO 和10 mol H2O互相混合加热,达平衡时,CO2 的物质的量为 1.66 mol,求 CO 的转化率是多少?若用 2 mol CO和 20 mol H2O 互相混合加热,达平衡时,H2的物质的量为1.818 mol,CO的转化率是多少?
83%
91%
结论:
增大
减小
对达化学平衡的反应体系 A + B C + D (恒T、V)
增加A物质的量:
A的转化率 B的转化率
应用:在生产上往往采用增大容易取得的或成本较低的
反应物浓度的方法,使成本较高的原料得到充分利用。
讨论5:在某容器中,C(s) + H2O(g) CO(g) + H2(g)
反应达到平衡,在温度、容器体积不变的情况下,向容器中充入一定量的H2,当建立新平衡时( )
A.CO、H2 的浓度都比原平衡时小
B.CO、H2 的浓度都比原平衡时大
C.H2O(g)、H2 的浓度都比原平衡时大
D. H2O(g)、CO 的浓度都比原平衡时大
C
总结: mA(g) + nB(g) pC(g) + qD(g)
恒T、V
↑ ↓ ↑ ↑
↓ ↑
↑ ↓ ↓ ↓
新旧平衡比较
cA 、 cB 、 cC 、 cD
A的转化率 B的转化率
A% 、B% 、C% 、 D %
cA ↑
平衡移动方向
瞬间速率变化
v′正 v正
>
若 ①cA ↓ ②cC↑ ③cC↓呢?
(二)压强对化学平衡的影响
点击图片播放
原因分析:
2NO2 (红棕色) N2O4(无色)
实验证明:T一定时,压强改变对气体体积大(即气体化学计量
数大)的一方反应速率影响尤为显著。
结 论: 在其他条件不变的情况下:
增大压强,使化学平衡向着气体体积缩小的方向移动。
减小压强,使化学平衡向着气体体积增大的方向移动。
t2
t3
v′正
v′逆
v′正= v′逆
v逆
t
t1
v
v正
v正= v逆
t2:增大压强
平衡状态1
平衡状态2
思考:对反应 H2+I2 2HI 在压强为 p1 时,
HI% 随时间变化如图所示。当压强增大为 p2 时,
图形将如何改变?
HI%
t
加压: v′正= v′逆 > v正= v 逆
减压: v′正= v′ 逆 < v正= v逆
mA(g) + nB(g) pC(g) + qD(g)
(1)m+n > p+q时
(2)m+n < p+q时
(3)m+n = p+q时
增大压强或减小压强时平衡如何移动?新旧平衡的速率大小比较。
注意:1. 对反应前后气态物质总体积无变化的可逆反应,压强改变对正、逆反应速率改变倍数相同,因此,平衡不发生移动。但是加压,达平衡快;减压,达平衡慢。
2.对只有固态或液态物参与的反应,压强改变对平衡无影响。
结论:在其他条件不变的情况下:
增大压强,使化学平衡向着气体体积缩小的方向移动
减小压强,使化学平衡向着气体体积增大的方向移动
总结: mA(g) + nB(g) pC(g) + qD(g)
若 m+n > p+q p↑ 平衡正向移动 新旧平衡比较:
A的转化率 B的转化率
A% 、B% 、C% 、D %
↑
↑
↓ ↓ ↑ ↑
讨论1:向盛有N2 、H2的反应器中充入氦气
(1)若为恒温、恒容,充入氦气后平衡如何移动?
(2)若为恒温、恒压,充入氦气后平衡如何移动?
不移动
逆向移动
增大
增大
N2 + 3H2 2NH3 (恒T、V)
起始 1 mol 3 mol 达平衡状态 1
改变1 增加 1 mol 达平衡状态 2
改变2 增加 1 mol 3 mol 达平衡状态 3
平衡状态 3 与平衡状态 1 比较:
H2的转化率 ,N2的转化率 。
讨论2:
结论:恒容条件下,在可逆反应中若气态反应物的浓度均按比例改变,视为加压或减压。
1 L
1 L
1 L
加入
1 mol N2
3 mol H2
再加入
1 mol N2
3 mol H2
虚拟状态
1 L
2 L
加压
达平衡状态1
达平衡状态 3
小结
化学平衡的移动
移动的含义、原因、方向
影响化学平衡状态的条件
浓度
压强
温度、催化剂
增大反应物浓度,化学平衡正向移动
减小反应物浓度,化学平衡逆向移动。
增大压强,使化学平衡向着气体体积缩小的方向移动;减小压强,使化学平衡向着气体体积增大的方向移动。
化学平衡
1.在一密闭恒容容器中充入 1 mol NO2,建立如下平衡:
,测得NO2的转化率为 a%。在该条件下,再充入 1 mol NO2,待新平衡建立时,又测得 NO2 的转化率为b%。 a、b的大小关系为_______________。
a%< b%
2.在体积可变的密闭容器中,反应
mA(气)+nB(固) pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是 ( )
A.(m+n)必定小于p B.(m+n)必定大于p
C. m必定小于p D. n必定大于p
C
本节内容结束
第3课时
浓度、压强对化学平衡移动的影响
复习
可逆反应中正、逆反应的速率变化
v
t
t1
达到平衡
v正= v逆≠0
v正
v逆
化学平衡
逆:
等:
动:
定:
变:
对象,即可逆反应
本质,即v正= v逆
现象,即反应混合物中各组成的浓度保持不变
特点,即平衡是动态的而非静止的,正、逆反应同时进行, v正= v逆≠0
发展,即条件改变时,可能v正≠ v逆,原平衡就要受
到破坏
化学平衡的移动
条件
改变
一定
时间后
化学平衡的移动
一定条件下的化学平衡
本质 v正= v逆
现象 各组分浓度保持一定
平衡被破坏
v正≠ v逆
各组分浓度保持
新的一定
新条件下的
化学平衡
v′正= v′逆
化学平衡的移动:可逆反应中旧化学平衡的破坏、新化学平衡的建立过程。
条件改变
化学平衡不移动
v正< v逆: 化学平衡逆向移动
v正> v逆: 化学平衡正向移动
v正= v逆:
v正≠ v逆:
【实验探究】 硫氰化钾与氯化铁混合溶液中加入铁粉、
硫氰化钾溶液的现象?
FeCl3+3KSCN Fe(SCN)3+3KCl
浅黄色 红色
1.上述实验中化学平衡状态是否改变?
2.能否推知影响化学平衡状态的影响因素?
增加反应物浓度
条件变化:
平衡移动方向:
正向移动
v′正= v′逆
平衡状态2
t2
t3
t1
v
t
v正
v逆
v正= v逆
平衡状态1
v′正
v′逆
(一)浓度对化学平衡的影响
结 论:
在其他条件不变的情况下:
增大反应物浓度(或减小生成物浓度)化学平衡正向移动;
减小反应物浓度(或增大生成物浓度)化学平衡逆向移动。
讨论1:对于该反应达到平衡时,按以上方法分析以下情况,化学平衡将如何移动?
(1)减小反应物浓度。 (2)增大生成物浓度。
(3)减小生成物浓度。
注意:
1.增大反应物浓度(或减小生成物浓度),新旧平衡比较:
v ′正= v ′逆 > v正= v逆
减小反应物浓度(或增大生成物浓度),新旧平衡比较:
v′正= v′ 逆 < v正= v逆
2.固体、纯液体(水)浓度为常数,其量的增减不影响
v正、 v逆,故平衡不移动。
(不会)
思考: C(s)+H2O(g) CO (g)+H2 (g) (恒T、V)
增大C的用量,平衡会移动吗?
(1) 10 mL 0.01 mol· L-1FeCl3+ 10 mL 0.01 mol· L-1 KSCN
(2) 10 mL 0.01 mol· L-1FeCl3+
10 mL 0.01 mol· L-1 KSCN + 10 mL H2O
(3) 10 mL 0.01 mol· L-1FeCl3+ 10 mL 1 mol· L-1 KSCN
(4) 20 mL 0.01 mol· L-1FeCl3 + 20 mL 0.01 mol· L-1 KSCN
以上四组溶液颜色由深到浅的顺序为 。
(3) >(4)=(1)>(2)
讨论2:
讨论3:试用“浓度对化学平衡的影响”来解释“用
排饱和食盐水法 收集Cl2可以抑制Cl2的溶解”。
分析: Cl2溶解于水,存在溶解平衡。
溶解的部分Cl2能与水反应: Cl2 + H2O H+ + Cl- + HClO
讨论4:在密闭容器中,给 CO 和水蒸气混合物加热,
800 ℃ 时达到下列平衡:CO(g)+ H2O(g) CO2(g) + H2(g),若用 2 mol CO 和10 mol H2O互相混合加热,达平衡时,CO2 的物质的量为 1.66 mol,求 CO 的转化率是多少?若用 2 mol CO和 20 mol H2O 互相混合加热,达平衡时,H2的物质的量为1.818 mol,CO的转化率是多少?
83%
91%
结论:
增大
减小
对达化学平衡的反应体系 A + B C + D (恒T、V)
增加A物质的量:
A的转化率 B的转化率
应用:在生产上往往采用增大容易取得的或成本较低的
反应物浓度的方法,使成本较高的原料得到充分利用。
讨论5:在某容器中,C(s) + H2O(g) CO(g) + H2(g)
反应达到平衡,在温度、容器体积不变的情况下,向容器中充入一定量的H2,当建立新平衡时( )
A.CO、H2 的浓度都比原平衡时小
B.CO、H2 的浓度都比原平衡时大
C.H2O(g)、H2 的浓度都比原平衡时大
D. H2O(g)、CO 的浓度都比原平衡时大
C
总结: mA(g) + nB(g) pC(g) + qD(g)
恒T、V
↑ ↓ ↑ ↑
↓ ↑
↑ ↓ ↓ ↓
新旧平衡比较
cA 、 cB 、 cC 、 cD
A的转化率 B的转化率
A% 、B% 、C% 、 D %
cA ↑
平衡移动方向
瞬间速率变化
v′正 v正
>
若 ①cA ↓ ②cC↑ ③cC↓呢?
(二)压强对化学平衡的影响
点击图片播放
原因分析:
2NO2 (红棕色) N2O4(无色)
实验证明:T一定时,压强改变对气体体积大(即气体化学计量
数大)的一方反应速率影响尤为显著。
结 论: 在其他条件不变的情况下:
增大压强,使化学平衡向着气体体积缩小的方向移动。
减小压强,使化学平衡向着气体体积增大的方向移动。
t2
t3
v′正
v′逆
v′正= v′逆
v逆
t
t1
v
v正
v正= v逆
t2:增大压强
平衡状态1
平衡状态2
思考:对反应 H2+I2 2HI 在压强为 p1 时,
HI% 随时间变化如图所示。当压强增大为 p2 时,
图形将如何改变?
HI%
t
加压: v′正= v′逆 > v正= v 逆
减压: v′正= v′ 逆 < v正= v逆
mA(g) + nB(g) pC(g) + qD(g)
(1)m+n > p+q时
(2)m+n < p+q时
(3)m+n = p+q时
增大压强或减小压强时平衡如何移动?新旧平衡的速率大小比较。
注意:1. 对反应前后气态物质总体积无变化的可逆反应,压强改变对正、逆反应速率改变倍数相同,因此,平衡不发生移动。但是加压,达平衡快;减压,达平衡慢。
2.对只有固态或液态物参与的反应,压强改变对平衡无影响。
结论:在其他条件不变的情况下:
增大压强,使化学平衡向着气体体积缩小的方向移动
减小压强,使化学平衡向着气体体积增大的方向移动
总结: mA(g) + nB(g) pC(g) + qD(g)
若 m+n > p+q p↑ 平衡正向移动 新旧平衡比较:
A的转化率 B的转化率
A% 、B% 、C% 、D %
↑
↑
↓ ↓ ↑ ↑
讨论1:向盛有N2 、H2的反应器中充入氦气
(1)若为恒温、恒容,充入氦气后平衡如何移动?
(2)若为恒温、恒压,充入氦气后平衡如何移动?
不移动
逆向移动
增大
增大
N2 + 3H2 2NH3 (恒T、V)
起始 1 mol 3 mol 达平衡状态 1
改变1 增加 1 mol 达平衡状态 2
改变2 增加 1 mol 3 mol 达平衡状态 3
平衡状态 3 与平衡状态 1 比较:
H2的转化率 ,N2的转化率 。
讨论2:
结论:恒容条件下,在可逆反应中若气态反应物的浓度均按比例改变,视为加压或减压。
1 L
1 L
1 L
加入
1 mol N2
3 mol H2
再加入
1 mol N2
3 mol H2
虚拟状态
1 L
2 L
加压
达平衡状态1
达平衡状态 3
小结
化学平衡的移动
移动的含义、原因、方向
影响化学平衡状态的条件
浓度
压强
温度、催化剂
增大反应物浓度,化学平衡正向移动
减小反应物浓度,化学平衡逆向移动。
增大压强,使化学平衡向着气体体积缩小的方向移动;减小压强,使化学平衡向着气体体积增大的方向移动。
化学平衡
1.在一密闭恒容容器中充入 1 mol NO2,建立如下平衡:
,测得NO2的转化率为 a%。在该条件下,再充入 1 mol NO2,待新平衡建立时,又测得 NO2 的转化率为b%。 a、b的大小关系为_______________。
a%< b%
2.在体积可变的密闭容器中,反应
mA(气)+nB(固) pC(气)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是 ( )
A.(m+n)必定小于p B.(m+n)必定大于p
C. m必定小于p D. n必定大于p
C
本节内容结束
