2.2.5 化学平衡图像 课件(共30张PPT)
文档属性
| 名称 | 2.2.5 化学平衡图像 课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 556.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 21:46:26 | ||
图片预览




文档简介
(共30张PPT)
第5课时 化学平衡图像
学习目标
1. 认识化学反应速率、化学平衡典型图像,学会化学平衡图像题的分析解答方法。
2. 知道等效平衡的含义,学会等效平衡的分析判断方法。
一. 化学平衡图像
(一)速率-时间图
1. 计算平衡浓度。
2. (已知反应)判断引起平衡移动的因素。
3. 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
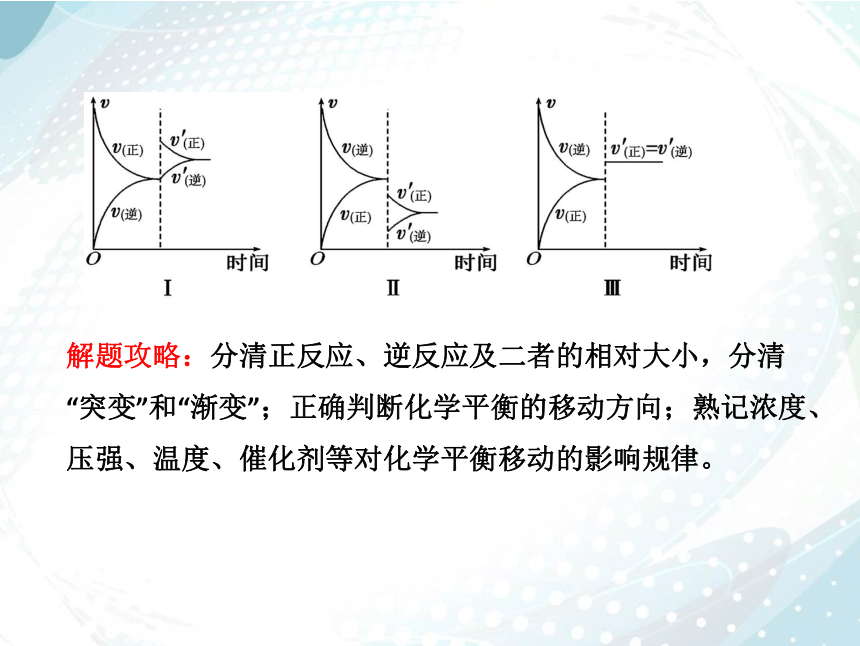
解题攻略:分清正反应、逆反应及二者的相对大小,分清“突变”和“渐变”;正确判断化学平衡的移动方向;熟记浓度、压强、温度、催化剂等对化学平衡移动的影响规律。
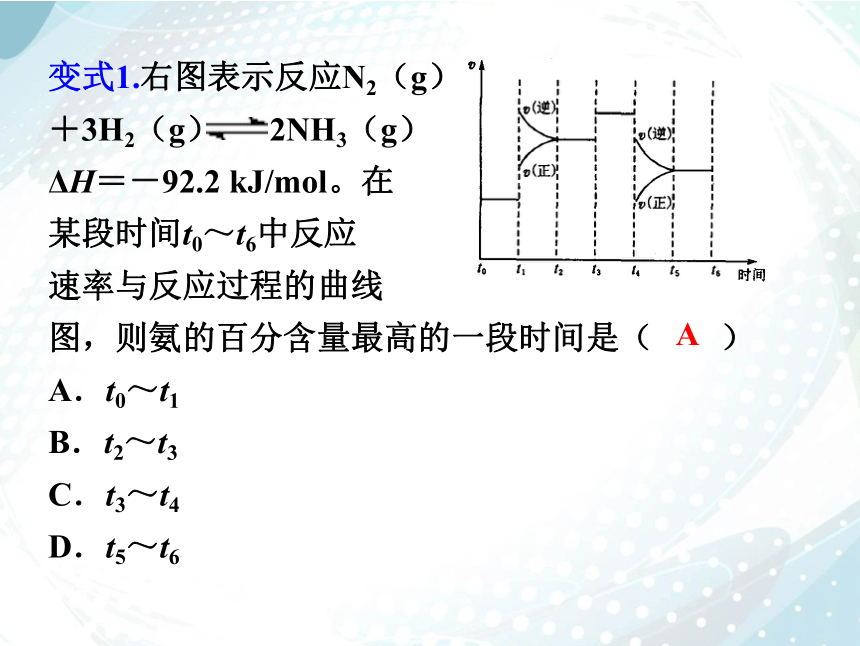
变式1.右图表示反应N2(g)
+3H2(g) 2NH3(g)
ΔH=-92.2 kJ/mol。在
某段时间t0~t6中反应
速率与反应过程的曲线
图,则氨的百分含量最高的一段时间是( )
A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6
A
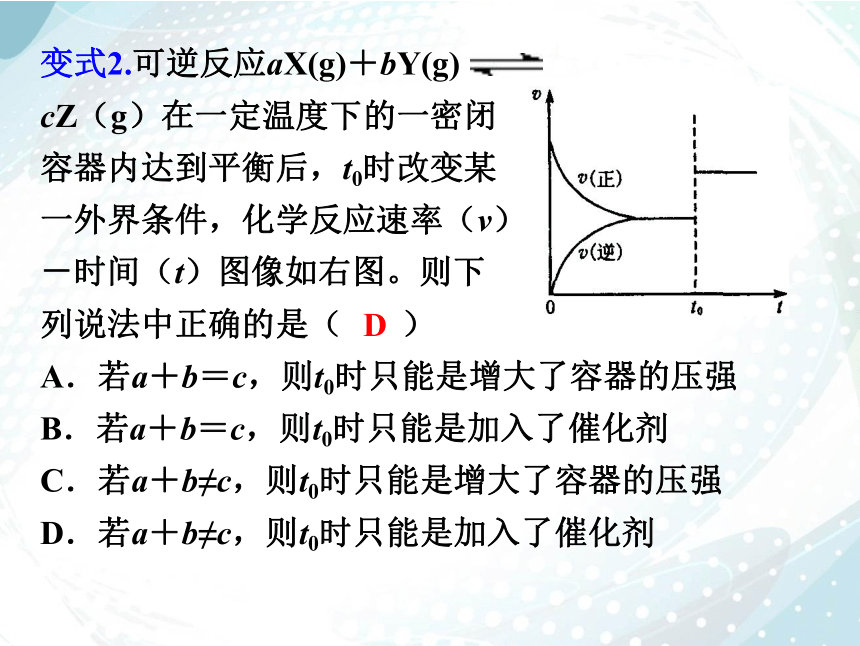
变式2.可逆反应aX(g)+bY(g)
cZ(g)在一定温度下的一密闭
容器内达到平衡后,t0时改变某
一外界条件,化学反应速率(v)
-时间(t)图像如右图。则下
列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
D
(二)速率-压强(温度)图
变式1. 符合下图的反应为( )
A.H2(g) +I2(g) 2HI(g)
B.3NO2(g)+H2O(l)
2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g)
4NO(g)+6H2O(g)
D.CO2(g)+C(s) 2CO(g)
B
T
v
v逆
v正
T1
T2
T
v
v正
v逆
吸
吸
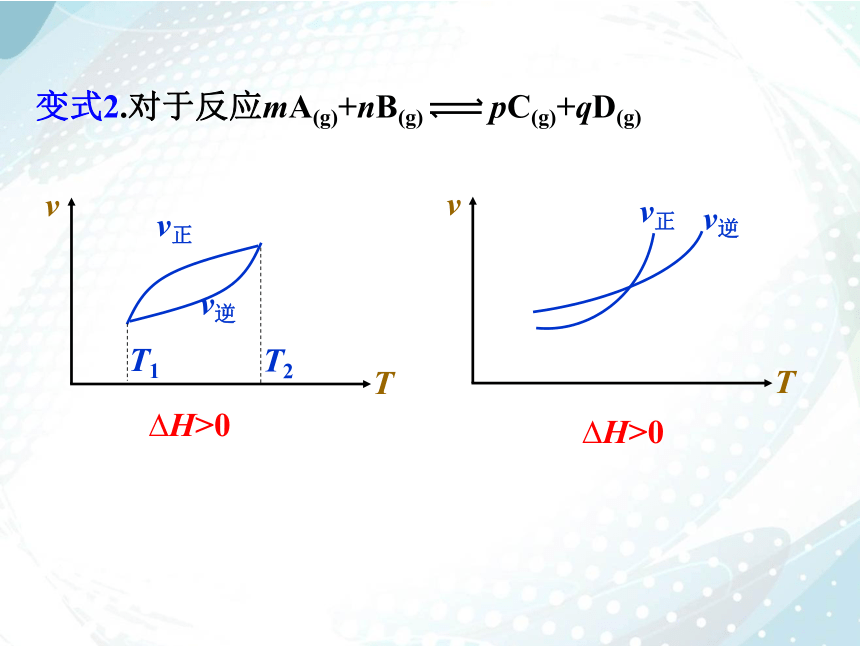
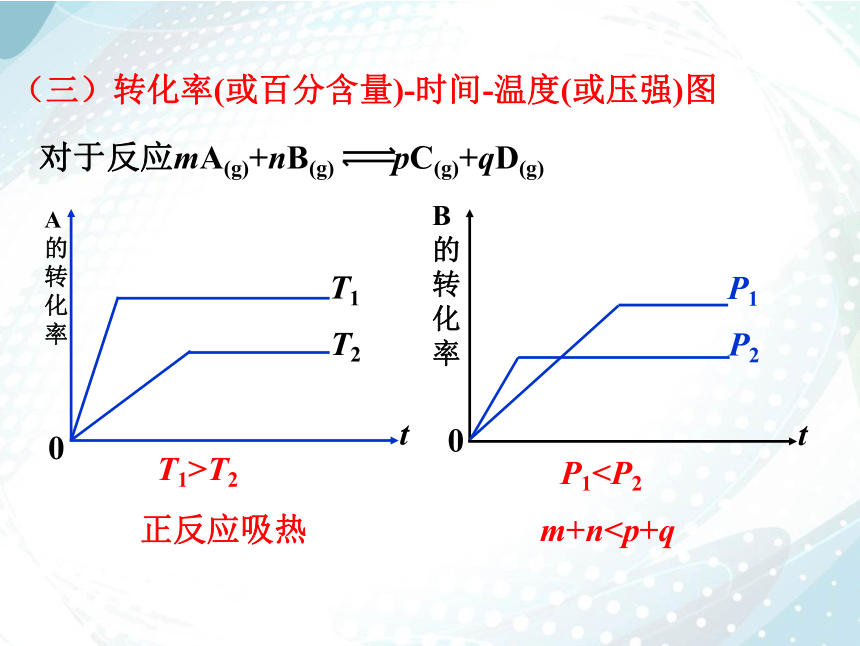
变式2.对于反应mA(g)+nB(g) pC(g)+qD(g)
H>0
H>0
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A的转化率
T1
T2
0
t
B的转化率
P1
P2
0
T1>T2
P1正反应吸热
m+n(三)转化率(或百分含量)-时间-温度(或压强)图
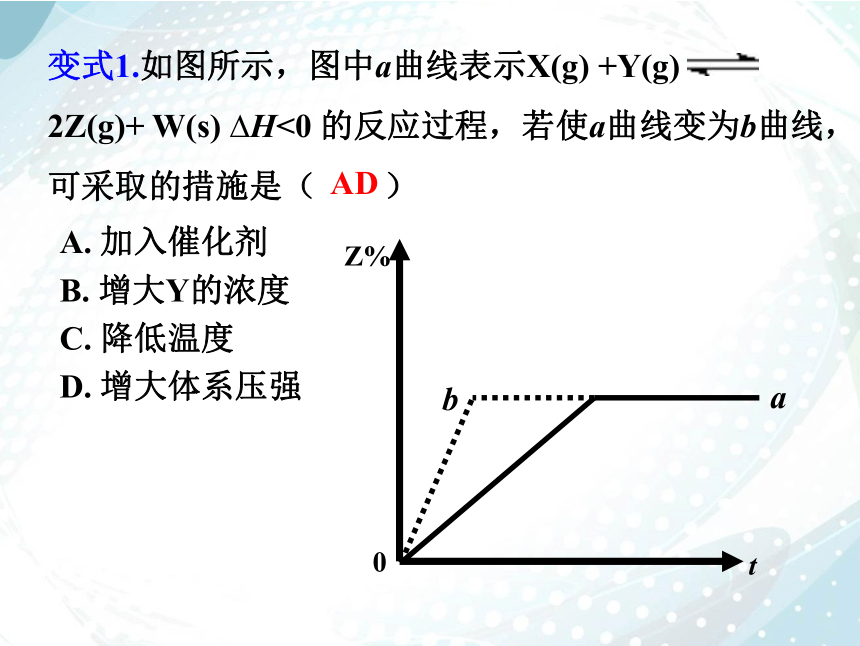
变式1.如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s) H<0 的反应过程,若使a曲线变为b曲线,可采取的措施是( )
0
Z%
t
a
b
A. 加入催化剂
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
AD
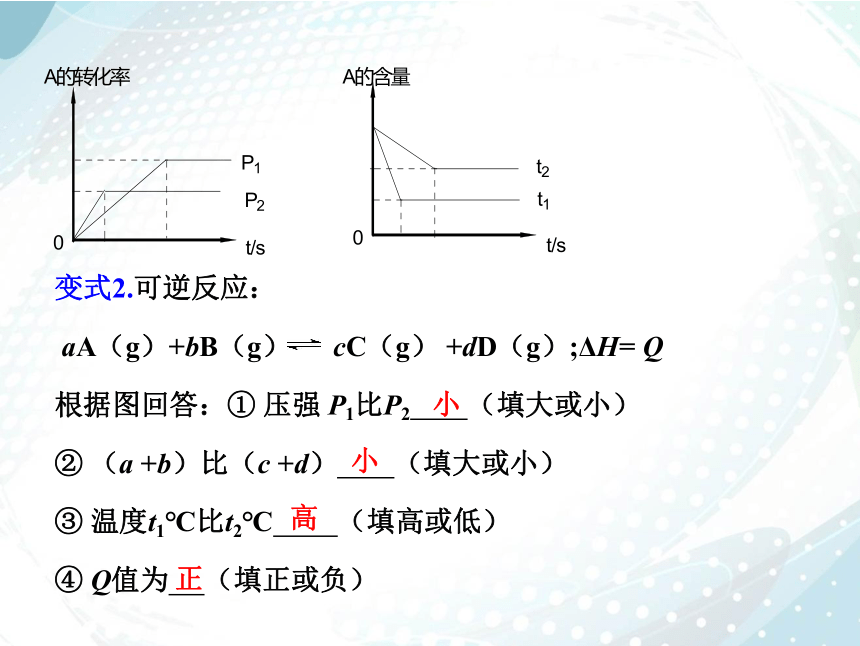
变式2.可逆反应:
aA(g)+bB(g) cC(g) +dD(g);ΔH= Q
根据图回答:① 压强 P1比P2 (填大或小)
② (a +b)比(c +d) (填大或小)
③ 温度t1℃比t2℃ (填高或低)
④ Q值为 (填正或负)
小
小
高
正
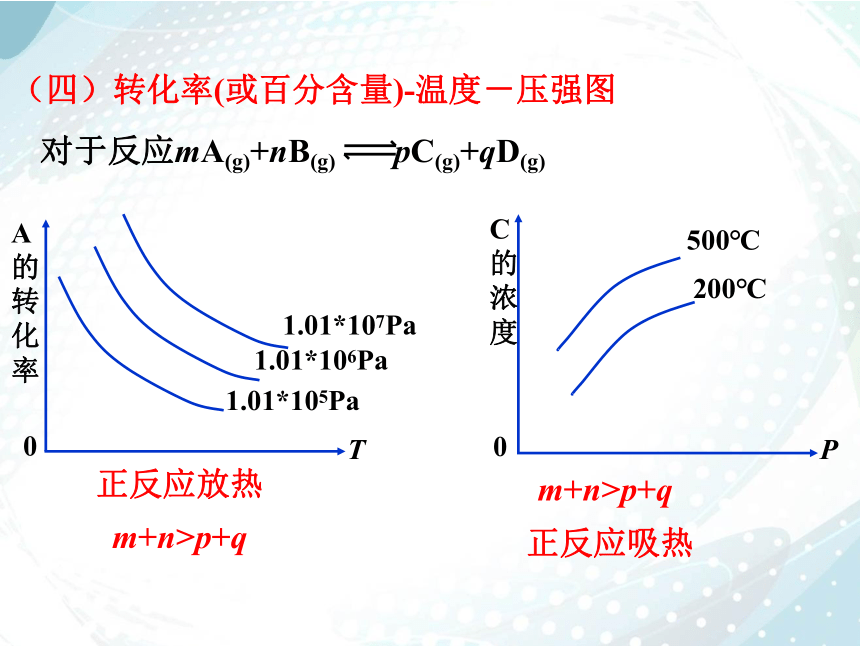
(四)转化率(或百分含量)-温度-压强图
T
A的转化率
1.01*107Pa
1.01*106Pa
1.01*105Pa
0
P
C的浓度
500℃
200℃
0
正反应放热
正反应吸热
m+n>p+q
m+n>p+q
对于反应mA(g)+nB(g) pC(g)+qD(g)
P
A%
300℃
200℃
0
正反应吸热
m+n=p+q
对于反应mA(g)+nB(g) pC(g)+qD(g)
变式1. 对于2A(g)+B(g) C(g)+3D(g) H>0
有如下图所示的变化,图中Y轴可能表示( ) A. B物质的转化率
B. 正反应的速率
C. 平衡体系中的A%
D. 平衡体系中的C%
P
Y
100℃
200℃
300℃
0
AD
0
变式2. 下图是在其它条件一定时,反应2NO+O2 2NO2 H <0 中NO的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且v正>v逆的点是 。
A
B
C
E
D
C点
T
NO转化率
(一)解化学反应速率与化学平衡图像题的步骤
1.看图像:一看面(横坐标和纵坐标各表示什么);
二看线(线的走向,变化趋势);
三看点(是否过原点、线的起点、交点、拐点及终点);
四看要不要作辅助线(如等压线、等温线、平衡线等)。
2.想规律:联想外界条件对化学反应速率和化学平衡的影响规律。
3.作判断:根据图像中体现的关系与所学规律对比,并作出正确的判断。
(二)解化学反应速率与化学平衡图像题的原则
1.“定一议二” :在化学平衡图像中,包括横坐标、纵坐标和曲线所表示的三个量,先确定横坐标(或纵坐标)所表示的量不变,再讨论纵坐标(或横坐标)与曲线的关系。
2.“先拐先平,数值大” :在化学平衡图像中,先出现拐点的曲线先达到平衡,即代表该曲线温度高或压强大。
二. 等效平衡
一定条件下,对同一可逆反应,只是起始时加入物质的物质的量不同,而达到化学平衡时,各组分的百分含量(或物质的量分数)均相同,这样的两个平衡状态互称为等效平衡。
等效平衡状态的建立与途径无关,与外界条件和物质用量有关。
(1)什么是等效平衡?
(2)等效平衡的解题思想有哪些?
极限转化法、虚拟过程法
N2 + 3H2 2NH3
1. 恒温恒容下的等效平衡(非等体积反应)
投料① 1 mol 2 mol
投料② 2 mol 4 mol
1 mol N2
2 mol H2
1 mol N2
2 mol H2
1 mol N2
2 mol H2
①
2 mol N2
4 mol H2
②
虚拟②
投料③ 1 mol 1 mol 2 mol
×
使用极限转化法后,与原始加入量相同即为等效平衡(全等平衡),此时②③为全等平衡。此时,两个平衡的各物质的百分含量相同,n、c也相同。
平衡② 0.8mol 0.4mol 2.4
极限转化法
假设常温下,该反应C(s) + H2O(g) CO(g) + H2(g)的K=0.5。V容=1 L
C(s) + H2O(g) CO(g) + H2(g)
投料① 1 mol
投料② 0.8 mol 0.2 mol 0.2 mol
投料③ 2 mol
平衡① 0.5 mol 0.5 mol 0.5 mol
平衡② 0.8-x mol 0.2+x mol 0.2+x mol
平衡③ 2-y mol y mol y mol
x=0.3; (H2O)=33% ;α(H2O)=50%;
y=0.78; (H2O)=44%; α(H2O)=39%;
H2 + I2 2HI
投料① 1 mol 2 mol
投料② 2 mol 4 mol
1 mol H2
2 mol I2
1 mol H2
2 mol I2
1 mol H2
2 mol I2
①
2 mol H2
4 mol I2
②
虚拟②
投料③ 0 mol 1 mol 2 mol
使用极限转化法后,与原始加入量的比值相同即为等效平衡,此时①②③为等效平衡(其中①③为全等平衡)。此时两个平衡的各物质的百分含量相同,n、c成比例改变。
等体积反应
压缩时平衡不移动
1. 恒温恒容下的等效平衡(等体积反应)
N2 + 3H2 2NH3
2. 恒温恒压下的等效平衡
投料① 1 mol 2 mol
投料② 2 mol 4 mol
1 mol N2
2 mol H2
1 mol N2
2 mol H2
1 mol N2
2 mol H2
①
②
2 mol N2
4 mol H2
虚拟②
投料③ 1 mol 1 mol 2 mol
使用极限转化法后,与原始加入量的比值相同即为等效平衡,此时①②③为等效平衡。此时两个平衡的各物质的百分含量相同,c相同,n成比例改变。
归纳:等效平衡
条件 等效条件 结果
恒温恒容 投料换算成相同物质表示时量相同 (极值等量) 两次平衡时各组分百分量、n、c均相同 (全等平衡)
恒温恒容 (等体积反应) 投料换算成相同物质表示时等比例 (极值等比) 两次平衡时各组分百分量相同,n、c同比例变化
恒温恒压 投料换算成相同物质表示时等比例 (极值等比) 两次平衡时各组分百分量、c相同,n同比例变化
例1.在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:2A(g) + B(g) 3C(g) + D(g) 达到平衡时,C的浓度为n mol/L,
(1)若维持恒温恒容,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为n mol/L的是: 。
A. 4 mol A+2 mol B B. 2 mol A+1 mol B+3 mol C+1 mol D
C. 4 mol C+1 mol D D. 3 mol C+1 mol D
E. 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
(2)C的浓度大于n mol/L的是: 。
(3)将D(g)改为D(s),则C的浓度仍为n mol/L的是: ______。
(4)若将题中“恒温恒容”改为“恒温恒压”,则C的浓度仍为n mol/L的是: 。
DE
ABC
DE
ABDE
例2. 在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应CH3OCH3(g)+H2O(g) 2CH3OH(g);ΔH=+37 kJ/mol,测得反应达到平衡时的数据如下下列说法正确的是( )
A. a+2c>37 B. α1+α2=1 C. V1=2V3 D. c1<2c3
容器 甲 乙 丙
反应物投入量 1 mol CH3OCH3、 1 mol H2O 2 mol CH3OH 1 mol CH3OH
CH3OH的浓度/mol/L c1 c2 c3
反应的能量变化 吸收a kJ 放出b kJ 放出c kJ
平衡时体积/L V1 V2 V3
反应物转化率 α1 α2 α3
BC
随堂练习
1. 对于反应:A2(g)+3B2(g)? 2AB3(g) ΔH<0下图中正确的是( )
A
2. 在某容积一定的密闭容器,可逆反应A(g)+B(g) xC(g) ΔH< 0,符合下列图像(I)所示关系,由此推断对图(II)的正确说法是( )
A. p3>p4,Y轴表示A的转化率
B. p3<p4,Y轴表示B的百分含量
C. p3>p4,Y轴表示混合气体的密度
D. p3>p4,Y轴表示混合气体的平均摩尔质量
AD
3. 一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和 2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是( )
A.2 mol C
B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol A、3 mol B和3 mol C
AB
B
4.已知2SO2 (g) + O2 (g) 2SO3 (g);ΔH = -197 kJ/mol。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强P:P甲=P丙 > 2P乙
B.SO3的质量m:m甲=m丙 > 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙
D.反应放出或吸收热量的数值Q:Q甲= Q丙 > 2Q乙
本节内容结束
第5课时 化学平衡图像
学习目标
1. 认识化学反应速率、化学平衡典型图像,学会化学平衡图像题的分析解答方法。
2. 知道等效平衡的含义,学会等效平衡的分析判断方法。
一. 化学平衡图像
(一)速率-时间图
1. 计算平衡浓度。
2. (已知反应)判断引起平衡移动的因素。
3. 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
解题攻略:分清正反应、逆反应及二者的相对大小,分清“突变”和“渐变”;正确判断化学平衡的移动方向;熟记浓度、压强、温度、催化剂等对化学平衡移动的影响规律。
变式1.右图表示反应N2(g)
+3H2(g) 2NH3(g)
ΔH=-92.2 kJ/mol。在
某段时间t0~t6中反应
速率与反应过程的曲线
图,则氨的百分含量最高的一段时间是( )
A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6
A
变式2.可逆反应aX(g)+bY(g)
cZ(g)在一定温度下的一密闭
容器内达到平衡后,t0时改变某
一外界条件,化学反应速率(v)
-时间(t)图像如右图。则下
列说法中正确的是( )
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
D
(二)速率-压强(温度)图
变式1. 符合下图的反应为( )
A.H2(g) +I2(g) 2HI(g)
B.3NO2(g)+H2O(l)
2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g)
4NO(g)+6H2O(g)
D.CO2(g)+C(s) 2CO(g)
B
T
v
v逆
v正
T1
T2
T
v
v正
v逆
吸
吸
变式2.对于反应mA(g)+nB(g) pC(g)+qD(g)
H>0
H>0
对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A的转化率
T1
T2
0
t
B的转化率
P1
P2
0
T1>T2
P1
m+n
变式1.如图所示,图中a曲线表示X(g) +Y(g) 2Z(g)+ W(s) H<0 的反应过程,若使a曲线变为b曲线,可采取的措施是( )
0
Z%
t
a
b
A. 加入催化剂
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
AD
变式2.可逆反应:
aA(g)+bB(g) cC(g) +dD(g);ΔH= Q
根据图回答:① 压强 P1比P2 (填大或小)
② (a +b)比(c +d) (填大或小)
③ 温度t1℃比t2℃ (填高或低)
④ Q值为 (填正或负)
小
小
高
正
(四)转化率(或百分含量)-温度-压强图
T
A的转化率
1.01*107Pa
1.01*106Pa
1.01*105Pa
0
P
C的浓度
500℃
200℃
0
正反应放热
正反应吸热
m+n>p+q
m+n>p+q
对于反应mA(g)+nB(g) pC(g)+qD(g)
P
A%
300℃
200℃
0
正反应吸热
m+n=p+q
对于反应mA(g)+nB(g) pC(g)+qD(g)
变式1. 对于2A(g)+B(g) C(g)+3D(g) H>0
有如下图所示的变化,图中Y轴可能表示( ) A. B物质的转化率
B. 正反应的速率
C. 平衡体系中的A%
D. 平衡体系中的C%
P
Y
100℃
200℃
300℃
0
AD
0
变式2. 下图是在其它条件一定时,反应2NO+O2 2NO2 H <0 中NO的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且v正>v逆的点是 。
A
B
C
E
D
C点
T
NO转化率
(一)解化学反应速率与化学平衡图像题的步骤
1.看图像:一看面(横坐标和纵坐标各表示什么);
二看线(线的走向,变化趋势);
三看点(是否过原点、线的起点、交点、拐点及终点);
四看要不要作辅助线(如等压线、等温线、平衡线等)。
2.想规律:联想外界条件对化学反应速率和化学平衡的影响规律。
3.作判断:根据图像中体现的关系与所学规律对比,并作出正确的判断。
(二)解化学反应速率与化学平衡图像题的原则
1.“定一议二” :在化学平衡图像中,包括横坐标、纵坐标和曲线所表示的三个量,先确定横坐标(或纵坐标)所表示的量不变,再讨论纵坐标(或横坐标)与曲线的关系。
2.“先拐先平,数值大” :在化学平衡图像中,先出现拐点的曲线先达到平衡,即代表该曲线温度高或压强大。
二. 等效平衡
一定条件下,对同一可逆反应,只是起始时加入物质的物质的量不同,而达到化学平衡时,各组分的百分含量(或物质的量分数)均相同,这样的两个平衡状态互称为等效平衡。
等效平衡状态的建立与途径无关,与外界条件和物质用量有关。
(1)什么是等效平衡?
(2)等效平衡的解题思想有哪些?
极限转化法、虚拟过程法
N2 + 3H2 2NH3
1. 恒温恒容下的等效平衡(非等体积反应)
投料① 1 mol 2 mol
投料② 2 mol 4 mol
1 mol N2
2 mol H2
1 mol N2
2 mol H2
1 mol N2
2 mol H2
①
2 mol N2
4 mol H2
②
虚拟②
投料③ 1 mol 1 mol 2 mol
×
使用极限转化法后,与原始加入量相同即为等效平衡(全等平衡),此时②③为全等平衡。此时,两个平衡的各物质的百分含量相同,n、c也相同。
平衡② 0.8mol 0.4mol 2.4
极限转化法
假设常温下,该反应C(s) + H2O(g) CO(g) + H2(g)的K=0.5。V容=1 L
C(s) + H2O(g) CO(g) + H2(g)
投料① 1 mol
投料② 0.8 mol 0.2 mol 0.2 mol
投料③ 2 mol
平衡① 0.5 mol 0.5 mol 0.5 mol
平衡② 0.8-x mol 0.2+x mol 0.2+x mol
平衡③ 2-y mol y mol y mol
x=0.3; (H2O)=33% ;α(H2O)=50%;
y=0.78; (H2O)=44%; α(H2O)=39%;
H2 + I2 2HI
投料① 1 mol 2 mol
投料② 2 mol 4 mol
1 mol H2
2 mol I2
1 mol H2
2 mol I2
1 mol H2
2 mol I2
①
2 mol H2
4 mol I2
②
虚拟②
投料③ 0 mol 1 mol 2 mol
使用极限转化法后,与原始加入量的比值相同即为等效平衡,此时①②③为等效平衡(其中①③为全等平衡)。此时两个平衡的各物质的百分含量相同,n、c成比例改变。
等体积反应
压缩时平衡不移动
1. 恒温恒容下的等效平衡(等体积反应)
N2 + 3H2 2NH3
2. 恒温恒压下的等效平衡
投料① 1 mol 2 mol
投料② 2 mol 4 mol
1 mol N2
2 mol H2
1 mol N2
2 mol H2
1 mol N2
2 mol H2
①
②
2 mol N2
4 mol H2
虚拟②
投料③ 1 mol 1 mol 2 mol
使用极限转化法后,与原始加入量的比值相同即为等效平衡,此时①②③为等效平衡。此时两个平衡的各物质的百分含量相同,c相同,n成比例改变。
归纳:等效平衡
条件 等效条件 结果
恒温恒容 投料换算成相同物质表示时量相同 (极值等量) 两次平衡时各组分百分量、n、c均相同 (全等平衡)
恒温恒容 (等体积反应) 投料换算成相同物质表示时等比例 (极值等比) 两次平衡时各组分百分量相同,n、c同比例变化
恒温恒压 投料换算成相同物质表示时等比例 (极值等比) 两次平衡时各组分百分量、c相同,n同比例变化
例1.在一个固定体积的密闭容器中,加入2 mol A和1 mol B,发生反应:2A(g) + B(g) 3C(g) + D(g) 达到平衡时,C的浓度为n mol/L,
(1)若维持恒温恒容,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为n mol/L的是: 。
A. 4 mol A+2 mol B B. 2 mol A+1 mol B+3 mol C+1 mol D
C. 4 mol C+1 mol D D. 3 mol C+1 mol D
E. 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
(2)C的浓度大于n mol/L的是: 。
(3)将D(g)改为D(s),则C的浓度仍为n mol/L的是: ______。
(4)若将题中“恒温恒容”改为“恒温恒压”,则C的浓度仍为n mol/L的是: 。
DE
ABC
DE
ABDE
例2. 在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应CH3OCH3(g)+H2O(g) 2CH3OH(g);ΔH=+37 kJ/mol,测得反应达到平衡时的数据如下下列说法正确的是( )
A. a+2c>37 B. α1+α2=1 C. V1=2V3 D. c1<2c3
容器 甲 乙 丙
反应物投入量 1 mol CH3OCH3、 1 mol H2O 2 mol CH3OH 1 mol CH3OH
CH3OH的浓度/mol/L c1 c2 c3
反应的能量变化 吸收a kJ 放出b kJ 放出c kJ
平衡时体积/L V1 V2 V3
反应物转化率 α1 α2 α3
BC
随堂练习
1. 对于反应:A2(g)+3B2(g)? 2AB3(g) ΔH<0下图中正确的是( )
A
2. 在某容积一定的密闭容器,可逆反应A(g)+B(g) xC(g) ΔH< 0,符合下列图像(I)所示关系,由此推断对图(II)的正确说法是( )
A. p3>p4,Y轴表示A的转化率
B. p3<p4,Y轴表示B的百分含量
C. p3>p4,Y轴表示混合气体的密度
D. p3>p4,Y轴表示混合气体的平均摩尔质量
AD
3. 一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A和 2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a %的是( )
A.2 mol C
B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol A、3 mol B和3 mol C
AB
B
4.已知2SO2 (g) + O2 (g) 2SO3 (g);ΔH = -197 kJ/mol。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强P:P甲=P丙 > 2P乙
B.SO3的质量m:m甲=m丙 > 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙
D.反应放出或吸收热量的数值Q:Q甲= Q丙 > 2Q乙
本节内容结束
