2.2.3杂化轨道理论简介 课件 (共39张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.3杂化轨道理论简介 课件 (共39张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 08:23:53 | ||
图片预览






文档简介
(共39张PPT)
1、结合实例了解杂化轨道理论的要点和类型(sp3、sp2、sp)。
2、能运用杂化轨道理认解释简单共价分子和离子的空间结构。
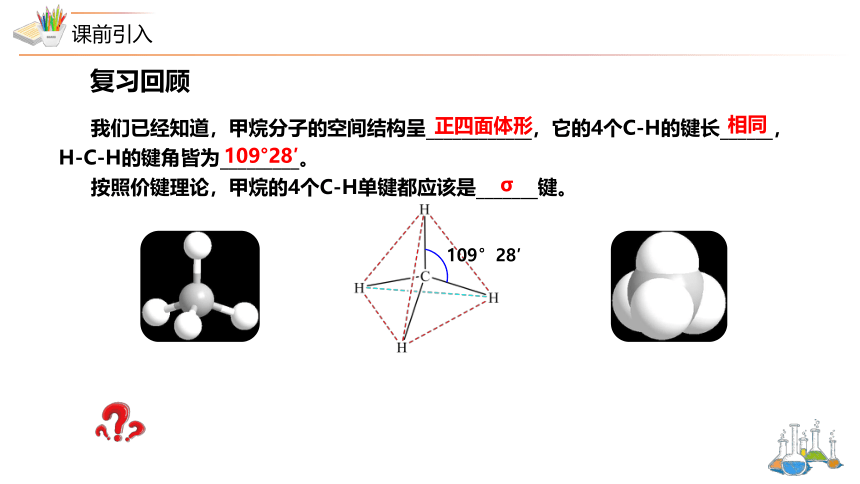
我们已经知道,甲烷分子的空间结构呈____________,它的4个C-H的键长______,H-C-H的键角皆为_________。
按照价键理论,甲烷的4个C-H单键都应该是_______键。
109°28′
正四面体形
相同
109°28′
σ
复习回顾
写出碳原子的核外电子排布式
【思考交流】
C
1s22s22p2
H
1s1
H
1s1
H
1s1
H
1s1
原子轨道重叠成键
CH4不可能得到正四面体形
思考碳原子与氢原子是如何结合形成CH4 ?
1s22s22p2
C
C原子的4个价层原子轨道是1个球形的2s轨道和3个相互垂直的2p轨道,用他们跟4个氢原子的1s轨道重叠,不可能得到正四面体形。
如何解决这一矛盾?
鲍林提出了杂化轨道理论
怎么重叠呢?
109°28′
四、杂化轨道理论简介 P47
鲍林为解释分子的立体构型提出杂化轨道理论
当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到四个新的能量相同,方向不同的轨道。
鲍林认为:
→sp3杂化轨道
杂化轨道理论:
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程 。
杂化轨道
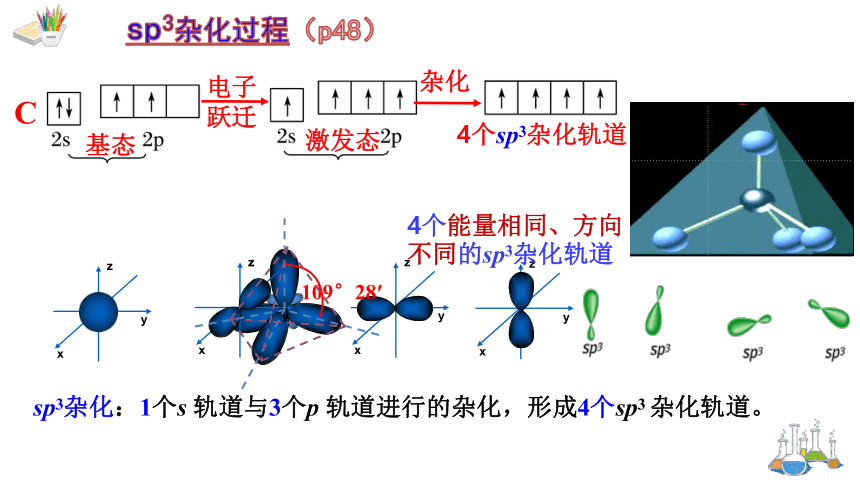
sp3杂化过程(p48)
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
基态
激发态
4个sp3杂化轨道
电子
跃迁
杂化
C
4个能量相同、方向不同的sp3杂化轨道
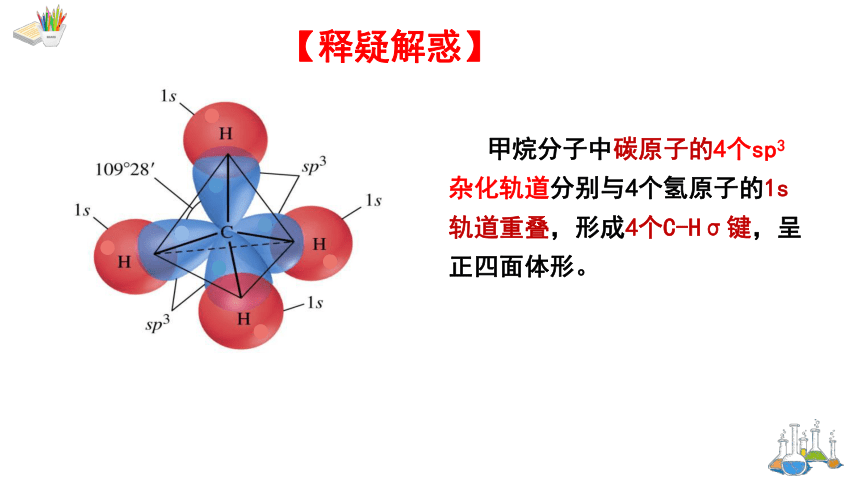
【释疑解惑】
甲烷分子中碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-Hσ键,呈正四面体形。
四、杂化轨道理论简介 P47
1. sp3杂化
① 由1个ns 轨道与3个np 轨道杂化形成
③轨道中心轴之间的夹角为109°28′,呈正四面体形
②每个sp3轨道含有4条相同的轨道,它们的能量相同、方向不同
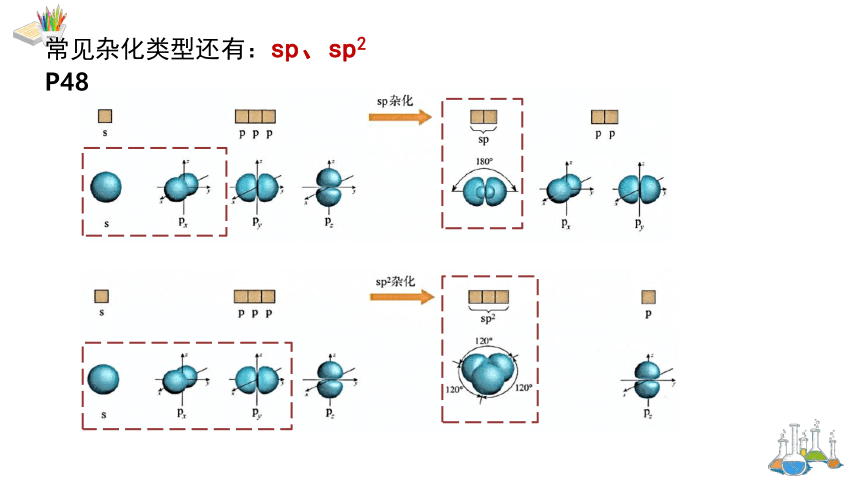
常见杂化类型还有:sp、sp2
P48
sp2杂化过程(p48)
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
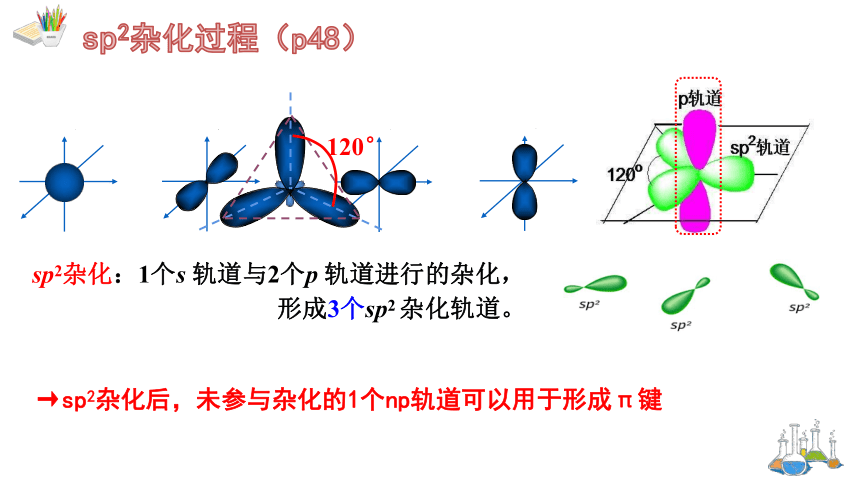
sp2杂化:1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
→sp2杂化后,未参与杂化的1个np轨道可以用于形成π键
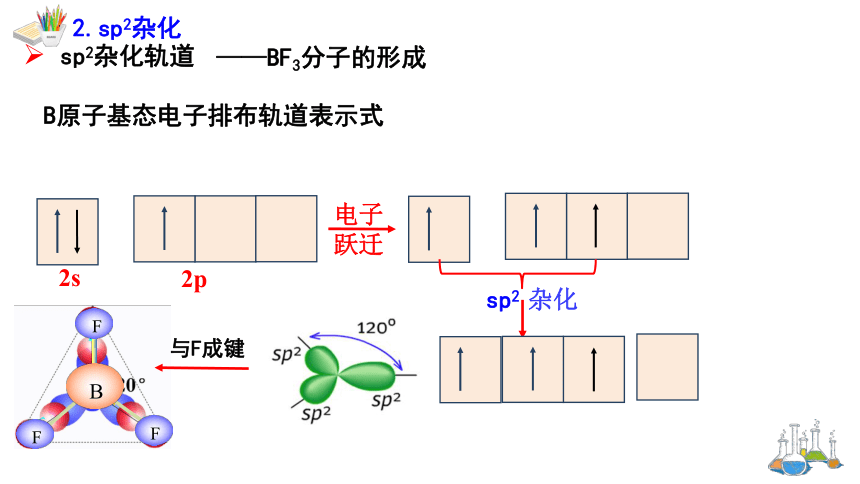
B原子基态电子排布轨道表示式
2s
2p
电子
跃迁
sp2 杂化
——BF3分子的形成
sp2杂化轨道
2.sp2杂化
与F成键
F
F
F
B
四、杂化轨道理论简介 P47
2. sp2杂化
① 由1个ns 轨道与2个np 轨道杂化形成
注意:sp2杂化后,未参与杂化的1个np轨道上若有未成对电子,则可以用于形成π键。
③轨道中心轴之间的夹角为120°,呈平面三角形。例如:BF3
②每个sp2轨道含有3条相同的轨道,它们的能量相同、方向不同
180°
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
四、杂化轨道理论简介 P47
3. sp杂化
sp杂化过程(p48)
sp 杂化:1个s轨道与1个p轨道进行的杂化, 形成2个sp杂化轨道。
180°
→sp杂化后,未参与杂化的两个np轨道可以用于形成π键
Be原子基态电子排布轨道表示式
2s
2p
电子跃迁
sp杂化
——BeCl2分子的形成
sp杂化轨道
3.sp杂化
与Cl成键
Cl
Cl
sp
px
px
180°
Cl
Cl
Be
σ键
σ键
四、杂化轨道理论简介 P47
3. sp杂化
① 由1个ns 轨道与1个np 轨道杂化形成
注意: sp杂化后,未参与杂化的2个np轨道上若有未成对电子,
则可以用于形成π键。
③轨道中心轴之间的夹角为180°,呈直线形。例如:BeCl2、CH≡CH
②每个sp轨道含有2条相同的轨道,它们的能量相同、方向相反
180°
杂化类型
sp3
sp2
参与杂化轨道
1个s,3个p
1个s,2个p
杂化轨道数
4个sp3
3个sp2
杂化轨道间夹角
109°28′
120°
空间结构
正四面体
平面三角形
实 例
CH4、CCl4
BF3
小结 杂化轨道类型
sp
1个s,1个p
2个sp
180°
直线形
BeCl2
杂化轨道
①杂化轨道数等于参与杂化的原子轨道数
②杂化改变了原子轨道的形状和方向
③杂化使原子的成键能力增强
④杂化轨道只用于形成分子的σ键或容纳孤电子对
杂化轨道有哪些特点?
四、杂化轨道理论简介
(即轨道数目不变)
剩余未杂化的p轨道可以形成π键!!!
杂化轨道理论要点
→中心原子 外界条件 能量相近的轨道(如2s、2p)
→杂化只发生在多原子分子(原子数>2)的过程中,
单独原子无法发生杂化(双原子分子也没有杂化过程)
→杂化前后的变与不变
不变:原子轨道的数目
变:轨道的成分、能量(趋向平均化)、形状、方向
→轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布
→杂化轨道用来形成σ键或用来容纳未参与成键的孤电子对
剩余未杂化的p轨道可以形成π键!!!
思考:任意不同的原子轨道都可以杂化吗?
①中心原子原子轨道只有在形成化学键时才能杂化.
③只有能量相近的轨道才能杂化(如2s、2p)。
不是
杂化的条件:
②杂化只发生在多原子分子(原子数>2)的过程中,
单独原子无法发生杂化(双原子分子也没有杂化过程)
√
√
×
×
大本39页
B
思考:观察并总结如何判断中心原子的杂化轨道类型?
价层电子对数
4
3
2
杂化轨道数=价层电子对数
四、杂化轨道理论简介
4.杂化轨道类型与VSEPR模型的关系。
杂化轨道数=价层电子对数
=中心原子σ键电子对数+孤电子对数
价层电子对数 中心原子的 杂化轨道类型 VSEPR 理想模型 理想键角
2
3
4
sp
直线形
180°
sp2
平面正三角形
120°
sp3
正四面体形
109°28′
C原子杂化轨道数目确定。
①4个σ键是sp3杂化。
②3个σ键是sp2杂化。
③2个σ键是sp杂化。
VSEPR模型 —— 预测分子的空间结构
杂化轨道理论 —— 解释分子的空间结构
【归纳小结】
VSEPR模型
预测空间结构
计算价层电子对数
=σ键电子对数+孤电子对数
确定中心原子的杂化轨道类型
→杂化理论和VSEPR模型预测粒子空间结构结果基本一致
思考:杂化方式一样,为什么键角不一样?
→双键(多含一对π电子对)排斥力略大于单键
→孤电子对数越多,键角越小。
键角:107° 105°
甲醛(HCHO)
116.4°
121.8°
乙烯
CH2=CH2
平面三角形
平面形
要点
类型
判断
方法
杂化轨道理论
轨道数不变
能量相近
成键力增强
排斥力最小
sp、sp2、sp3
VSEPR模型
杂化轨道数目
C原子杂化类型
D
大本41页:1、2、3、5
D
B
多原子分子或离子的中心原子的杂化轨道类型的判断方法,并完成下表中的空白。
思考与讨论
粒子 中心原子的价层电子对数 VSEPR模型名称 中心原子的杂化轨道类型 分子或离子的空间结构名称
CO2
CH2O
SO2
BF3
CH4
NH3
H2O
H3O+
NH4+
2
直线形
直线形
sp
3
平面三角形
平面三角形
3
sp2
平面三角形
sp2
平面三角形
3
平面三角形
sp2
平面三角形
4
正四面体形
sp3
正四面体形
4
四面体形
sp3
三角锥形
4
4
4
四面体形
四面体形
正四面体形
sp3
sp3
sp3
V形
三角锥形
正四面体形
在学习价层电子对互斥模型时,知道NH3和H2O的VSEPR模型跟CH4一样也是四面体形,因此它们的中心原子也是采取了sp3杂化。
109°28′
107°
105°
NH3
H2O
CH4
讨论:如何用杂化轨道理论解释氨分子和水分子的空间结构呢?
注:杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。
氮原子的3个sp3杂化轨道与3个氢原子的1s原子轨道重叠形成3个N-Hσ键,其中1个sp3杂化轨道中占有孤电子对。
思考与讨论1:
2s
2p
sp3不等性杂化
sp3
→孤电子对对成键电子对的排斥能力较强,故键角小于109°28′,为107°
NH3 空间结构:三角锥形
键角:107o
7N 1s22s22p3
107°
O原子的2个sp3杂化轨道与2个氢原子的1s原子轨道重叠形成2个O-Hσ键,其中有2个sp3杂化轨道中占有孤电子对。
思考与讨论2:
H2O 空间结构:V形
键角为:105o
8O 1s22s22p4
2s
2p
sp3不等性杂化
sp3
105°
109°28′
1、结合实例了解杂化轨道理论的要点和类型(sp3、sp2、sp)。
2、能运用杂化轨道理认解释简单共价分子和离子的空间结构。
我们已经知道,甲烷分子的空间结构呈____________,它的4个C-H的键长______,H-C-H的键角皆为_________。
按照价键理论,甲烷的4个C-H单键都应该是_______键。
109°28′
正四面体形
相同
109°28′
σ
复习回顾
写出碳原子的核外电子排布式
【思考交流】
C
1s22s22p2
H
1s1
H
1s1
H
1s1
H
1s1
原子轨道重叠成键
CH4不可能得到正四面体形
思考碳原子与氢原子是如何结合形成CH4 ?
1s22s22p2
C
C原子的4个价层原子轨道是1个球形的2s轨道和3个相互垂直的2p轨道,用他们跟4个氢原子的1s轨道重叠,不可能得到正四面体形。
如何解决这一矛盾?
鲍林提出了杂化轨道理论
怎么重叠呢?
109°28′
四、杂化轨道理论简介 P47
鲍林为解释分子的立体构型提出杂化轨道理论
当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到四个新的能量相同,方向不同的轨道。
鲍林认为:
→sp3杂化轨道
杂化轨道理论:
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程 。
杂化轨道
sp3杂化过程(p48)
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
基态
激发态
4个sp3杂化轨道
电子
跃迁
杂化
C
4个能量相同、方向不同的sp3杂化轨道
【释疑解惑】
甲烷分子中碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-Hσ键,呈正四面体形。
四、杂化轨道理论简介 P47
1. sp3杂化
① 由1个ns 轨道与3个np 轨道杂化形成
③轨道中心轴之间的夹角为109°28′,呈正四面体形
②每个sp3轨道含有4条相同的轨道,它们的能量相同、方向不同
常见杂化类型还有:sp、sp2
P48
sp2杂化过程(p48)
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
sp2杂化:1个s 轨道与2个p 轨道进行的杂化,形成3个sp2 杂化轨道。
→sp2杂化后,未参与杂化的1个np轨道可以用于形成π键
B原子基态电子排布轨道表示式
2s
2p
电子
跃迁
sp2 杂化
——BF3分子的形成
sp2杂化轨道
2.sp2杂化
与F成键
F
F
F
B
四、杂化轨道理论简介 P47
2. sp2杂化
① 由1个ns 轨道与2个np 轨道杂化形成
注意:sp2杂化后,未参与杂化的1个np轨道上若有未成对电子,则可以用于形成π键。
③轨道中心轴之间的夹角为120°,呈平面三角形。例如:BF3
②每个sp2轨道含有3条相同的轨道,它们的能量相同、方向不同
180°
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
四、杂化轨道理论简介 P47
3. sp杂化
sp杂化过程(p48)
sp 杂化:1个s轨道与1个p轨道进行的杂化, 形成2个sp杂化轨道。
180°
→sp杂化后,未参与杂化的两个np轨道可以用于形成π键
Be原子基态电子排布轨道表示式
2s
2p
电子跃迁
sp杂化
——BeCl2分子的形成
sp杂化轨道
3.sp杂化
与Cl成键
Cl
Cl
sp
px
px
180°
Cl
Cl
Be
σ键
σ键
四、杂化轨道理论简介 P47
3. sp杂化
① 由1个ns 轨道与1个np 轨道杂化形成
注意: sp杂化后,未参与杂化的2个np轨道上若有未成对电子,
则可以用于形成π键。
③轨道中心轴之间的夹角为180°,呈直线形。例如:BeCl2、CH≡CH
②每个sp轨道含有2条相同的轨道,它们的能量相同、方向相反
180°
杂化类型
sp3
sp2
参与杂化轨道
1个s,3个p
1个s,2个p
杂化轨道数
4个sp3
3个sp2
杂化轨道间夹角
109°28′
120°
空间结构
正四面体
平面三角形
实 例
CH4、CCl4
BF3
小结 杂化轨道类型
sp
1个s,1个p
2个sp
180°
直线形
BeCl2
杂化轨道
①杂化轨道数等于参与杂化的原子轨道数
②杂化改变了原子轨道的形状和方向
③杂化使原子的成键能力增强
④杂化轨道只用于形成分子的σ键或容纳孤电子对
杂化轨道有哪些特点?
四、杂化轨道理论简介
(即轨道数目不变)
剩余未杂化的p轨道可以形成π键!!!
杂化轨道理论要点
→中心原子 外界条件 能量相近的轨道(如2s、2p)
→杂化只发生在多原子分子(原子数>2)的过程中,
单独原子无法发生杂化(双原子分子也没有杂化过程)
→杂化前后的变与不变
不变:原子轨道的数目
变:轨道的成分、能量(趋向平均化)、形状、方向
→轨道成键时要满足化学键间最小排斥原理,使轨道在空间取得最大夹角分布
→杂化轨道用来形成σ键或用来容纳未参与成键的孤电子对
剩余未杂化的p轨道可以形成π键!!!
思考:任意不同的原子轨道都可以杂化吗?
①中心原子原子轨道只有在形成化学键时才能杂化.
③只有能量相近的轨道才能杂化(如2s、2p)。
不是
杂化的条件:
②杂化只发生在多原子分子(原子数>2)的过程中,
单独原子无法发生杂化(双原子分子也没有杂化过程)
√
√
×
×
大本39页
B
思考:观察并总结如何判断中心原子的杂化轨道类型?
价层电子对数
4
3
2
杂化轨道数=价层电子对数
四、杂化轨道理论简介
4.杂化轨道类型与VSEPR模型的关系。
杂化轨道数=价层电子对数
=中心原子σ键电子对数+孤电子对数
价层电子对数 中心原子的 杂化轨道类型 VSEPR 理想模型 理想键角
2
3
4
sp
直线形
180°
sp2
平面正三角形
120°
sp3
正四面体形
109°28′
C原子杂化轨道数目确定。
①4个σ键是sp3杂化。
②3个σ键是sp2杂化。
③2个σ键是sp杂化。
VSEPR模型 —— 预测分子的空间结构
杂化轨道理论 —— 解释分子的空间结构
【归纳小结】
VSEPR模型
预测空间结构
计算价层电子对数
=σ键电子对数+孤电子对数
确定中心原子的杂化轨道类型
→杂化理论和VSEPR模型预测粒子空间结构结果基本一致
思考:杂化方式一样,为什么键角不一样?
→双键(多含一对π电子对)排斥力略大于单键
→孤电子对数越多,键角越小。
键角:107° 105°
甲醛(HCHO)
116.4°
121.8°
乙烯
CH2=CH2
平面三角形
平面形
要点
类型
判断
方法
杂化轨道理论
轨道数不变
能量相近
成键力增强
排斥力最小
sp、sp2、sp3
VSEPR模型
杂化轨道数目
C原子杂化类型
D
大本41页:1、2、3、5
D
B
多原子分子或离子的中心原子的杂化轨道类型的判断方法,并完成下表中的空白。
思考与讨论
粒子 中心原子的价层电子对数 VSEPR模型名称 中心原子的杂化轨道类型 分子或离子的空间结构名称
CO2
CH2O
SO2
BF3
CH4
NH3
H2O
H3O+
NH4+
2
直线形
直线形
sp
3
平面三角形
平面三角形
3
sp2
平面三角形
sp2
平面三角形
3
平面三角形
sp2
平面三角形
4
正四面体形
sp3
正四面体形
4
四面体形
sp3
三角锥形
4
4
4
四面体形
四面体形
正四面体形
sp3
sp3
sp3
V形
三角锥形
正四面体形
在学习价层电子对互斥模型时,知道NH3和H2O的VSEPR模型跟CH4一样也是四面体形,因此它们的中心原子也是采取了sp3杂化。
109°28′
107°
105°
NH3
H2O
CH4
讨论:如何用杂化轨道理论解释氨分子和水分子的空间结构呢?
注:杂化轨道只用于形成σ键或用来容纳未参与成键的孤电子对。
氮原子的3个sp3杂化轨道与3个氢原子的1s原子轨道重叠形成3个N-Hσ键,其中1个sp3杂化轨道中占有孤电子对。
思考与讨论1:
2s
2p
sp3不等性杂化
sp3
→孤电子对对成键电子对的排斥能力较强,故键角小于109°28′,为107°
NH3 空间结构:三角锥形
键角:107o
7N 1s22s22p3
107°
O原子的2个sp3杂化轨道与2个氢原子的1s原子轨道重叠形成2个O-Hσ键,其中有2个sp3杂化轨道中占有孤电子对。
思考与讨论2:
H2O 空间结构:V形
键角为:105o
8O 1s22s22p4
2s
2p
sp3不等性杂化
sp3
105°
109°28′
