3.3.2 影响盐类水解的主要因素及盐类水解的应用 课件(共31张PPT)
文档属性
| 名称 | 3.3.2 影响盐类水解的主要因素及盐类水解的应用 课件(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 884.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 22:48:47 | ||
图片预览










文档简介
(共31张PPT)
第 三 节 盐类的水解
第 1 课时 影响盐类水解的因素和盐类水解的应用
第 2 课时 影响盐类水解的主要因素及盐类水解的应用
复习回顾
盐类的水解 :
在溶液中盐电离出来的离子跟水所电离出来的H+
或OH-结合生成弱电解质的反应,叫做盐类的水解。
水解的实质:
水解反应与中和反应的关系:
酸+碱 盐+水
中和
水解
破坏了水的电离平衡(促进水的电离)
水解的酸碱性规律:
有弱才水解,无弱不水解;
谁强显谁性,同强显中性。
一.影响盐类水解的因素
1.内因:反应物本身的性质-----主要因素:
如HA越弱, 则A-和H+更 结合, 即水解的程度更_____。
容易
大
越弱越水解
MgCl2 (aq) AlCl3 (aq)
对应的碱
酸 性
Mg(OH)2 Al(OH)3
<
>
① 不同弱酸对应的盐
NaClO (aq) CH3COONa (aq)
对应的酸
HClO CH3COOH
<
>
碱 性
② 不同弱碱对应的盐
③ 同一弱酸对应的盐
Na2CO3 (aq) NaHCO3 (aq)
对应的酸
HCO3– H2CO3
<
>
碱 性
∴ 正盐的水解程度 酸式盐的水解程度
>
Na3PO4 Na2HPO4 NaH2PO4
Na2SO3 Na2SO4 NaHSO3 NaHSO4
练习∶比较同浓度下列物质的pH值
> > >
> >
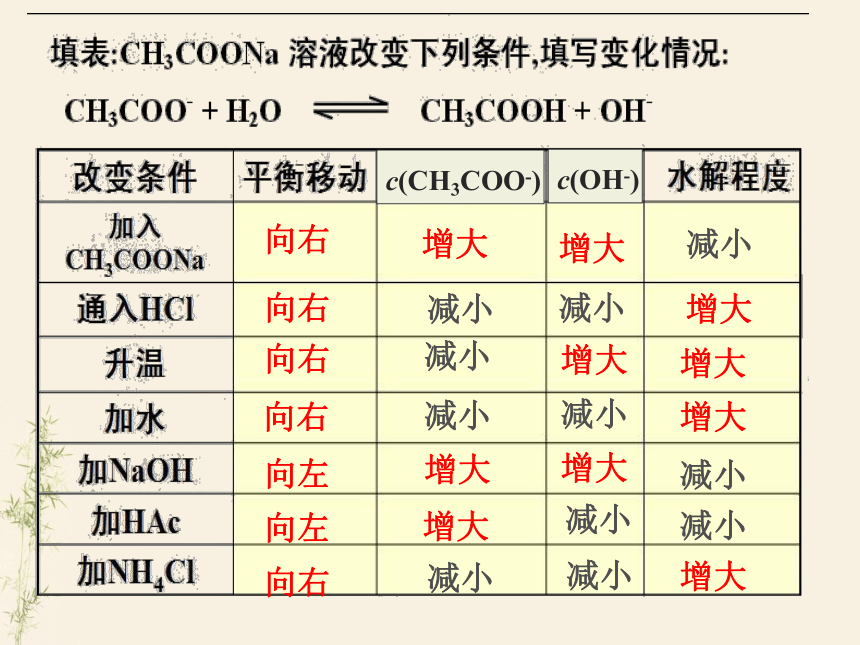
2.外因:符合勒夏特列原理:
(1)温度:盐的水解反应是吸热反应,升高温度水解程度增大。(越热越水解)
(2)浓度:加水稀释盐的溶液,水解程度增大。
(越稀越水解)
(3)加入酸或碱:可促进或抑制盐的水解。
配制FeCl3溶液需要注意什么问题?
向右
增大
增大
减小
向右
减小
减小
增大
向右
减小
增大
增大
向右
减小
减小
增大
向左
增大
增大
减小
向左
增大
减小
减小
向右
减小
减小
增大
c(CH3COO-)
c(OH-)
3.两种离子的双水解
例:Al 3+ + 3HCO3– Al(OH)3 + 3CO2
(1)不完全双水解:两离子水解相互促进,但仍部分水解,可逆的,阴阳离子仍能在溶液中大量共存,
如NH4+与S2-、HCO3- 、CO32-、CH3COO–
(2)完全双水解:水解进行完全,用“ === ”、“↑”、“↓”。阴、阳离子不能在溶液中大量共存:
①Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、ClO、
SiO32-
② Fe3+ 与 AlO2-、CO32-、HCO3-
③ NH4+ 与 SiO32-、AlO2-
说明:(Fe3+ 与 S2- 、HS-)主要发生氧化还原反应
不能大量共存的阴、阳离子:
2Al3+ + 3S2- + 6H2O === 2Al(OH)3↓+3H2S↑
2Al3+ + 3CO32- + 3H2O === 2Al(OH)3↓+3CO2↑
Al3+ + 3AlO2- + 6H2O ===4Al(OH)3↓
Al3+ + 3HCO3- === Al(OH)3↓+3CO2 ↑
练习:双水解的离子方程式的书写:
(1) Al3+ 与 CO32- (2) Al3+ 与 HCO3-
(3) Al3+ 与 S2- (4)Al3+ 与 AlO2-
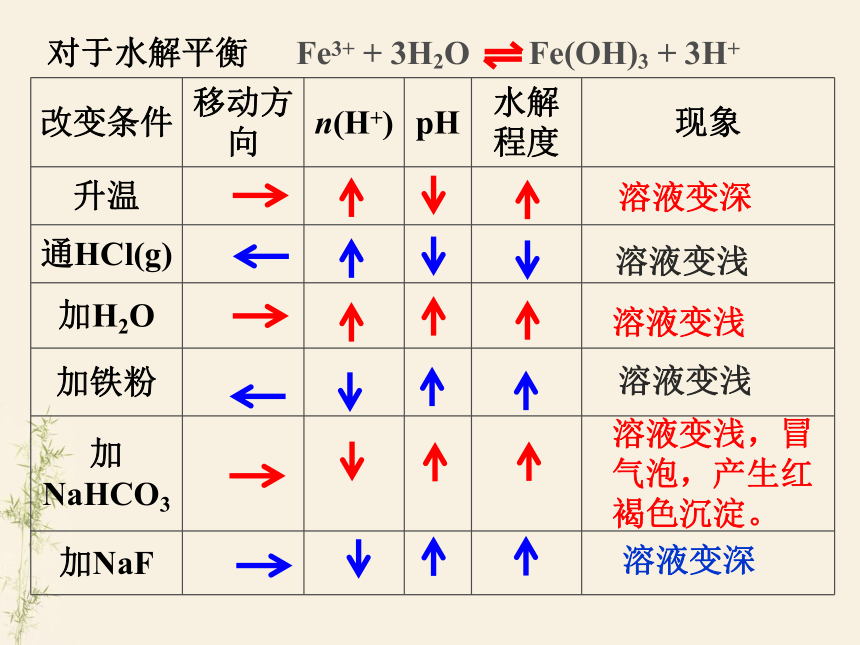
对于水解平衡
Fe3+ + 3H2O Fe(OH)3 + 3H+
改变条件 移动方向 n(H+) pH 水解程度 现象
升温
通HCl(g)
加H2O
加铁粉
加NaHCO3
加NaF
溶液变深
溶液变浅
溶液变浅
溶液变浅
溶液变浅,冒气泡,产生红褐色沉淀。
溶液变深
二.盐类水解的应用:
例:相同条件,相同物质的量浓度的下列八种溶液:
Na2CO3、NaHCO3、NaClO、CH3COONa、Na2SO4、NaOH 、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为
pH: NaOH>Na2CO3>NaClO>NaHCO3
>CH3COONa> Na2SO4 >(NH4)2SO4>NaHSO4
1.判断盐溶液的酸碱性
酸性:HCO3-<HClO<H2CO3<CH3COOH
2.比较盐溶液中离子种类的多少
例:将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子种类最多的是( )
A. KCl B. Na3PO4 C. Na2CO3 D. MgSO4
B
3.判定离子能否大量共存:
Al3+ 与 AlO2–
Al3+ 与 HCO3–
Al3+ 与 CO32–
Fe3+ 与 AlO2- Fe3+ 与CO32-
Fe3+ 与 HCO3- Fe3+ 与S2–
Al3+ 与 S2–
4.某些盐溶液的配制、保存
(1)在配制FeCl3、Al(NO3)3、CuSO4、SnCl2等溶液时,为防止水解,常先将盐溶于少量__________中,再加蒸馏水稀释到所需浓度。
(2)Na2SiO3、Na2CO3、NaAlO2等碱性溶液不能贮存在___________塞的试剂瓶中。
磨口玻璃
相应的酸
5.判断蒸干盐溶液所得固体的成分
Al2(SO4)3盐溶液:
蒸干所得固体
盐酸易挥发
AlCl3盐溶液:
AlCl3+3H2O Al(OH)3+3HCl
Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4
Al2O3
Al2(SO4)3
蒸干所得固体
硫酸难挥发
蒸干灼烧
弱碱易挥发性酸盐
弱碱难挥发性酸盐
蒸干灼烧
氧化物固体
同溶质固体
规
律
1.如何通过FeCl3 溶液制得FeCl3 固体?
2.加热AlCl3·6H2O 可以得AlCl3 ?
1.在蒸发溶液过程中不断通入HCl气体。
2.在干燥的HCl气流中加热。
规
律
溶液蒸干 固体物质
NaHCO3、Na2CO3
Mg(HCO3)2、MgCO3
(NH4)2CO3或NH4HCO3
Ca(HCO3)2
FeCl3
Na2SO3
Fe2O3
MgO
Na2CO3
CaO
Na2SO4
完全分解
练习:判断加热蒸干灼烧盐溶液所得固体的成分。
6.解释事实
(1)FeCl3、KAl(SO4)2·12H2O等可作净水剂
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
Fe3+ + 3H2O Fe(OH)3 (胶体) + 3H+
(2) 泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al2(SO4)3 和 NaHCO3溶液:
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
Al 3+ + 3H2O Al(OH)3 + 3H +
HCO3– + H2O H2CO3 + OH –
速度快
耗盐少
混合前
混合后
(3)某些化学肥料不能混合使用。如铵态氮肥(含NH4+的盐)不能与草木灰(主要成分K2CO3)混合使用。
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
NH4++H2O NH3·H2O+ H+,
混施后,使两种盐的水解平衡地向右移动,以至生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。
(4)热的纯碱液去油污效果好加热能促进纯碱Na2CO3水解,产生的c(OH-)较大,而油污中的油脂在碱性较强的条件下水解更完全。
(5)在NH4Cl溶液中加入Mg粉,为何有H2放出
NH4++H2O NH3·H2O+H+
Mg+2H+ === Mg2+ +H2↑
Mg+2NH4+===Mg2++2NH3↑+H2↑
6.利用盐类水解除杂
实例:不纯的KNO3溶液中常含有杂质Fe3+,可用加热的方法来除去KNO3溶液中所含的Fe3+;除去CuCl2溶液中的Fe3+时,向溶液中加入CuO或Cu(OH)2或Cu2(OH)2CO3,促进Fe3+水解生成Fe(OH)3沉淀而除去。
原理:在除去含有某些弱碱金属阳离子的杂质时,可加入适当的试剂或促进该离子彻底水解生成氢氧化物沉淀,然后过滤除去。
练习:除去MgCl2溶液中的Fe3+可在加热搅拌条件下,可加入某试剂,后过滤。下列试剂中合适的是( )
A.NH3·H2O B.NaOH C.Na2CO3
D.MgCO3 E.MgO F.Mg(OH)2
DEF
一.影响盐类水解的因素
1.内因:
越弱越水解
2.外因:符合勒夏特列原理:
(1)温度:越热越水解
(2)浓度:越稀越水解
(3)加入酸或碱:可促进或抑制盐的水解。
小结
二.盐类水解的应用
1.判断盐溶液的酸碱性
2.比较盐溶液中离子种类的多少
3.判定离子能否大量共存:
4.某些盐溶液的配制、保存
5.判断蒸干盐溶液所得固体的成分
6.解释事实
7.利用盐类水解除杂
1.下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污
B.钢铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深
D.浓硫化钠溶液有臭味
B
随堂训练
2.对滴有酚酞溶液的下列溶液,操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
B
3.在Al3++3H2O??Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是( )
A.加热 B.通入HCl
C.加入适量Na2CO3(s) D.加入NaCl溶液
D
4.为使Na2S溶液中 的值减小,可加入的物质是( )
①盐酸 ②适量的NaOH溶液 ③适量的KOH溶液 ④适量的KHS溶液
A.①② B.②③ C.③④ D.①④
C
5.下列说法中正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C.向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
C
本节内容结束
第 三 节 盐类的水解
第 1 课时 影响盐类水解的因素和盐类水解的应用
第 2 课时 影响盐类水解的主要因素及盐类水解的应用
复习回顾
盐类的水解 :
在溶液中盐电离出来的离子跟水所电离出来的H+
或OH-结合生成弱电解质的反应,叫做盐类的水解。
水解的实质:
水解反应与中和反应的关系:
酸+碱 盐+水
中和
水解
破坏了水的电离平衡(促进水的电离)
水解的酸碱性规律:
有弱才水解,无弱不水解;
谁强显谁性,同强显中性。
一.影响盐类水解的因素
1.内因:反应物本身的性质-----主要因素:
如HA越弱, 则A-和H+更 结合, 即水解的程度更_____。
容易
大
越弱越水解
MgCl2 (aq) AlCl3 (aq)
对应的碱
酸 性
Mg(OH)2 Al(OH)3
<
>
① 不同弱酸对应的盐
NaClO (aq) CH3COONa (aq)
对应的酸
HClO CH3COOH
<
>
碱 性
② 不同弱碱对应的盐
③ 同一弱酸对应的盐
Na2CO3 (aq) NaHCO3 (aq)
对应的酸
HCO3– H2CO3
<
>
碱 性
∴ 正盐的水解程度 酸式盐的水解程度
>
Na3PO4 Na2HPO4 NaH2PO4
Na2SO3 Na2SO4 NaHSO3 NaHSO4
练习∶比较同浓度下列物质的pH值
> > >
> >
2.外因:符合勒夏特列原理:
(1)温度:盐的水解反应是吸热反应,升高温度水解程度增大。(越热越水解)
(2)浓度:加水稀释盐的溶液,水解程度增大。
(越稀越水解)
(3)加入酸或碱:可促进或抑制盐的水解。
配制FeCl3溶液需要注意什么问题?
向右
增大
增大
减小
向右
减小
减小
增大
向右
减小
增大
增大
向右
减小
减小
增大
向左
增大
增大
减小
向左
增大
减小
减小
向右
减小
减小
增大
c(CH3COO-)
c(OH-)
3.两种离子的双水解
例:Al 3+ + 3HCO3– Al(OH)3 + 3CO2
(1)不完全双水解:两离子水解相互促进,但仍部分水解,可逆的,阴阳离子仍能在溶液中大量共存,
如NH4+与S2-、HCO3- 、CO32-、CH3COO–
(2)完全双水解:水解进行完全,用“ === ”、“↑”、“↓”。阴、阳离子不能在溶液中大量共存:
①Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、ClO、
SiO32-
② Fe3+ 与 AlO2-、CO32-、HCO3-
③ NH4+ 与 SiO32-、AlO2-
说明:(Fe3+ 与 S2- 、HS-)主要发生氧化还原反应
不能大量共存的阴、阳离子:
2Al3+ + 3S2- + 6H2O === 2Al(OH)3↓+3H2S↑
2Al3+ + 3CO32- + 3H2O === 2Al(OH)3↓+3CO2↑
Al3+ + 3AlO2- + 6H2O ===4Al(OH)3↓
Al3+ + 3HCO3- === Al(OH)3↓+3CO2 ↑
练习:双水解的离子方程式的书写:
(1) Al3+ 与 CO32- (2) Al3+ 与 HCO3-
(3) Al3+ 与 S2- (4)Al3+ 与 AlO2-
对于水解平衡
Fe3+ + 3H2O Fe(OH)3 + 3H+
改变条件 移动方向 n(H+) pH 水解程度 现象
升温
通HCl(g)
加H2O
加铁粉
加NaHCO3
加NaF
溶液变深
溶液变浅
溶液变浅
溶液变浅
溶液变浅,冒气泡,产生红褐色沉淀。
溶液变深
二.盐类水解的应用:
例:相同条件,相同物质的量浓度的下列八种溶液:
Na2CO3、NaHCO3、NaClO、CH3COONa、Na2SO4、NaOH 、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为
pH: NaOH>Na2CO3>NaClO>NaHCO3
>CH3COONa> Na2SO4 >(NH4)2SO4>NaHSO4
1.判断盐溶液的酸碱性
酸性:HCO3-<HClO<H2CO3<CH3COOH
2.比较盐溶液中离子种类的多少
例:将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子种类最多的是( )
A. KCl B. Na3PO4 C. Na2CO3 D. MgSO4
B
3.判定离子能否大量共存:
Al3+ 与 AlO2–
Al3+ 与 HCO3–
Al3+ 与 CO32–
Fe3+ 与 AlO2- Fe3+ 与CO32-
Fe3+ 与 HCO3- Fe3+ 与S2–
Al3+ 与 S2–
4.某些盐溶液的配制、保存
(1)在配制FeCl3、Al(NO3)3、CuSO4、SnCl2等溶液时,为防止水解,常先将盐溶于少量__________中,再加蒸馏水稀释到所需浓度。
(2)Na2SiO3、Na2CO3、NaAlO2等碱性溶液不能贮存在___________塞的试剂瓶中。
磨口玻璃
相应的酸
5.判断蒸干盐溶液所得固体的成分
Al2(SO4)3盐溶液:
蒸干所得固体
盐酸易挥发
AlCl3盐溶液:
AlCl3+3H2O Al(OH)3+3HCl
Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4
Al2O3
Al2(SO4)3
蒸干所得固体
硫酸难挥发
蒸干灼烧
弱碱易挥发性酸盐
弱碱难挥发性酸盐
蒸干灼烧
氧化物固体
同溶质固体
规
律
1.如何通过FeCl3 溶液制得FeCl3 固体?
2.加热AlCl3·6H2O 可以得AlCl3 ?
1.在蒸发溶液过程中不断通入HCl气体。
2.在干燥的HCl气流中加热。
规
律
溶液蒸干 固体物质
NaHCO3、Na2CO3
Mg(HCO3)2、MgCO3
(NH4)2CO3或NH4HCO3
Ca(HCO3)2
FeCl3
Na2SO3
Fe2O3
MgO
Na2CO3
CaO
Na2SO4
完全分解
练习:判断加热蒸干灼烧盐溶液所得固体的成分。
6.解释事实
(1)FeCl3、KAl(SO4)2·12H2O等可作净水剂
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
Fe3+ + 3H2O Fe(OH)3 (胶体) + 3H+
(2) 泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al2(SO4)3 和 NaHCO3溶液:
Al 3+ + 3HCO3– Al(OH)3 + 3CO2
Al 3+ + 3H2O Al(OH)3 + 3H +
HCO3– + H2O H2CO3 + OH –
速度快
耗盐少
混合前
混合后
(3)某些化学肥料不能混合使用。如铵态氮肥(含NH4+的盐)不能与草木灰(主要成分K2CO3)混合使用。
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
NH4++H2O NH3·H2O+ H+,
混施后,使两种盐的水解平衡地向右移动,以至生成大量的NH3·H2O,进一步分解成NH3逸出了,从而降低了肥效。
(4)热的纯碱液去油污效果好加热能促进纯碱Na2CO3水解,产生的c(OH-)较大,而油污中的油脂在碱性较强的条件下水解更完全。
(5)在NH4Cl溶液中加入Mg粉,为何有H2放出
NH4++H2O NH3·H2O+H+
Mg+2H+ === Mg2+ +H2↑
Mg+2NH4+===Mg2++2NH3↑+H2↑
6.利用盐类水解除杂
实例:不纯的KNO3溶液中常含有杂质Fe3+,可用加热的方法来除去KNO3溶液中所含的Fe3+;除去CuCl2溶液中的Fe3+时,向溶液中加入CuO或Cu(OH)2或Cu2(OH)2CO3,促进Fe3+水解生成Fe(OH)3沉淀而除去。
原理:在除去含有某些弱碱金属阳离子的杂质时,可加入适当的试剂或促进该离子彻底水解生成氢氧化物沉淀,然后过滤除去。
练习:除去MgCl2溶液中的Fe3+可在加热搅拌条件下,可加入某试剂,后过滤。下列试剂中合适的是( )
A.NH3·H2O B.NaOH C.Na2CO3
D.MgCO3 E.MgO F.Mg(OH)2
DEF
一.影响盐类水解的因素
1.内因:
越弱越水解
2.外因:符合勒夏特列原理:
(1)温度:越热越水解
(2)浓度:越稀越水解
(3)加入酸或碱:可促进或抑制盐的水解。
小结
二.盐类水解的应用
1.判断盐溶液的酸碱性
2.比较盐溶液中离子种类的多少
3.判定离子能否大量共存:
4.某些盐溶液的配制、保存
5.判断蒸干盐溶液所得固体的成分
6.解释事实
7.利用盐类水解除杂
1.下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污
B.钢铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深
D.浓硫化钠溶液有臭味
B
随堂训练
2.对滴有酚酞溶液的下列溶液,操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
B
3.在Al3++3H2O??Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是( )
A.加热 B.通入HCl
C.加入适量Na2CO3(s) D.加入NaCl溶液
D
4.为使Na2S溶液中 的值减小,可加入的物质是( )
①盐酸 ②适量的NaOH溶液 ③适量的KOH溶液 ④适量的KHS溶液
A.①② B.②③ C.③④ D.①④
C
5.下列说法中正确的是( )
A.AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C.向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
C
本节内容结束
