4.1.2 化学电源 课件(共35张PPT)
文档属性
| 名称 | 4.1.2 化学电源 课件(共35张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-17 00:00:00 | ||
图片预览









文档简介
(共35张PPT)
第2课时
化学电源
1. 知道化学电源的分类方法。
2. 熟悉几种常见化学电源的组成和工作原理。
3. 了解化学电源广泛的应用及废旧电池对换将的危害,设想其处理方法。
学习目标
在我们的日常生活中经常会使用到化学电池,你知道哪些化学电池呢?它们有哪些优缺点?应该如何选择电池?如何判断电池的优劣?
新课引入
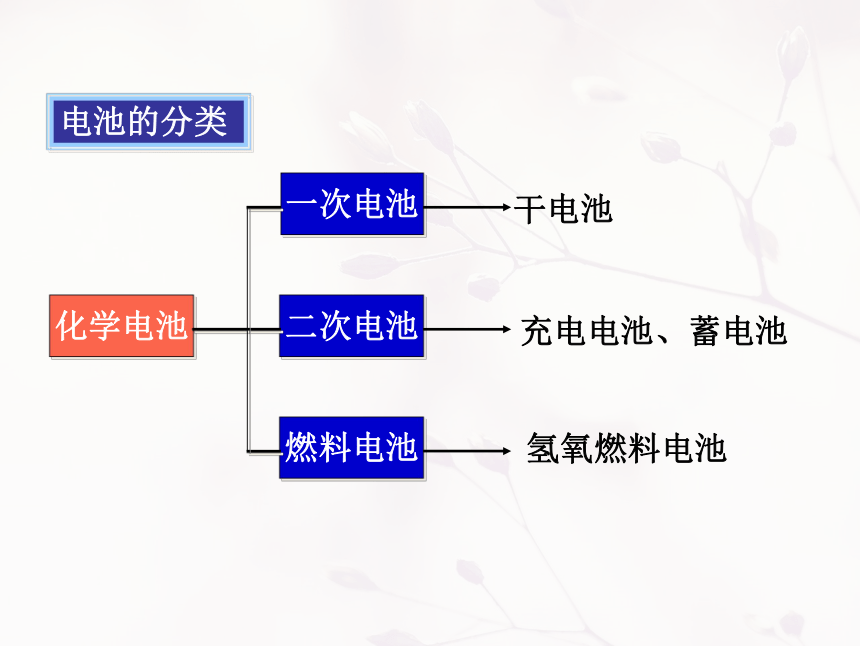
电池的分类
化学电池
一次电池
二次电池
燃料电池
干电池
充电电池、蓄电池
氢氧燃料电池
一. 一次电池
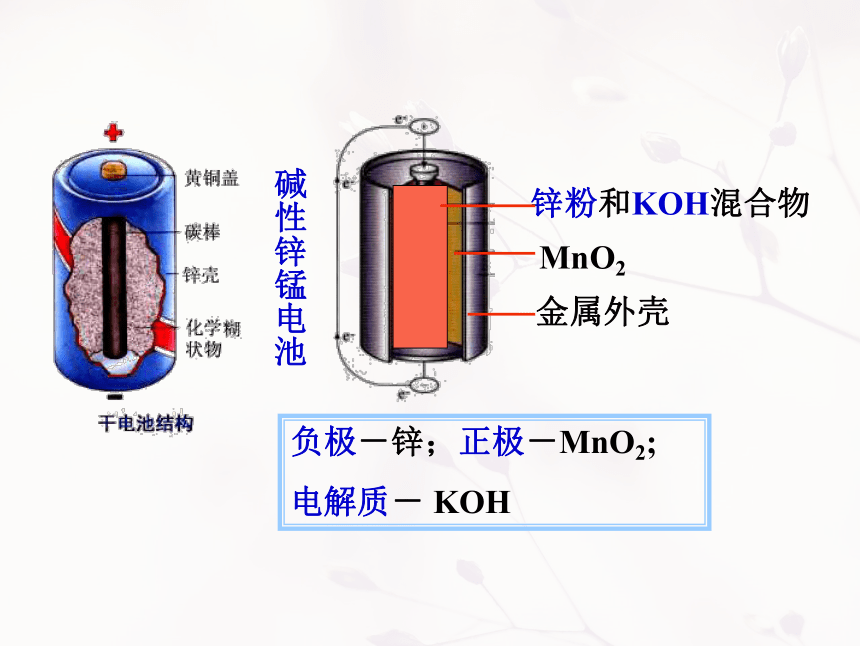
【一次电池】如:普通锌锰干电池、碱性锌锰干电池、锌银电池(钮扣电池)等。
负极-锌;正极-MnO2;
电解质- KOH
碱性锌锰电池
锌粉和KOH混合物
MnO2
金属外壳
1)正负极材料
1.碱性锌锰电池
正极:MnO2
负极:Zn
2)工作机制
负极:
Zn + 2OH- -2e- === Zn(OH)2
正极:
2MnO2+2H2O+2e-===2MnO(OH)+2OH-
氢氧化氧锰
氧化反应
还原反应
电解质:KOH
总反应:
Zn+2MnO2+2H2O === 2MnO(OH)+Zn(OH)2
多数只能一次使用,不能充电;价格较贵
缺点:
比能量和储存时间有所提高,适用于大电流和连续放电
优点:
2.锌银电池(纽扣电池)
正极:Ag2O + H2O+ 2e- === 2Ag+2OH-
负极:Zn +2OH- _2e- === Zn(OH)2
总反应:Zn+Ag2O+H2O === Zn(OH)2+2Ag
钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,已知电池内Zn的氧化产物为ZnO
优点:电压高、稳定,低污染。
3.锂电池
锂亚硫酰氯电池(Li-SOCl2):8Li+3SOCl2==6LiCl+Li2SO3+2S
负极: ;
正极: 。
用途:质轻、高能(比能量高)、高工作效率、高稳定电压、工作温度宽、高使用寿命,广泛应用于军事和航空领域。
8Li-8e- === 8Li+
3SOCl2+8e- === 6Cl-+SO32-+2S
二. 二次电池
【二次电池】既可充电又可放电。如:铅酸蓄电池、手机锂电池等。
1. 铅酸蓄电池
正极材料上涂有棕褐色的PbO2,负极材料是海绵状的金属铅,两极浸在H2SO4溶液中。写出电极反应式。
1)正负极材料
正极:PbO2
负极:Pb
2)工作机制
电解质:H2SO4溶液
铅酸蓄电池为典型的可充电电池,其电极反应分为放电和充电两个过程。
铅酸蓄电池的电压正常情况下保持2 0 V,当电压下降到1 85 V时,即停止放电,而需要将蓄电池进行充电 。目前汽车上使用的电池,有很多是铅酸蓄电池。由于它的电压稳定,使用方便、安全、可靠,价格低廉。缺点是比能量低,笨重。
Pb(s) + SO42- (aq)-2e- === PbSO4 (s)
氧化反应
负极:
①放电过程
正极:
PbO2(s)+4H+(aq)+SO42-(aq)+2e-===2PbSO4(s)+2H2O(l)
还原反应
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq) === 2PbSO4(s)+2H2O(l)
铅酸蓄电池充电的反应则是上述反应的逆过程
②充电过程
PbSO4 (s) +2e- === Pb(s) + SO42- (aq)
还原反应
阴极:
阳极:
2PbSO4 (s)+2H2O(l) -2e- === PbO2(s) + 4H+(aq) + SO42-(aq)
氧化反应
接电源负极
接电源正极
充电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l) === Pb(s)+PbO2(s)+2H2SO4(aq)
铅酸蓄电池的充放电过程:
放电
充电
2. 锂离子电池
锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备(如智能手机、笔记本电脑等)和交通工具(如电动汽车、电动自行车等)的常用电池。
工作机制:
负极:LixCy-xe-===xLi++Cy
正极:Li1-xCoO2+ xLi++ xe-=== LiCoO2
总反应:LixCy +Li1-xCoO2=== LiCoO2+Cy
放电时,锂离子由石墨中脱嵌移向正极,嵌入钴酸锂晶体中;充电时,锂离子从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。这样在放电、充电时,锂离子往返于电池的正极、负极之间,完成化学能与电能的相互转化。
练一练1:碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zn s +2MnO2 s +H2O l === Zn OH 2 s +Mn2O3 s 下列说法错误的是( )
A 电池工作时,锌失去电子
B 电池正极电极反应式为:
2MnO2 s +H2O l +2e === Mn2O3 s +2OH aq
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0 2 mol电子,锌的质量理论上减小6 5 g
C
三. 燃料电池
随着社会的进步,科技的发展,燃料电池由于其“绿色”,越来越受到人们的关注。
燃料电池是一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。电池的电极本身不包含活性物质,只是一个催化转化元件。工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排除,于是电池就连续不断地提供电能。清洁、能量转换率高的特点。
氢氧燃料电池,烃、肼、甲醇、氨、煤气燃料电池……
介质 电池反应:2H2 +O2 === 2H2O 酸性 负极
正极
中性 负极
正极
碱性 负极
正极
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
2H2 - 4e- === 4H+
O2 + 2H2O + 4e- === 4OH-
2H2 +4OH-- 4e- === 4H2O
O2 + 2H2O + 4e- === 4OH-
固体燃料电池
介质 电池反应: 2H2 +O2=== 2H2O 负极
正极
负极
正极
2H2 - 4e- +2O2- === 2H2O
O2 + 4e- === 2O2-
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利 于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……
1. 燃料电池的规律:
2. 燃料电池与前几种电池的差别:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
书写电极反应式应注意以下几点:
1.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”);
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
负极发生氧化反应:还原剂-ne- ===氧化产物
正极发生还原反应:氧化剂+ne- ===还原产物
电极反应是指还原剂(或氧化剂)失(或得)电子后生成在溶液中稳定存在微粒的过程。
4.酸性溶液中缺氧来自水生成H+,碱性溶液缺氧来自OH-生成水;
3.O2-在溶液不能独立存在,在酸性溶液中结合H+生成H2O,在碱性溶液中结合水生成OH-;
5.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在)。
练一练2:航天技术上使用的氢氧燃料电池具有高能、轻便、无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的总反应都可以表示为2H2+O2 === 2H2O,酸式电池中电解质是酸,其负极反应可表示为2H2-4e- === 4H+ ,则其正极反应式为______________ _。碱式电池的电解质是碱,其正极反应式为O2+2H2O+4e- === 4OH-,则其负极反应可表示为 。
O2+4e-+4H+ === 2H2O
2H2-4e-+4OH- === 4H2O
练一练3:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式 :
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e- === CO32- +7H2O
CH4+2O2+2KOH===K2CO3+3H2O
1.电池中含有大量的重金属、酸、碱等物质。
2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量;一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害。
四.电池的污染和回收
3.电池的回收
废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
化学电源
1. 一次电池
2. 二次电池
3. 燃料电池
——锌锰干电池
——铅酸蓄电池
——氢氧燃料电池
掌握每一类典型
电池的正负极、
电极反应;了解
每一类电池的优
缺点;对其它电
池有初步的认识
小结
1.银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是 ( )
A.Ag B.Zn(OH)2
C.Ag2O D.Zn
课堂练习
D
2.航天技术上使用一种氢氧燃料电池,它具有高能轻便不污染等优点.该电池总的化学方程式为:2H2+O2 === 2H2O;
其负极变化过程可表示为___________;
其正极变化过程可表示为
_____________。
2H2-4e- === 4H+
O2+4H++4e- === 2H2O
3.银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时它的正、负两极的电极反应式如下:Zn+2OH--2e- === Zn(OH)2 Ag2O+H2O+2e- === 2Ag+2OH-
下列判断正确的是 ( )
A.锌为负极,氧化银为正极
B.锌为正极,氧化银为负极
C.原电池工作时,负极区溶液pH增大
D.原电池反应的化学方程式为:
Zn+Ag2O+H2O === Zn(OH)2+2Ag
AD
4. 银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e- === ZnO+H2O;Ag2O+H2O+2e- === 2Ag+2OH- ;总反应为:Ag2O+Zn === 2Ag+ZnO,下列判断正确的是( )
A. 锌为正极,Ag2O为负极
B. 锌为负极,Ag2O为正极
C. 原电池工作时,负极区pH减小
D. 原电池工作时,负极区pH增大
BC
本节内容结束
第2课时
化学电源
1. 知道化学电源的分类方法。
2. 熟悉几种常见化学电源的组成和工作原理。
3. 了解化学电源广泛的应用及废旧电池对换将的危害,设想其处理方法。
学习目标
在我们的日常生活中经常会使用到化学电池,你知道哪些化学电池呢?它们有哪些优缺点?应该如何选择电池?如何判断电池的优劣?
新课引入
电池的分类
化学电池
一次电池
二次电池
燃料电池
干电池
充电电池、蓄电池
氢氧燃料电池
一. 一次电池
【一次电池】如:普通锌锰干电池、碱性锌锰干电池、锌银电池(钮扣电池)等。
负极-锌;正极-MnO2;
电解质- KOH
碱性锌锰电池
锌粉和KOH混合物
MnO2
金属外壳
1)正负极材料
1.碱性锌锰电池
正极:MnO2
负极:Zn
2)工作机制
负极:
Zn + 2OH- -2e- === Zn(OH)2
正极:
2MnO2+2H2O+2e-===2MnO(OH)+2OH-
氢氧化氧锰
氧化反应
还原反应
电解质:KOH
总反应:
Zn+2MnO2+2H2O === 2MnO(OH)+Zn(OH)2
多数只能一次使用,不能充电;价格较贵
缺点:
比能量和储存时间有所提高,适用于大电流和连续放电
优点:
2.锌银电池(纽扣电池)
正极:Ag2O + H2O+ 2e- === 2Ag+2OH-
负极:Zn +2OH- _2e- === Zn(OH)2
总反应:Zn+Ag2O+H2O === Zn(OH)2+2Ag
钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,已知电池内Zn的氧化产物为ZnO
优点:电压高、稳定,低污染。
3.锂电池
锂亚硫酰氯电池(Li-SOCl2):8Li+3SOCl2==6LiCl+Li2SO3+2S
负极: ;
正极: 。
用途:质轻、高能(比能量高)、高工作效率、高稳定电压、工作温度宽、高使用寿命,广泛应用于军事和航空领域。
8Li-8e- === 8Li+
3SOCl2+8e- === 6Cl-+SO32-+2S
二. 二次电池
【二次电池】既可充电又可放电。如:铅酸蓄电池、手机锂电池等。
1. 铅酸蓄电池
正极材料上涂有棕褐色的PbO2,负极材料是海绵状的金属铅,两极浸在H2SO4溶液中。写出电极反应式。
1)正负极材料
正极:PbO2
负极:Pb
2)工作机制
电解质:H2SO4溶液
铅酸蓄电池为典型的可充电电池,其电极反应分为放电和充电两个过程。
铅酸蓄电池的电压正常情况下保持2 0 V,当电压下降到1 85 V时,即停止放电,而需要将蓄电池进行充电 。目前汽车上使用的电池,有很多是铅酸蓄电池。由于它的电压稳定,使用方便、安全、可靠,价格低廉。缺点是比能量低,笨重。
Pb(s) + SO42- (aq)-2e- === PbSO4 (s)
氧化反应
负极:
①放电过程
正极:
PbO2(s)+4H+(aq)+SO42-(aq)+2e-===2PbSO4(s)+2H2O(l)
还原反应
放电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq) === 2PbSO4(s)+2H2O(l)
铅酸蓄电池充电的反应则是上述反应的逆过程
②充电过程
PbSO4 (s) +2e- === Pb(s) + SO42- (aq)
还原反应
阴极:
阳极:
2PbSO4 (s)+2H2O(l) -2e- === PbO2(s) + 4H+(aq) + SO42-(aq)
氧化反应
接电源负极
接电源正极
充电过程总反应:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l) === Pb(s)+PbO2(s)+2H2SO4(aq)
铅酸蓄电池的充放电过程:
放电
充电
2. 锂离子电池
锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备(如智能手机、笔记本电脑等)和交通工具(如电动汽车、电动自行车等)的常用电池。
工作机制:
负极:LixCy-xe-===xLi++Cy
正极:Li1-xCoO2+ xLi++ xe-=== LiCoO2
总反应:LixCy +Li1-xCoO2=== LiCoO2+Cy
放电时,锂离子由石墨中脱嵌移向正极,嵌入钴酸锂晶体中;充电时,锂离子从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。这样在放电、充电时,锂离子往返于电池的正极、负极之间,完成化学能与电能的相互转化。
练一练1:碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zn s +2MnO2 s +H2O l === Zn OH 2 s +Mn2O3 s 下列说法错误的是( )
A 电池工作时,锌失去电子
B 电池正极电极反应式为:
2MnO2 s +H2O l +2e === Mn2O3 s +2OH aq
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0 2 mol电子,锌的质量理论上减小6 5 g
C
三. 燃料电池
随着社会的进步,科技的发展,燃料电池由于其“绿色”,越来越受到人们的关注。
燃料电池是一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。电池的电极本身不包含活性物质,只是一个催化转化元件。工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排除,于是电池就连续不断地提供电能。清洁、能量转换率高的特点。
氢氧燃料电池,烃、肼、甲醇、氨、煤气燃料电池……
介质 电池反应:2H2 +O2 === 2H2O 酸性 负极
正极
中性 负极
正极
碱性 负极
正极
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
2H2 - 4e- === 4H+
O2 + 2H2O + 4e- === 4OH-
2H2 +4OH-- 4e- === 4H2O
O2 + 2H2O + 4e- === 4OH-
固体燃料电池
介质 电池反应: 2H2 +O2=== 2H2O 负极
正极
负极
正极
2H2 - 4e- +2O2- === 2H2O
O2 + 4e- === 2O2-
2H2 - 4e- === 4H+
O2 + 4H+ + 4e- === 2H2O
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出;
③能量转化率高(超过80%),普通的只有30%,有利 于节约能源。
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
其它燃料电池:烃、肼、甲醇、氨、煤气燃料电池……
1. 燃料电池的规律:
2. 燃料电池与前几种电池的差别:
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
书写电极反应式应注意以下几点:
1.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”);
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
负极发生氧化反应:还原剂-ne- ===氧化产物
正极发生还原反应:氧化剂+ne- ===还原产物
电极反应是指还原剂(或氧化剂)失(或得)电子后生成在溶液中稳定存在微粒的过程。
4.酸性溶液中缺氧来自水生成H+,碱性溶液缺氧来自OH-生成水;
3.O2-在溶液不能独立存在,在酸性溶液中结合H+生成H2O,在碱性溶液中结合水生成OH-;
5.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在)。
练一练2:航天技术上使用的氢氧燃料电池具有高能、轻便、无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的总反应都可以表示为2H2+O2 === 2H2O,酸式电池中电解质是酸,其负极反应可表示为2H2-4e- === 4H+ ,则其正极反应式为______________ _。碱式电池的电解质是碱,其正极反应式为O2+2H2O+4e- === 4OH-,则其负极反应可表示为 。
O2+4e-+4H+ === 2H2O
2H2-4e-+4OH- === 4H2O
练一练3:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式 :
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e- === CO32- +7H2O
CH4+2O2+2KOH===K2CO3+3H2O
1.电池中含有大量的重金属、酸、碱等物质。
2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量;一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害。
四.电池的污染和回收
3.电池的回收
废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
化学电源
1. 一次电池
2. 二次电池
3. 燃料电池
——锌锰干电池
——铅酸蓄电池
——氢氧燃料电池
掌握每一类典型
电池的正负极、
电极反应;了解
每一类电池的优
缺点;对其它电
池有初步的认识
小结
1.银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是 ( )
A.Ag B.Zn(OH)2
C.Ag2O D.Zn
课堂练习
D
2.航天技术上使用一种氢氧燃料电池,它具有高能轻便不污染等优点.该电池总的化学方程式为:2H2+O2 === 2H2O;
其负极变化过程可表示为___________;
其正极变化过程可表示为
_____________。
2H2-4e- === 4H+
O2+4H++4e- === 2H2O
3.银锌蓄电池是一种高能电池,它的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时它的正、负两极的电极反应式如下:Zn+2OH--2e- === Zn(OH)2 Ag2O+H2O+2e- === 2Ag+2OH-
下列判断正确的是 ( )
A.锌为负极,氧化银为正极
B.锌为正极,氧化银为负极
C.原电池工作时,负极区溶液pH增大
D.原电池反应的化学方程式为:
Zn+Ag2O+H2O === Zn(OH)2+2Ag
AD
4. 银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e- === ZnO+H2O;Ag2O+H2O+2e- === 2Ag+2OH- ;总反应为:Ag2O+Zn === 2Ag+ZnO,下列判断正确的是( )
A. 锌为正极,Ag2O为负极
B. 锌为负极,Ag2O为正极
C. 原电池工作时,负极区pH减小
D. 原电池工作时,负极区pH增大
BC
本节内容结束
