山东省枣庄市2022-2023学年高一上学期期末学科素养诊断化学试题(含答案)
文档属性
| 名称 | 山东省枣庄市2022-2023学年高一上学期期末学科素养诊断化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 08:29:40 | ||
图片预览



文档简介
枣庄市2022-2023学年高一上学期期末学科素养诊断
化学
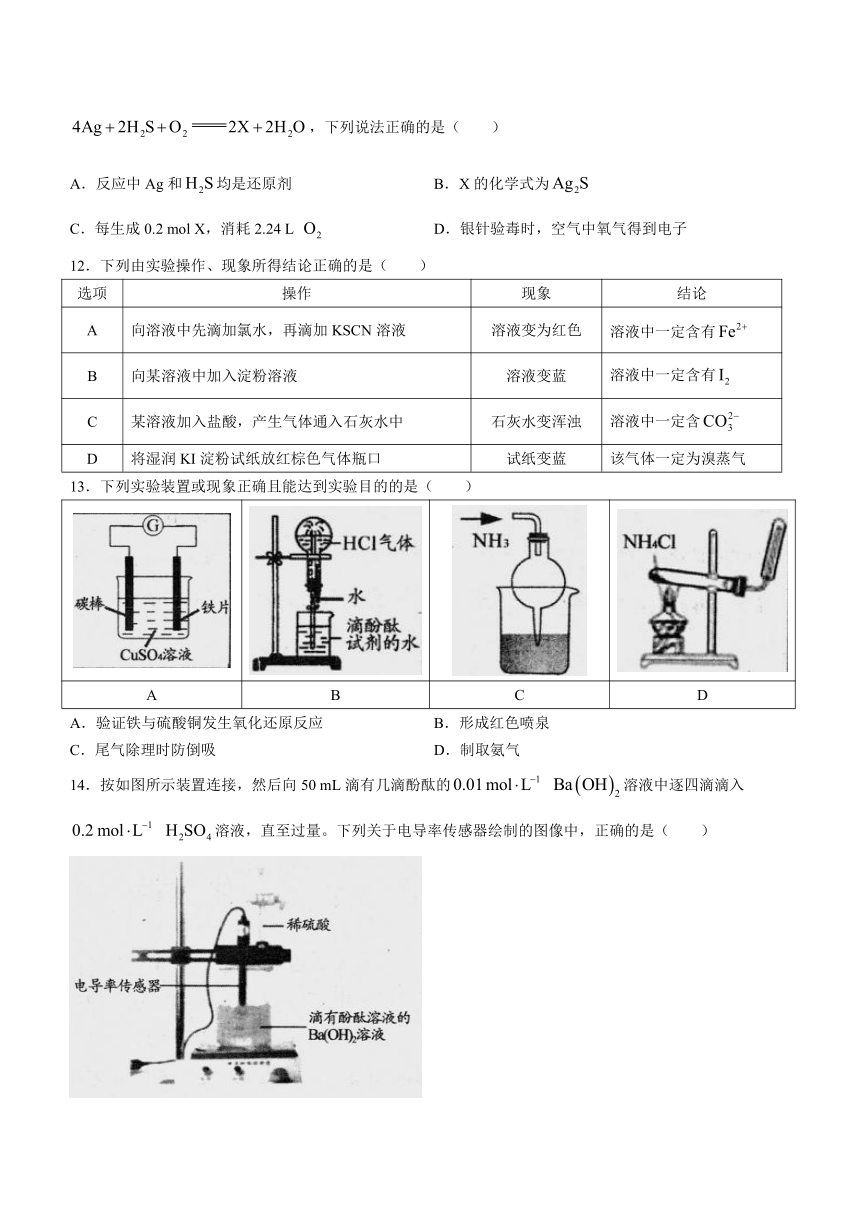
试卷分选择题和非选择题两部分,全卷满分100分,考试时间90分钟。
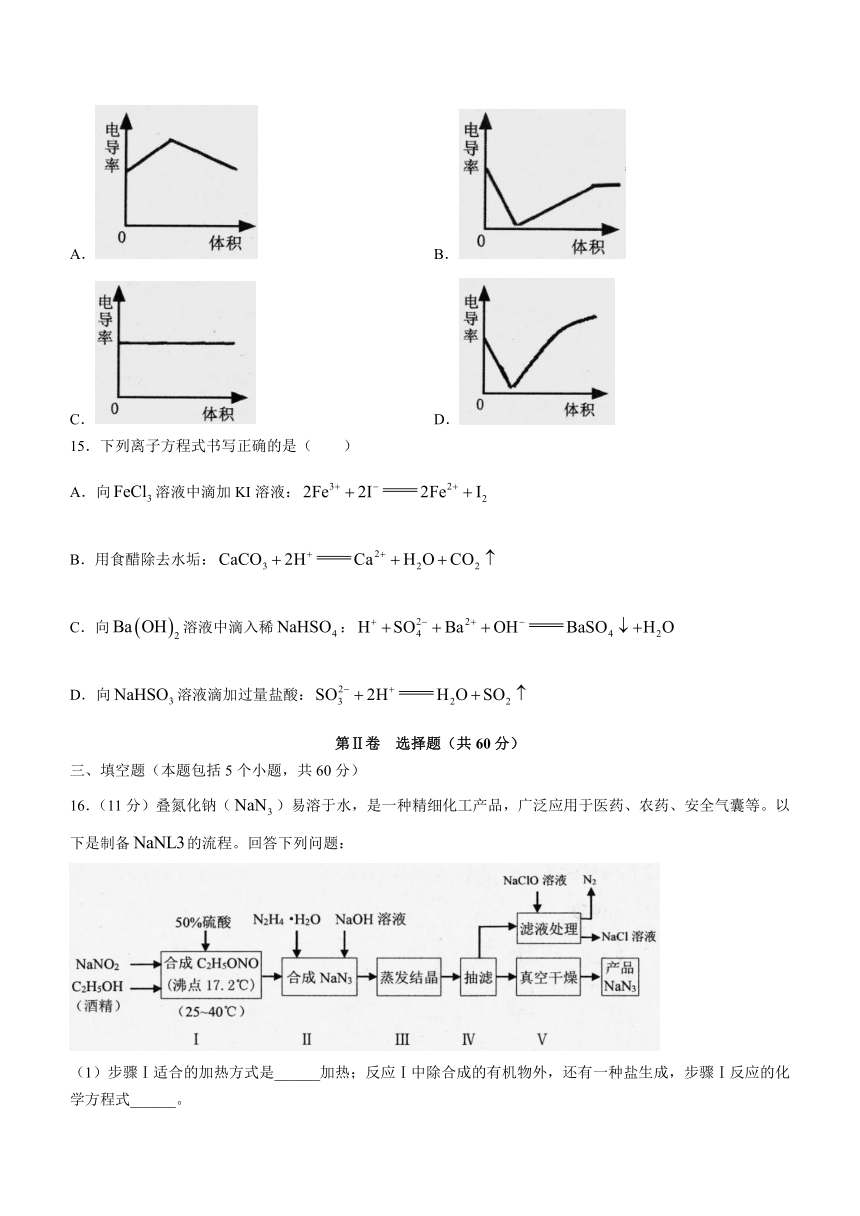
可能用到的相对原子质量:H:1 N:14 O:16 Mg:24 S:32 Cl:35.5 Fe:56 Cu:64
第Ⅰ卷 选择题(共40分)
一、选择题(本题包括10个小题,每小题只有一个正确答案,每题2分,共20分)
1.化学与生产、生活、科技等密切相关,下列说法错误的是( )
A.利用膜材料将含油污水中的油水分离,发生的是化学变化
B.屠呦呦从青蒿中提取的青蒿素对治疗疟疾有特效
C.“84消毒液”常用于新冠疫情过程中消毒处理,其主要成分是次氯酸钠
D.洁厕灵与84消毒液不能混合使用
2.下列事实中,不可以用胶体性质解释的是( )
A.利用明矾净水
B.利用食醋除去水垢
C.黑暗的电影院中,放映口发出的光会在影院中形成光柱
D.向氢氧化铁胶体溶液中滴入硫酸钠溶液出现红褐色沉淀
3.进行化学实验时应强化安全意识。下列做法错误的是( )
A.实验时用剩的钠块应该放回原试剂瓶
B.移取熔融氯化钠的坩锅,应用坩锅钳夹持
C.实验室的少量液溴,常用“水封”后保存于棕色滴瓶中
D.金属钠着火时,可用泡沫灭火器灭火
4.表示阿伏加德罗常数值,下列说法中正确的是( )
A.的KCl溶液中含数为
B.常温下,18 g 中含有的分子个数为
C.含个和的混合体积为22.4 L,则其所处状况为标准状况
D.常温下,均含A个H原子的甲烷和氨气的物质的量之比为4:3
5.下列配制一定浓度溶液的操作中,正确的是( )
A.称量 B.溶解
C.转移溶液 D.定容
6.下列除杂质的方法错误的是( )
A.气体中混有少量:用溶液洗气
B.固体中混有少量:加热
C.气体中混有少量HCl:用饱和溶液洗气
D.溶液中混有少量:加入过量Zn粉,过滤
7.下列关于浓硫酸的说法中错误的是( )
A.冷的浓硫酸可以用铝质或铁质容器存放
B.浓硫酸可以和铜片发生化学反应,但没有氢气生成
C.浓硫酸有吸水性,所以滴在蔗糖上会出现变黑现象
D.浓硫酸能与木炭反应生成二氧化硫和二氧化碳
8.下列物质均有漂白作用,其中漂白原理与其他三种物质不同的是( )
A. B.氯水 C. D.
9.有一瓶可能部分被氧化的溶液,某同学取少量此溶液,滴入溶液,产生白色沉淀,再加入足量稀硫酸,充分振荡后,仍有白色沉淀。下述有关此实验的结论正确的是( )
A.已部分被空气中的氧气氧化
B.加入溶液后,生成的沉淀中一定含有
C.加入稀硫酸后,不溶的沉淀一定是
D.此实验能确定是否部分被氧化
10.向溶液中同时加入铁粉和铜粉,充分反应后不会出现的结果是( )
A.有铁无铜 B.有铜无铁 C.铁、铜都有 D.铁铜均无
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是,下列说法正确的是( )
A.反应中Ag和均是还原剂 B.X的化学式为
C.每生成0.2 mol X,消耗2.24 L D.银针验毒时,空气中氧气得到电子
12.下列由实验操作、现象所得结论正确的是( )
选项 操作 现象 结论
A 向溶液中先滴加氯水,再滴加KSCN溶液 溶液变为红色 溶液中一定含有
B 向某溶液中加入淀粉溶液 溶液变蓝 溶液中一定含有
C 某溶液加入盐酸,产生气体通入石灰水中 石灰水变浑浊 溶液中一定含
D 将湿润KI淀粉试纸放红棕色气体瓶口 试纸变蓝 该气体一定为溴蒸气
13.下列实验装置或现象正确且能达到实验目的的是( )
A B C D
A.验证铁与硫酸铜发生氧化还原反应 B.形成红色喷泉
C.尾气除理时防倒吸 D.制取氨气
14.按如图所示装置连接,然后向50 mL滴有几滴酚酞的 溶液中逐四滴滴入 溶液,直至过量。下列关于电导率传感器绘制的图像中,正确的是( )
A. B.
C. D.
15.下列离子方程式书写正确的是( )
A.向溶液中滴加KI溶液:
B.用食醋除去水垢:
C.向溶液中滴入稀:
D.向溶液滴加过量盐酸:
第Ⅱ卷 选择题(共60分)
三、填空题(本题包括5个小题,共60分)
16.(11分)叠氮化钠()易溶于水,是一种精细化工产品,广泛应用于医药、农药、安全气囊等。以下是制备的流程。回答下列问题:
(1)步骤Ⅰ适合的加热方式是______加热;反应Ⅰ中除合成的有机物外,还有一种盐生成,步骤Ⅰ反应的化学方程式______。
(2)操作Ⅲ所用的玻璃仪器有______。
(3)叠氮化钠是气体发生剂,受热分解生成氮气和金属钠,按物质的组成和性质分类所属的物质类型为______;受热分解的化学方程式为______。
(4)步骤Ⅳ抽滤后的溶液中含有少量和。中N元素的化合价为______价;写出碱性条件下,用NaClO除去的化学方程式______。
17.(12分)根据酸碱的质子理论,“凡是能给出质子()的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。”按这个理论,下列微粒中:
①,②,③,④,⑤,⑥HClO,⑦,⑧
(1)只属于酸的微粒是:______;属于两性的微粒是:______。(填标号)。
(2)写出⑤和⑥反应的离子方程式______。
(3)经检测某工业废水显酸性,且废水中含有大量、和上述③、⑦、⑧离子。
a.下列离子中不可能大量存在该废水的是______(填标号)。
A. B. C. D.
b.将该废水调节至碱性;废水中存在的离子产生的现象是______。
(4)用流程图表示除去粗盐水中、、离子的方案设计。
(可选用试剂有:稀盐酸、稀硫酸、溶液、溶液、NaOH溶液。)
____________________________________。
18.(14分)“环境就是民生,青山就是美丽,蓝天也是幸福。”拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)二次污染指的是排入环境中的一次污染物在物理、化学因素或生物作用下发生变化,或与环境中的其他物质发生反应生成新的污染物。在、(或2)、等气体中,在大气中会造成二次污染的是______。
(2)汽车尾气(含CO、、和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化。
①写出在催化剂的作用下CO跟NO反应的化学方程式______。
②使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,其原因是______。
(3)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以和形式存在,为达到变废为宝回收利用的目的。某团队设计处理流程如下:
过程Ⅱ为硝化过程,在微生物的作用下实现的转化,在碱性条件下,被氧气氧化成的总反应离子方程式为______;
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇()实现的转化,将1 mol 完全转化为,转移的电子数为______。
(4)硫酸生产及煤燃烧产生的废气等会对大气造成污染。
①为防止工业煤燃烧产生,常向燃煤中加入浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为______。
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石()为原料。若取2吨该矿石,可制得98%的浓硫酸______吨(假设生产过程中96% 转化为)。
19.(12分)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。回答下列问题:
(1)盐酸既有酸性,又能表现氧化性和还原性。若用浓盐酸制取氯气,需要与具有______(酸性、氧化性、还原性)的物质发生反应;若用0.6 mol 与100 mL 的浓盐酸加热反应,生成的物质的量______(填标号)。
A.等于0.6 mol B.大于0.3 mol C.等于0.3 mol D.小于0.3 mol
(2)以下为用硫酸制取硫酸铜的两种方法。
①实验室常利用铜与浓硫酸加热反应制得硫酸铜;②工业上却是将废铜屑倒入热的稀硫酸中并不断通入空气来制备硫酸铜。
方法②反应的离子方程式为______。
上述两种方法中,制取硫酸铜的最佳方法是______(填“①”或“②”),理由是______。
(3)将12.8 g铜与足量的浓硝酸反应,产生NO和气体的体积为5.60 L(STP),则参加反应的硝酸的物质的量为______。
(4)Q为单质,X、Y、Z、E、M五种物质含有同一元素,一定条件下有以下的转化关系。
若M为酸。则M的化学式可能为______。
20.(13分)亚硫酰氯()又名氯化亚砜,其熔点,沸点79℃,140℃以上时易分解。是一种无色或淡黄色发烟液体,遇水剧烈与水反应生成和另一酸性气体,常用作脱水剂,广泛应用于医药、农药、染料工业及有机合成工业。
Ⅰ.氯化亚砜的保存方法是______。
Ⅱ.实验室合成的原理之一为,可选用装置如图所示。
(1)实验室用二氧化锰制备氯气,应选用的发生装置为______(填标号);发生反应的离子方程式为______。
(2)仪器a为球形冷凝管,起冷凝回流的作用。冷凝水的进口应为______(填③或④);装置b的作用为______。
(3)实验室常用亚硫酸钠和浓硫酸反应制取气体。制取干燥气体的装置与装置A的连接顺序为:②→______→⑦。
(4)写出亚硫酰氯()与水反应的化学方程式______。
高一化学参考答案
1.本答案供阅卷评分时使用,考生若写出其他合理答案,请参照标准评分
2.化学专用名词出现错别字、元素符号错误不给分,化学用语书写不规范的酌情扣分。
3.化学方程式或离子方程式不配平的不得分。
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有1个正确选项。)
1.A 2.B 3.D 4.B 5.B 6.D 7.C 8.C 9.C 10.A
二、选择题(本题包括5小题,每小题4分,共20分。每小题只有1个选项符合题意。两个选项答对一个得2分。错选不得分。)
11.BD 12.B 13.AC 14.D 15.AC
16.(11分)
(1)水浴(1分)
(2)蒸发皿、酒精灯、玻璃棒
(3)盐(1分)
(4)(1分) (除注明外,每空2分,共11分)
17.(11分)
(1)④⑥ ①(1分)
(2)
(3)BCD 有蓝色沉淀生成(1分)
(4)答案合理即可(3分) (除注明外,每空2分,共11分)
18.(14分)
(1)在、
(2)① ②转化为,产生了硫酸酸雾
(3) 或
(4)① ②2.4(每空2分,共14分。)
19.(12分)
(1)氧化性((1分) D
(2) ②(1分) 产生等量后者消耗硫酸的量少,且不产生污染环境的
(3)0.65 mol
(4)或(除注明外,每空2分,共15分。)
20.(12分)
Ⅰ.密封储存于阴凉、干燥处
Ⅱ.(1)B(1分)
(2)③(1分) 除去多余的有毒尾气,防止外部水蒸气进入
(3)⑩⑨
(4)
化学
试卷分选择题和非选择题两部分,全卷满分100分,考试时间90分钟。
可能用到的相对原子质量:H:1 N:14 O:16 Mg:24 S:32 Cl:35.5 Fe:56 Cu:64
第Ⅰ卷 选择题(共40分)
一、选择题(本题包括10个小题,每小题只有一个正确答案,每题2分,共20分)
1.化学与生产、生活、科技等密切相关,下列说法错误的是( )
A.利用膜材料将含油污水中的油水分离,发生的是化学变化
B.屠呦呦从青蒿中提取的青蒿素对治疗疟疾有特效
C.“84消毒液”常用于新冠疫情过程中消毒处理,其主要成分是次氯酸钠
D.洁厕灵与84消毒液不能混合使用
2.下列事实中,不可以用胶体性质解释的是( )
A.利用明矾净水
B.利用食醋除去水垢
C.黑暗的电影院中,放映口发出的光会在影院中形成光柱
D.向氢氧化铁胶体溶液中滴入硫酸钠溶液出现红褐色沉淀
3.进行化学实验时应强化安全意识。下列做法错误的是( )
A.实验时用剩的钠块应该放回原试剂瓶
B.移取熔融氯化钠的坩锅,应用坩锅钳夹持
C.实验室的少量液溴,常用“水封”后保存于棕色滴瓶中
D.金属钠着火时,可用泡沫灭火器灭火
4.表示阿伏加德罗常数值,下列说法中正确的是( )
A.的KCl溶液中含数为
B.常温下,18 g 中含有的分子个数为
C.含个和的混合体积为22.4 L,则其所处状况为标准状况
D.常温下,均含A个H原子的甲烷和氨气的物质的量之比为4:3
5.下列配制一定浓度溶液的操作中,正确的是( )
A.称量 B.溶解
C.转移溶液 D.定容
6.下列除杂质的方法错误的是( )
A.气体中混有少量:用溶液洗气
B.固体中混有少量:加热
C.气体中混有少量HCl:用饱和溶液洗气
D.溶液中混有少量:加入过量Zn粉,过滤
7.下列关于浓硫酸的说法中错误的是( )
A.冷的浓硫酸可以用铝质或铁质容器存放
B.浓硫酸可以和铜片发生化学反应,但没有氢气生成
C.浓硫酸有吸水性,所以滴在蔗糖上会出现变黑现象
D.浓硫酸能与木炭反应生成二氧化硫和二氧化碳
8.下列物质均有漂白作用,其中漂白原理与其他三种物质不同的是( )
A. B.氯水 C. D.
9.有一瓶可能部分被氧化的溶液,某同学取少量此溶液,滴入溶液,产生白色沉淀,再加入足量稀硫酸,充分振荡后,仍有白色沉淀。下述有关此实验的结论正确的是( )
A.已部分被空气中的氧气氧化
B.加入溶液后,生成的沉淀中一定含有
C.加入稀硫酸后,不溶的沉淀一定是
D.此实验能确定是否部分被氧化
10.向溶液中同时加入铁粉和铜粉,充分反应后不会出现的结果是( )
A.有铁无铜 B.有铜无铁 C.铁、铜都有 D.铁铜均无
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是,下列说法正确的是( )
A.反应中Ag和均是还原剂 B.X的化学式为
C.每生成0.2 mol X,消耗2.24 L D.银针验毒时,空气中氧气得到电子
12.下列由实验操作、现象所得结论正确的是( )
选项 操作 现象 结论
A 向溶液中先滴加氯水,再滴加KSCN溶液 溶液变为红色 溶液中一定含有
B 向某溶液中加入淀粉溶液 溶液变蓝 溶液中一定含有
C 某溶液加入盐酸,产生气体通入石灰水中 石灰水变浑浊 溶液中一定含
D 将湿润KI淀粉试纸放红棕色气体瓶口 试纸变蓝 该气体一定为溴蒸气
13.下列实验装置或现象正确且能达到实验目的的是( )
A B C D
A.验证铁与硫酸铜发生氧化还原反应 B.形成红色喷泉
C.尾气除理时防倒吸 D.制取氨气
14.按如图所示装置连接,然后向50 mL滴有几滴酚酞的 溶液中逐四滴滴入 溶液,直至过量。下列关于电导率传感器绘制的图像中,正确的是( )
A. B.
C. D.
15.下列离子方程式书写正确的是( )
A.向溶液中滴加KI溶液:
B.用食醋除去水垢:
C.向溶液中滴入稀:
D.向溶液滴加过量盐酸:
第Ⅱ卷 选择题(共60分)
三、填空题(本题包括5个小题,共60分)
16.(11分)叠氮化钠()易溶于水,是一种精细化工产品,广泛应用于医药、农药、安全气囊等。以下是制备的流程。回答下列问题:
(1)步骤Ⅰ适合的加热方式是______加热;反应Ⅰ中除合成的有机物外,还有一种盐生成,步骤Ⅰ反应的化学方程式______。
(2)操作Ⅲ所用的玻璃仪器有______。
(3)叠氮化钠是气体发生剂,受热分解生成氮气和金属钠,按物质的组成和性质分类所属的物质类型为______;受热分解的化学方程式为______。
(4)步骤Ⅳ抽滤后的溶液中含有少量和。中N元素的化合价为______价;写出碱性条件下,用NaClO除去的化学方程式______。
17.(12分)根据酸碱的质子理论,“凡是能给出质子()的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。”按这个理论,下列微粒中:
①,②,③,④,⑤,⑥HClO,⑦,⑧
(1)只属于酸的微粒是:______;属于两性的微粒是:______。(填标号)。
(2)写出⑤和⑥反应的离子方程式______。
(3)经检测某工业废水显酸性,且废水中含有大量、和上述③、⑦、⑧离子。
a.下列离子中不可能大量存在该废水的是______(填标号)。
A. B. C. D.
b.将该废水调节至碱性;废水中存在的离子产生的现象是______。
(4)用流程图表示除去粗盐水中、、离子的方案设计。
(可选用试剂有:稀盐酸、稀硫酸、溶液、溶液、NaOH溶液。)
____________________________________。
18.(14分)“环境就是民生,青山就是美丽,蓝天也是幸福。”拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)二次污染指的是排入环境中的一次污染物在物理、化学因素或生物作用下发生变化,或与环境中的其他物质发生反应生成新的污染物。在、(或2)、等气体中,在大气中会造成二次污染的是______。
(2)汽车尾气(含CO、、和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化。
①写出在催化剂的作用下CO跟NO反应的化学方程式______。
②使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,其原因是______。
(3)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以和形式存在,为达到变废为宝回收利用的目的。某团队设计处理流程如下:
过程Ⅱ为硝化过程,在微生物的作用下实现的转化,在碱性条件下,被氧气氧化成的总反应离子方程式为______;
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇()实现的转化,将1 mol 完全转化为,转移的电子数为______。
(4)硫酸生产及煤燃烧产生的废气等会对大气造成污染。
①为防止工业煤燃烧产生,常向燃煤中加入浆状物进行脱硫,脱硫的产品用于制造石膏。脱硫反应的化学方程式为______。
②某硫酸化工厂,使用一种含杂质为25%的黄铁矿石()为原料。若取2吨该矿石,可制得98%的浓硫酸______吨(假设生产过程中96% 转化为)。
19.(12分)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。回答下列问题:
(1)盐酸既有酸性,又能表现氧化性和还原性。若用浓盐酸制取氯气,需要与具有______(酸性、氧化性、还原性)的物质发生反应;若用0.6 mol 与100 mL 的浓盐酸加热反应,生成的物质的量______(填标号)。
A.等于0.6 mol B.大于0.3 mol C.等于0.3 mol D.小于0.3 mol
(2)以下为用硫酸制取硫酸铜的两种方法。
①实验室常利用铜与浓硫酸加热反应制得硫酸铜;②工业上却是将废铜屑倒入热的稀硫酸中并不断通入空气来制备硫酸铜。
方法②反应的离子方程式为______。
上述两种方法中,制取硫酸铜的最佳方法是______(填“①”或“②”),理由是______。
(3)将12.8 g铜与足量的浓硝酸反应,产生NO和气体的体积为5.60 L(STP),则参加反应的硝酸的物质的量为______。
(4)Q为单质,X、Y、Z、E、M五种物质含有同一元素,一定条件下有以下的转化关系。
若M为酸。则M的化学式可能为______。
20.(13分)亚硫酰氯()又名氯化亚砜,其熔点,沸点79℃,140℃以上时易分解。是一种无色或淡黄色发烟液体,遇水剧烈与水反应生成和另一酸性气体,常用作脱水剂,广泛应用于医药、农药、染料工业及有机合成工业。
Ⅰ.氯化亚砜的保存方法是______。
Ⅱ.实验室合成的原理之一为,可选用装置如图所示。
(1)实验室用二氧化锰制备氯气,应选用的发生装置为______(填标号);发生反应的离子方程式为______。
(2)仪器a为球形冷凝管,起冷凝回流的作用。冷凝水的进口应为______(填③或④);装置b的作用为______。
(3)实验室常用亚硫酸钠和浓硫酸反应制取气体。制取干燥气体的装置与装置A的连接顺序为:②→______→⑦。
(4)写出亚硫酰氯()与水反应的化学方程式______。
高一化学参考答案
1.本答案供阅卷评分时使用,考生若写出其他合理答案,请参照标准评分
2.化学专用名词出现错别字、元素符号错误不给分,化学用语书写不规范的酌情扣分。
3.化学方程式或离子方程式不配平的不得分。
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有1个正确选项。)
1.A 2.B 3.D 4.B 5.B 6.D 7.C 8.C 9.C 10.A
二、选择题(本题包括5小题,每小题4分,共20分。每小题只有1个选项符合题意。两个选项答对一个得2分。错选不得分。)
11.BD 12.B 13.AC 14.D 15.AC
16.(11分)
(1)水浴(1分)
(2)蒸发皿、酒精灯、玻璃棒
(3)盐(1分)
(4)(1分) (除注明外,每空2分,共11分)
17.(11分)
(1)④⑥ ①(1分)
(2)
(3)BCD 有蓝色沉淀生成(1分)
(4)答案合理即可(3分) (除注明外,每空2分,共11分)
18.(14分)
(1)在、
(2)① ②转化为,产生了硫酸酸雾
(3) 或
(4)① ②2.4(每空2分,共14分。)
19.(12分)
(1)氧化性((1分) D
(2) ②(1分) 产生等量后者消耗硫酸的量少,且不产生污染环境的
(3)0.65 mol
(4)或(除注明外,每空2分,共15分。)
20.(12分)
Ⅰ.密封储存于阴凉、干燥处
Ⅱ.(1)B(1分)
(2)③(1分) 除去多余的有毒尾气,防止外部水蒸气进入
(3)⑩⑨
(4)
同课章节目录
