化学人教版(2019)选择性必修3 3.4.1羧酸(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.4.1羧酸(共33张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 10.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 09:00:28 | ||
图片预览









文档简介
(共33张PPT)
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第一课时
一、羧酸的定义及分类
O
CH3—C—O—H
=
O
H—C—O—H
=
CH2COOH
HO—C—COOH
CH2COOH
_
_
COOH
—
=
=
1、定义:分子由烃基(或氢原子)与羧基相连构成的有机化合物称为羧酸
甲酸(蚁酸)
乙酸(醋酸)
乙二酸
(草酸)
苯甲酸
(安息香酸)
柠檬酸
官能团:羧基
或
—COOH
—C—O—H
O
=
饱和一元羧酸通式:CnH2n+1COOH
2、 分类
烃基不同
脂肪酸
芳香酸
CH3COOH
CH2=CHCOOH
羧基数目
一元羧酸
二元羧酸
多元羧酸
HO—C—COOH
CH2—COOH
CH2—COOH
羧酸
低级脂肪酸
高级脂肪酸
硬脂酸——C17H35COOH
软脂酸——C15H31COOH
油酸——C17H33COOH
HCOOH、CH2=CHCOOH等
COOH
—
COOH
COOH
命名原则:
3、羧酸的命名:
(1)选取分子中有羧基的最长碳链作为主链,按主链碳原子数称
为“某酸”。
(2)从羧基碳原子开始编号
(3)在“某酸”名称之前加上取代基的位次号和名称。
CH3—CH — CH2 — CH2 —COOH
CH3
|
4- 甲基戊酸
1
2
3
4
5
4 甲基 3 乙基戊酸
9-十八碳烯酸(油酸)
丙烯酸
3-甲基-2-丁烯酸
4-甲基-2-乙基戊酸
2-甲基丁二酸
邻甲基苯甲酸
邻苯二甲酸
邻羟基苯甲酸(水杨酸)
对硝基苯甲酸
3-苯基丁酸
自然界和日常生活中的有机酸
资料卡片
蚁酸(甲酸)
HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
未成熟的梅子、李子、杏子等水果中,含有草酸、安息香酸等成分
草酸
(乙二酸)
COOH
COOH
安息香酸
(苯甲酸)
COOH
CH2COOH
CH(OH)COOH
苹果酸
CH3COOH
醋酸(乙酸)
CH3CHCOOH
OH
乳酸
二、羧酸物理性质
根据表中数据,归纳一元羧酸的物理性质递变规律,从分子结构角度分析可能的原因。
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 —COOH 122 249
沸 点:随着分子中碳原子数的增加,沸点逐渐升高。
溶解度:分子中碳原子数目小于4的羧酸与水互溶;随着分子中碳原
子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水,
高级脂肪酸是不溶于水的蜡状固体。
分子间作用力
相对分子质量相当的不同有机物的沸点数据
名称 甲酸 乙醛 乙醇 乙酸 丙醛 正丙醇 丙酸 丁醛 正丁醇
结构简式 HCOOH CH3CHO CH3CH2OH CH3COOH CH3CH2 CHO CH3CH2 CH2OH CH3CH2COOH CH3(CH2)2 CHO CH3(CH2)2
CH2OH
相对分子质量 46 44 46 60 58 60 74 72 74
沸点/℃ 101 21 78.4 118 49 97.2 141 76 117.8
与相对分子质量相当的其他有机物的沸点相比:
这与分子间可以形成氢键有关。
R
H
O
C
O
R
H
O
C
O
…
氢键
R
H
O
C
O
R
H
O
C
O
…
氢键
羧酸的沸点较高
由于羧酸分子形成氢键的机会比相对分子质量相近的醇的多,羧酸的沸点
比相应的醇的高。
断键方式:
表现出酸性
发生酯化反应
羧酸的化学性质主要取决于羧基官能团。由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时,羧基结构中下面两个部位的化学键容易断裂:
—C—O—H
O
δ+
δ-
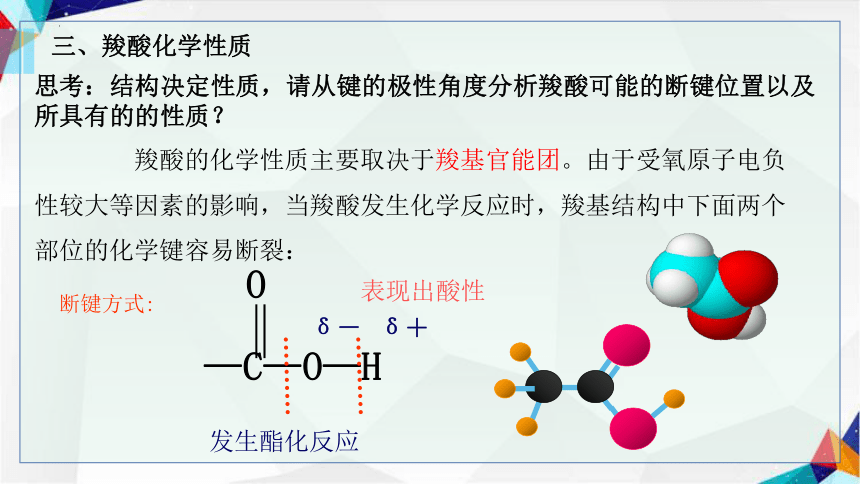
思考:结构决定性质,请从键的极性角度分析羧酸可能的断键位置以及所具有的的性质?
三、羧酸化学性质
1、弱酸性:具有酸的通性
CH3COOH CH3COO-+H+
(1)跟指示剂反应
(2)跟活泼金属起置换反应(与氢前金属反应)
(3)跟碱性氧化物反应
(4)跟碱起中和反应
(5)跟某些盐反应
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
2CH3COOH +2Na = 2CH3COONa +H2↑
CH3COOH+NaOH=CH3COONa+H2O
2CH3COOH+Na2O=2CH3COONa+2H2O
2CH3COOH + CaCO3 = (CH3COO)2Ca +H2O+CO2↑
【实验探究1】甲酸、苯甲酸和乙二酸的酸性
实验对象 甲酸 苯甲酸 乙二酸
实验 操作 ① ② 现象 结论 分别取0.01 mol·L-1三种酸溶液,滴入紫色石蕊溶液
分别取0.01 mol·L-1三种酸溶液,测pH
①紫色石蕊溶液变红色
②pH大于2
甲酸、苯甲酸和乙二酸具有弱酸性
思考与讨论:利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。请写出各装置中发生反应的化学方程式。
CH3COOH
A
B
C
Na2CO3
饱和NaHCO3溶液
苯酚钠溶液
D
E
F
G
H
J
注:D、E、F、G分别是双孔橡胶塞上的孔
I
【实验探究2】乙酸、碳酸和苯酚的酸性强弱
思考:
1.产生的CO2是纯净物吗?
2.试管内溶液变浑浊一定是CO2的作用吗?
2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑
CO2+H2O+C6H5ONa→C6H5OH+NaHCO3
有气泡生成
溶液变浑浊
各装置发生的反应为:
根据强酸制弱酸的原理
除CO2中的乙酸
接口的顺序:A→D→E→B→C→F→G→H→I→J
CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑
酸性:乙酸 > 碳酸 > 苯酚
2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑
CO2+H2O+C6H5ONa→C6H5OH+NaHCO3
各装置发生的反应为:
思考与讨论:除了定性的比较羧酸的酸性,如何定量比较羧酸的酸性?
(1)测定相同c的羧酸pH
(2)电离平衡常数Ka
名称 甲酸(蚁酸) 苯甲酸(安息香酸) 乙二酸(草酸)
结构 简式
物理 性质
HCOOH
4、生活中常见的羧酸和羧酸盐及其用途
无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶
属于芳香酸,无色晶体,易升华,微溶于水,易溶于乙醇
无色晶体,通常含有两分子结晶水,可溶于水和乙醇
名称 甲酸 苯甲酸 乙二酸
化学 性质
用途
既表现羧酸的性质,又表现醛的性质
工业上可用作还原剂,也是合成医药、农药和染料等的原料。
表现羧酸的性质
用于合成香料、药物等,它的钠盐是常用的食品防腐剂。
表现羧酸的性质
化学分析中常用的还原剂,也是重要的化工原料。
讨论1.甲酸除了具有酸性,还可能具有什么化学性质?请从分子结构分析。
氧化反应
酸性,酯化反应
O
H—C—O—H
羧基
醛基
讨论3.乙二酸的特性
a、弱酸性:
b、还原性:
c、不稳定性:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
H2C2O4 H++HC2O4- ;HC2O4- H++C2O42-
H2C2O4 ═ H2O+CO↑+CO2↑
【酸性】HOOC-COOH > HCOOH > C6H5COOH > CH3COOH
讨论2.如何证明甲酸、苯甲酸是一元酸,乙二酸是二元酸
酸碱中和定量关系
2、酯化反应
乙酸与乙醇的酯化反应,从形式上看是羧基与羟基之间脱去一个水分子。脱水时有以下两种可能的方式,你能设计一个实验方案来证明是哪一种吗?
乙酸与乙醇的酯化反应方程式:
同位素示踪法
在乙酸乙酯中检测到放射性同位素18O,证明断键方式①正确,酯化
反应的机理是:酸脱-OH,醇脱-H
思考与讨论:在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请结合化学反应原理的有关知识进行说明。
①浓度:
(1)影响产率的因素
②温度:
控制温度在60~70℃,既有利于反应正向进行,又能减少反应物
的挥发。温度过高,反应速率增大,但易使有机物发生炭化。
增加乙醇的用量(乙醇的沸点比乙酸低,更容易挥发而损失),
提高乙酸的转化率进而提高产率。
加入适量浓硫酸,吸收反应生成的水,使平衡正向移动;
饱和碳酸钠溶液
乙醇、乙酸、
浓硫酸
实验分析
1、浓硫酸的作用是:
3、得到的反应产物是否纯净?主要杂质有 哪些?
4、饱和Na2CO3溶液有什么作用?
催化剂、吸水剂
不纯净;主要含乙酸、乙醇。
① 中和乙酸 ② 溶解乙醇。
③ 降低酯在水中的溶解度,以便使酯分层析出。
2、试剂加入的顺序应该怎样:
无水乙醇、浓硫酸、乙酸
6、有无其它防倒吸的方法?
5、为什么导管不插入饱和Na2CO3溶液中?
防止受热不匀发生倒吸。
四、完善“醇、醛、酸、酯”的相互转化模型
思考:酒越陈越香的原因?
醇
醛
酯
羧酸
氧化(O2)
氧化
还原(H2)
(O2、酸性KMnO4溶液、溴水、
新制Cu(OH)2、Ag(NH3)2OH )
酯化反应
乙醇
乙醛
乙酸
乙酸乙酯
酸性
O
—C—O—R
=
O
—C—O—H
=
O
—C—H
=
R—O—H
O
—C—O-
=
练习1、牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸的结构简式如下,请回答下列问题。
(1)乳酸在浓H2SO4加热条件下,分别能与乙醇、乙酸发生化学反应,
请写出相应反应的化学方程式 。
HO CH
CH3
COOH
+ C2H5OH
+ H2O
△
浓硫酸
HO CH
CH3
COOC2H5
(2)写出两分子乳酸发生酯化反应脱去一分子水形成链状酯的结构简式
HO CH
CH3
COOH
+
HO CH
CH3
COOH
HO CH
CH3
C O
CH
CH3
COOH
+
H2O
O
△
浓硫酸
HO CH
CH3
COOH
CH3COOH +
+ H2O
△
浓硫酸
CH3COO
CH
CH3
COOH
(3)写出两分子乳酸发生酯化反应脱去两分子水生成环状酯的结构简式
工业上以丙酸为原料,采用氯化氨化法合成丙氨酸
在105℃和3%赤磷催化剂存在下,通入液氯进行氯化,生成2-氯丙酸,然后进入氨水溶液中,以乌洛托品为催化剂,在60℃温度下进行氨化,即生成丙氨酸。
3、羧酸的α-H取代反应(了解)
CH3-CH2-COOH+Cl2 CH3-CH-COOH+HCl
催化剂
|
Cl
α
羟基对羰基的影响,使羧基中的羰基较难发生加成反应,只有在特定条件或催化剂作用下,反应才能进行。羧酸很难通过催化加氢的方法被还原,用较强还原剂氢化铝锂能将羧酸还原为相应的醇。
4、羧酸的还原反应(了解)
R-C-O-H R-CH2OH
O
=
LiAlH4
第三章 烃的衍生物
第四节 羧酸 羧酸衍生物
第一课时
一、羧酸的定义及分类
O
CH3—C—O—H
=
O
H—C—O—H
=
CH2COOH
HO—C—COOH
CH2COOH
_
_
COOH
—
=
=
1、定义:分子由烃基(或氢原子)与羧基相连构成的有机化合物称为羧酸
甲酸(蚁酸)
乙酸(醋酸)
乙二酸
(草酸)
苯甲酸
(安息香酸)
柠檬酸
官能团:羧基
或
—COOH
—C—O—H
O
=
饱和一元羧酸通式:CnH2n+1COOH
2、 分类
烃基不同
脂肪酸
芳香酸
CH3COOH
CH2=CHCOOH
羧基数目
一元羧酸
二元羧酸
多元羧酸
HO—C—COOH
CH2—COOH
CH2—COOH
羧酸
低级脂肪酸
高级脂肪酸
硬脂酸——C17H35COOH
软脂酸——C15H31COOH
油酸——C17H33COOH
HCOOH、CH2=CHCOOH等
COOH
—
COOH
COOH
命名原则:
3、羧酸的命名:
(1)选取分子中有羧基的最长碳链作为主链,按主链碳原子数称
为“某酸”。
(2)从羧基碳原子开始编号
(3)在“某酸”名称之前加上取代基的位次号和名称。
CH3—CH — CH2 — CH2 —COOH
CH3
|
4- 甲基戊酸
1
2
3
4
5
4 甲基 3 乙基戊酸
9-十八碳烯酸(油酸)
丙烯酸
3-甲基-2-丁烯酸
4-甲基-2-乙基戊酸
2-甲基丁二酸
邻甲基苯甲酸
邻苯二甲酸
邻羟基苯甲酸(水杨酸)
对硝基苯甲酸
3-苯基丁酸
自然界和日常生活中的有机酸
资料卡片
蚁酸(甲酸)
HCOOH
柠檬酸
HO—C—COOH
CH2—COOH
CH2—COOH
未成熟的梅子、李子、杏子等水果中,含有草酸、安息香酸等成分
草酸
(乙二酸)
COOH
COOH
安息香酸
(苯甲酸)
COOH
CH2COOH
CH(OH)COOH
苹果酸
CH3COOH
醋酸(乙酸)
CH3CHCOOH
OH
乳酸
二、羧酸物理性质
根据表中数据,归纳一元羧酸的物理性质递变规律,从分子结构角度分析可能的原因。
名称 结构简式 熔点/℃ 沸点/℃
甲酸 HCOOH 8 101
乙酸 CH3COOH 17 118
丙酸 CH3CH2COOH -21 141
正丁酸 CH3CH2CH2COOH -5 166
十八酸(硬脂酸) CH3(CH2)16COOH 70 383
苯甲酸 —COOH 122 249
沸 点:随着分子中碳原子数的增加,沸点逐渐升高。
溶解度:分子中碳原子数目小于4的羧酸与水互溶;随着分子中碳原
子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水,
高级脂肪酸是不溶于水的蜡状固体。
分子间作用力
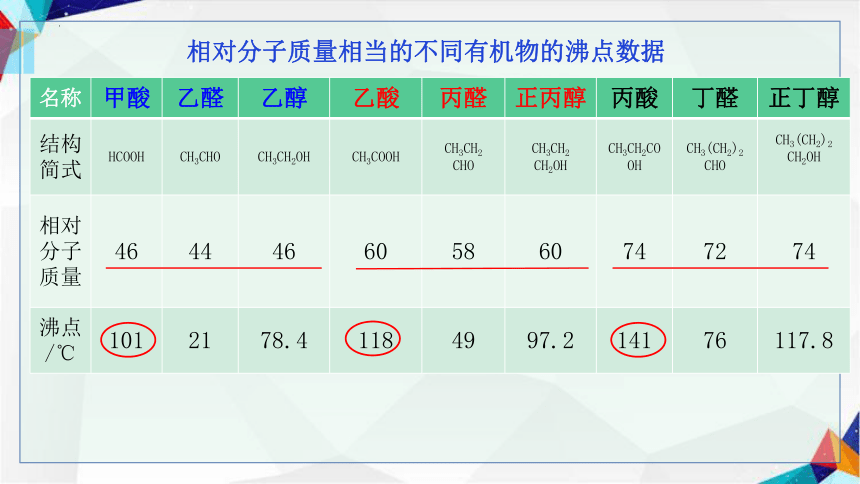
相对分子质量相当的不同有机物的沸点数据
名称 甲酸 乙醛 乙醇 乙酸 丙醛 正丙醇 丙酸 丁醛 正丁醇
结构简式 HCOOH CH3CHO CH3CH2OH CH3COOH CH3CH2 CHO CH3CH2 CH2OH CH3CH2COOH CH3(CH2)2 CHO CH3(CH2)2
CH2OH
相对分子质量 46 44 46 60 58 60 74 72 74
沸点/℃ 101 21 78.4 118 49 97.2 141 76 117.8
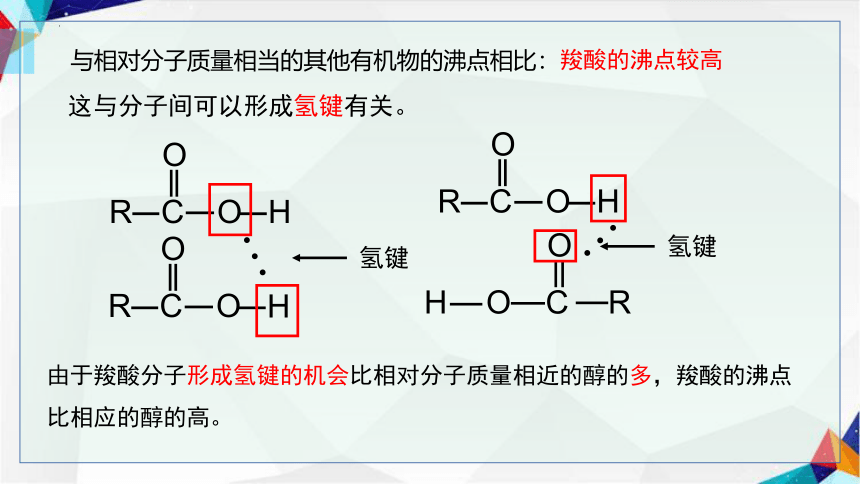
与相对分子质量相当的其他有机物的沸点相比:
这与分子间可以形成氢键有关。
R
H
O
C
O
R
H
O
C
O
…
氢键
R
H
O
C
O
R
H
O
C
O
…
氢键
羧酸的沸点较高
由于羧酸分子形成氢键的机会比相对分子质量相近的醇的多,羧酸的沸点
比相应的醇的高。
断键方式:
表现出酸性
发生酯化反应
羧酸的化学性质主要取决于羧基官能团。由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时,羧基结构中下面两个部位的化学键容易断裂:
—C—O—H
O
δ+
δ-
思考:结构决定性质,请从键的极性角度分析羧酸可能的断键位置以及所具有的的性质?
三、羧酸化学性质
1、弱酸性:具有酸的通性
CH3COOH CH3COO-+H+
(1)跟指示剂反应
(2)跟活泼金属起置换反应(与氢前金属反应)
(3)跟碱性氧化物反应
(4)跟碱起中和反应
(5)跟某些盐反应
2CH3COOH + Na2CO3 = 2CH3COONa+H2O+CO2↑
2CH3COOH +2Na = 2CH3COONa +H2↑
CH3COOH+NaOH=CH3COONa+H2O
2CH3COOH+Na2O=2CH3COONa+2H2O
2CH3COOH + CaCO3 = (CH3COO)2Ca +H2O+CO2↑
【实验探究1】甲酸、苯甲酸和乙二酸的酸性
实验对象 甲酸 苯甲酸 乙二酸
实验 操作 ① ② 现象 结论 分别取0.01 mol·L-1三种酸溶液,滴入紫色石蕊溶液
分别取0.01 mol·L-1三种酸溶液,测pH
①紫色石蕊溶液变红色
②pH大于2
甲酸、苯甲酸和乙二酸具有弱酸性
思考与讨论:利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。请写出各装置中发生反应的化学方程式。
CH3COOH
A
B
C
Na2CO3
饱和NaHCO3溶液
苯酚钠溶液
D
E
F
G
H
J
注:D、E、F、G分别是双孔橡胶塞上的孔
I
【实验探究2】乙酸、碳酸和苯酚的酸性强弱
思考:
1.产生的CO2是纯净物吗?
2.试管内溶液变浑浊一定是CO2的作用吗?
2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑
CO2+H2O+C6H5ONa→C6H5OH+NaHCO3
有气泡生成
溶液变浑浊
各装置发生的反应为:
根据强酸制弱酸的原理
除CO2中的乙酸
接口的顺序:A→D→E→B→C→F→G→H→I→J
CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑
酸性:乙酸 > 碳酸 > 苯酚
2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2↑
CO2+H2O+C6H5ONa→C6H5OH+NaHCO3
各装置发生的反应为:
思考与讨论:除了定性的比较羧酸的酸性,如何定量比较羧酸的酸性?
(1)测定相同c的羧酸pH
(2)电离平衡常数Ka
名称 甲酸(蚁酸) 苯甲酸(安息香酸) 乙二酸(草酸)
结构 简式
物理 性质
HCOOH
4、生活中常见的羧酸和羧酸盐及其用途
无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶
属于芳香酸,无色晶体,易升华,微溶于水,易溶于乙醇
无色晶体,通常含有两分子结晶水,可溶于水和乙醇
名称 甲酸 苯甲酸 乙二酸
化学 性质
用途
既表现羧酸的性质,又表现醛的性质
工业上可用作还原剂,也是合成医药、农药和染料等的原料。
表现羧酸的性质
用于合成香料、药物等,它的钠盐是常用的食品防腐剂。
表现羧酸的性质
化学分析中常用的还原剂,也是重要的化工原料。
讨论1.甲酸除了具有酸性,还可能具有什么化学性质?请从分子结构分析。
氧化反应
酸性,酯化反应
O
H—C—O—H
羧基
醛基
讨论3.乙二酸的特性
a、弱酸性:
b、还原性:
c、不稳定性:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
H2C2O4 H++HC2O4- ;HC2O4- H++C2O42-
H2C2O4 ═ H2O+CO↑+CO2↑
【酸性】HOOC-COOH > HCOOH > C6H5COOH > CH3COOH
讨论2.如何证明甲酸、苯甲酸是一元酸,乙二酸是二元酸
酸碱中和定量关系
2、酯化反应
乙酸与乙醇的酯化反应,从形式上看是羧基与羟基之间脱去一个水分子。脱水时有以下两种可能的方式,你能设计一个实验方案来证明是哪一种吗?
乙酸与乙醇的酯化反应方程式:
同位素示踪法
在乙酸乙酯中检测到放射性同位素18O,证明断键方式①正确,酯化
反应的机理是:酸脱-OH,醇脱-H
思考与讨论:在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请结合化学反应原理的有关知识进行说明。
①浓度:
(1)影响产率的因素
②温度:
控制温度在60~70℃,既有利于反应正向进行,又能减少反应物
的挥发。温度过高,反应速率增大,但易使有机物发生炭化。
增加乙醇的用量(乙醇的沸点比乙酸低,更容易挥发而损失),
提高乙酸的转化率进而提高产率。
加入适量浓硫酸,吸收反应生成的水,使平衡正向移动;
饱和碳酸钠溶液
乙醇、乙酸、
浓硫酸
实验分析
1、浓硫酸的作用是:
3、得到的反应产物是否纯净?主要杂质有 哪些?
4、饱和Na2CO3溶液有什么作用?
催化剂、吸水剂
不纯净;主要含乙酸、乙醇。
① 中和乙酸 ② 溶解乙醇。
③ 降低酯在水中的溶解度,以便使酯分层析出。
2、试剂加入的顺序应该怎样:
无水乙醇、浓硫酸、乙酸
6、有无其它防倒吸的方法?
5、为什么导管不插入饱和Na2CO3溶液中?
防止受热不匀发生倒吸。
四、完善“醇、醛、酸、酯”的相互转化模型
思考:酒越陈越香的原因?
醇
醛
酯
羧酸
氧化(O2)
氧化
还原(H2)
(O2、酸性KMnO4溶液、溴水、
新制Cu(OH)2、Ag(NH3)2OH )
酯化反应
乙醇
乙醛
乙酸
乙酸乙酯
酸性
O
—C—O—R
=
O
—C—O—H
=
O
—C—H
=
R—O—H
O
—C—O-
=
练习1、牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸的结构简式如下,请回答下列问题。
(1)乳酸在浓H2SO4加热条件下,分别能与乙醇、乙酸发生化学反应,
请写出相应反应的化学方程式 。
HO CH
CH3
COOH
+ C2H5OH
+ H2O
△
浓硫酸
HO CH
CH3
COOC2H5
(2)写出两分子乳酸发生酯化反应脱去一分子水形成链状酯的结构简式
HO CH
CH3
COOH
+
HO CH
CH3
COOH
HO CH
CH3
C O
CH
CH3
COOH
+
H2O
O
△
浓硫酸
HO CH
CH3
COOH
CH3COOH +
+ H2O
△
浓硫酸
CH3COO
CH
CH3
COOH
(3)写出两分子乳酸发生酯化反应脱去两分子水生成环状酯的结构简式
工业上以丙酸为原料,采用氯化氨化法合成丙氨酸
在105℃和3%赤磷催化剂存在下,通入液氯进行氯化,生成2-氯丙酸,然后进入氨水溶液中,以乌洛托品为催化剂,在60℃温度下进行氨化,即生成丙氨酸。
3、羧酸的α-H取代反应(了解)
CH3-CH2-COOH+Cl2 CH3-CH-COOH+HCl
催化剂
|
Cl
α
羟基对羰基的影响,使羧基中的羰基较难发生加成反应,只有在特定条件或催化剂作用下,反应才能进行。羧酸很难通过催化加氢的方法被还原,用较强还原剂氢化铝锂能将羧酸还原为相应的醇。
4、羧酸的还原反应(了解)
R-C-O-H R-CH2OH
O
=
LiAlH4
