化学人教版(2019)选择性必修2 2.2.2 价层电子对互斥模型(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.2.2 价层电子对互斥模型(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 53.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 09:05:58 | ||
图片预览





文档简介
(共24张PPT)
价层电子互斥(VSEPR)模型
1.学会计算分子中的价电子对数和孤电子对数,并利用价电子对互斥理论模型预测分子的空间结构;2.了解价层电子对互斥理论模型,并利用该模型预测简单分子的空间结构;
3.通过价层电子对互斥理论模型培养学生模型认知的化学学科核心素养。
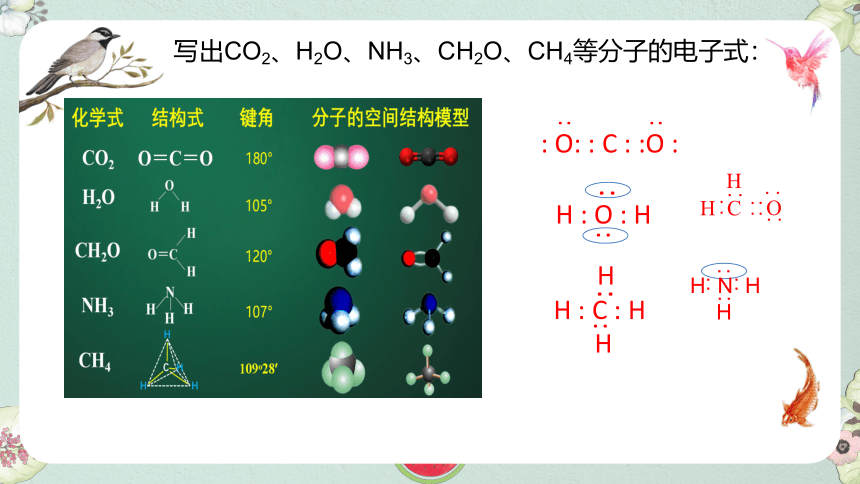
CO2和H2O同是三原子分子,CO2是直线型,而H2O是“V”型。
同为四原子分子,CH2O与 NH3 分子的空间结构也不同,什么原因?
写出CO2、H2O、NH3、CH2O、CH4等分子的电子式:
: O: : C : :O :
:
:
H : O : H
:
:
H : C : H
:
:
H
H
H
H
. .
C
. .
. .
O
. .
. .
. .
:
:
:
H N H
:
H
中心原子:对ABn型分子,B围绕A成键,则A为中心原子,
n值为中心原子结合的原子数。
分析CO2 , H2O,NH3 ,CH2O,CH4电子式的中心原子价电子层电子的成键情况:
孤对电子:未用于形成共价键的电子对
成键电子对和孤对电子对会影响分子的空间构型.
结论:
中心原子 代表物 中心原子 结合的原子数 分子类型 空间构型
无孤对电子 CO2 AB2
CH2O AB3
CH4 AB4
有孤对电子 H2O AB2
NH3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
小结:
孤对电子对分子立体结构影响较大。
2
3
4
2
3
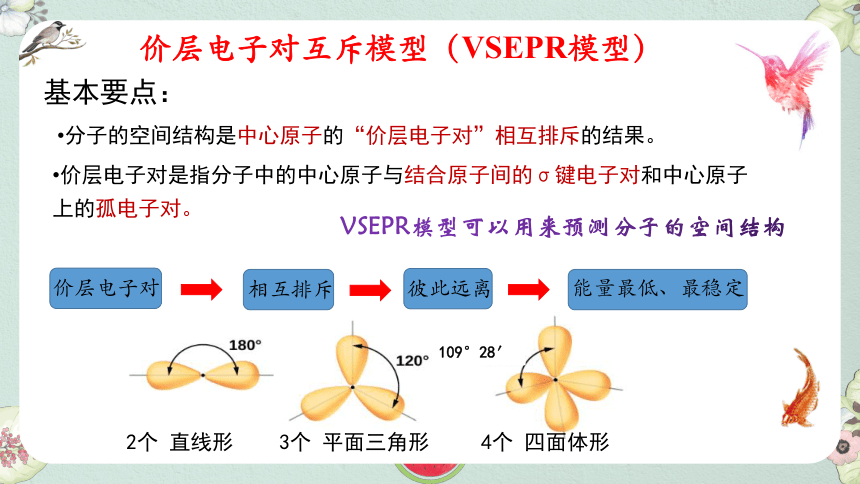
价层电子对互斥模型(VSEPR模型)
基本要点:
价层电子对是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。
价层电子对
相互排斥
彼此远离
能量最低、最稳定
分子的空间结构是中心原子的“价层电子对”相互排斥的结果。
VSEPR模型可以用来预测分子的空间结构
109°28′
2个 直线形
3个 平面三角形
4个 四面体形
(1)σ键电子对可从分子式来确定。ABn型分子,A为中心原子,B为周围与A用共价键结合的原子。n为结合的数量,也等于A与B之间结合的σ键个数,即σ键电子对的数量,π键的数目不计入在内。即σ键电子对数=中心原子结合的原子数。
例如:H2O中O的σ键电子对数是2;
NH3 中的σ键电子对数是3。
中心原子价层电子对数的确定
1)价层电子对数=σ键电子对数(x)+中心原子上的孤电子对数(y)
2) σ键电子对数(x)=中心原子所结合的原子数
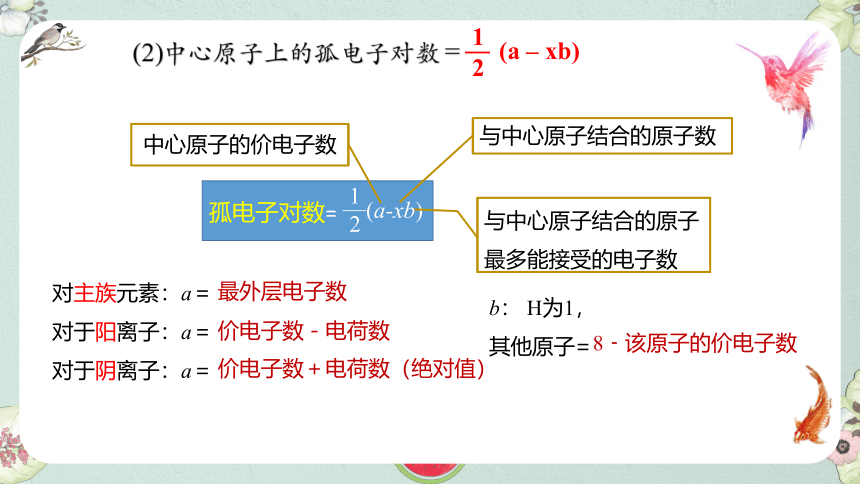
3)中心原子上的孤电子对数(y)=1/2(a-xb)
分子中A、B间无论是双键还是三键有且只有一个σ键电子对
(2)中心原子上的孤电子对数 =
—
2
1
(a – xb)
孤电子对数=
2
—
1
(a-xb)
与中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
对主族元素:a=
对于阳离子:a=
对于阴离子:a=
价电子数-电荷数
最外层电子数
价电子数+电荷数(绝对值)
b: H为1,
其他原子=
中心原子的价电子数
8﹣该原子的价电子数
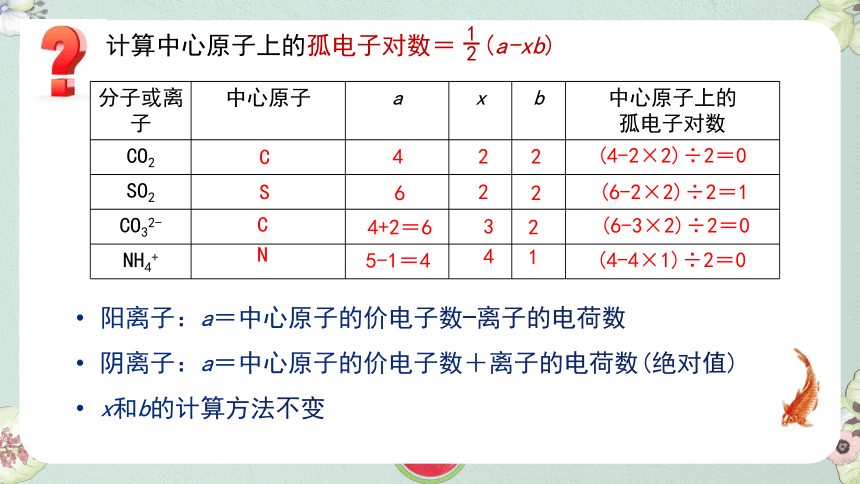
计算中心原子上的孤电子对数= (a-xb)
2
1
分子或离子 中心原子 a x b 中心原子上的
孤电子对数
CO2
SO2
CO32-
NH4+
C
4
2
2
(4-2×2)÷2=0
S
6
2
2
(6-2×2)÷2=1
(6-3×2)÷2=0
(4-4×1)÷2=0
C
4+2=6
3
2
N
5-1=4
4
1
阳离子:a=中心原子的价电子数-离子的电荷数
阴离子:a=中心原子的价电子数+离子的电荷数(绝对值)
x和b的计算方法不变
分子或离子 孤电子对数 价层电子对数 VSEPR理想模型 VSEPR理想模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2 0
SO2 1
CO32- 0
NH4+ 0
0+4=4
0+3=3
1+2=3
0+2=2
直线形
平面
三角形
平面
三角形
正四
面体形
正四
面体形
平面
三角形
直线形
V形
分子 或离子 中心原子 孤电子对数 价层电子对数 VSEPR理想模型 分子的
空间结构
HC≡N
O3
NF3
CHCl3
平面三角形
V形
(6-2×2)÷2=1
1+2=3
(4-1×1-1×3)÷2=0
0+2=2
直线形
直线形
O(O)2
四面体形
三角锥形
(5-3×1)÷2=1
1+3=4
四面体
(4-3×1-1×1)÷2=0
4+0=4
四面体形
代表物 σ键 电子对数 孤电子 对数 价层电子对数 含孤电子对的VSEPR模型 分子的空间结构
H2O
NH3
CH4
2
2
4
3
1
4
4
0
4
“V”形
三角锥形
正四面体形
HCHO
平面三角形
直线形
3
0
3
2
0
2
平面三角形
直线形
BeCl2
归纳
1)中心原子上无孤对电子的分子:VSEPR模型就是其分子的立体结构。
2)中心原子上存在孤对电子的分子:先由价层电子对数得出含有孤对电子的价层电子对互斥模型,然后略去孤对电子在价层电子对互斥模型占有的空间,剩下的就是分子的立体结构。
价层电子对互斥模型的两种类型
由于孤电子对有较大斥力,含孤电子对的分子的实测键角几乎都小于VSEPR模型的预测值。
1.试解释CH4键角(109°28′)、NH3键角(107°)、H2O键角(105°)依次减小的原因。
提示 CH4分子中的C原子没有孤电子对,NH3分子中N原子上有1对孤电子对,H2O分子中O原子上有2对孤电子对,对成键电子对的排斥作用增大,故键角减小。
2.解释BF3分子的空间结构是平面三角形而NF3分子的空间结构是三角锥形?
BF3分子中B原子的3个价电子都与F原子形成共价键,而NF3分子中N原子的3个价电子与F原子形成共价键,还有一对未成键的电子对,占据了N原子周围的空间,参与相互排斥,形成三角锥形
(1)孤电子对对成键电子对的排斥作用,孤电子对越多,排斥力越大,键角越小
(2)价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子。
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
价层电子对互斥(VSEPR)模型
价层电子对数:2
价层电子对数:3
价层电子对数:4
价层电子对数:5
价层电子对数:6
三角双锥形
八面体形
直线形
平面三角形
正四面体形
VSEPR模型预测分子空间结构的步骤
1.计算中心原子的成键电子对数=结合原子数
2.计算中心原子上的孤电子对数
3.价层电子对数=σ键电子对数+孤电子对数
4.确定VSEPR理想模型
5.略去孤电子对,确定分子的空间结构
价层电子对数 VSEPR
理想模型
2 直线形
3 平面三角形
4 正四面体形
教材P51题8
价层电子对互斥模型
略去孤电子
价层电子对数
σ键电子对数
中心原子上的
孤电子对数
+
分子(或离子)的空间结构
课堂 小 结
AB2型分子:直线形或V形
价层电子对
互斥模型
价层电子对互斥模型
价层电子对互斥模型
的应用——预测分子(或离子)空间结构
价层电子对数为=σ键电子对数+孤电子对数
价层电子对相互排斥,趋于尽可能远离而减小斥力
价层电子对数为2时:直线形
价层电子对数为3时:平面三角形、V形
价层电子对数为4时:四面体形、三角锥形、V形
价层电子对数为5时:常见三角双锥形
价层电子对数为6时:正八面体形、平面四边形
分子尽可能采取对称的空间结构
步骤:价层电子对数→ VSEPR模型→空间结构
AB3型分子:平面三角形或三角锥形
AB4型分子:常见四面体形
分子(或离子)
空间结构
巩固练习
(1)分子的VSEPR模型和相应分子的空间结构是相同的( )
(2)所有的三原子分子都是直线形结构( )
(3)SO2与CO2的分子组成相似,故它们分子的空间结构相同( )
(4)由价层电子对互斥模型可知SnBr2分子中Sn—Br的键角小于180°( )
(5)根据价层电子对互斥模型可以判断H3O+与NH3的分子(或离子)的空间结构一致( )
判断正误
×
×
×
√
√
σ键电子对数 孤电子对数 空间结构
1.用价层电子对互斥模型完成下列问题(点“·”的原子为中心原子)。
2 2 V形
3 0 平面三角形
3 1 三角锥形
2 1 V形
4 0 正四面体形
2 2 V形
2 2 V形
2.有X、Y两种活性反应中间体微粒,均含有1个碳原子和3个氢原子,其
球棍模型如图所示: , 。下列说法错误的是
A.X的组成为 B.Y的组成为
C.X的价层电子对数为4 D.Y中键角小于120°
√
平面三角形
三角锥形
3.短周期主族元素A、B可形成AB3分子,下列有关叙述正确的是
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子可能为平面正三角形
C.若A、B为同一主族元素,则AB3分子一定为三角锥形
D.若AB3分子为三角锥形,则AB3分子一定为NH3
√
4.下列说法中正确的是
A.NO2、BF3、NCl3分子中没有一个分子中原子的最外电子层都满足了8
电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C. 的电子式为 ,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
√
D
平面三角形
三角锥形
价层电子互斥(VSEPR)模型
1.学会计算分子中的价电子对数和孤电子对数,并利用价电子对互斥理论模型预测分子的空间结构;2.了解价层电子对互斥理论模型,并利用该模型预测简单分子的空间结构;
3.通过价层电子对互斥理论模型培养学生模型认知的化学学科核心素养。
CO2和H2O同是三原子分子,CO2是直线型,而H2O是“V”型。
同为四原子分子,CH2O与 NH3 分子的空间结构也不同,什么原因?
写出CO2、H2O、NH3、CH2O、CH4等分子的电子式:
: O: : C : :O :
:
:
H : O : H
:
:
H : C : H
:
:
H
H
H
H
. .
C
. .
. .
O
. .
. .
. .
:
:
:
H N H
:
H
中心原子:对ABn型分子,B围绕A成键,则A为中心原子,
n值为中心原子结合的原子数。
分析CO2 , H2O,NH3 ,CH2O,CH4电子式的中心原子价电子层电子的成键情况:
孤对电子:未用于形成共价键的电子对
成键电子对和孤对电子对会影响分子的空间构型.
结论:
中心原子 代表物 中心原子 结合的原子数 分子类型 空间构型
无孤对电子 CO2 AB2
CH2O AB3
CH4 AB4
有孤对电子 H2O AB2
NH3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
小结:
孤对电子对分子立体结构影响较大。
2
3
4
2
3
价层电子对互斥模型(VSEPR模型)
基本要点:
价层电子对是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。
价层电子对
相互排斥
彼此远离
能量最低、最稳定
分子的空间结构是中心原子的“价层电子对”相互排斥的结果。
VSEPR模型可以用来预测分子的空间结构
109°28′
2个 直线形
3个 平面三角形
4个 四面体形
(1)σ键电子对可从分子式来确定。ABn型分子,A为中心原子,B为周围与A用共价键结合的原子。n为结合的数量,也等于A与B之间结合的σ键个数,即σ键电子对的数量,π键的数目不计入在内。即σ键电子对数=中心原子结合的原子数。
例如:H2O中O的σ键电子对数是2;
NH3 中的σ键电子对数是3。
中心原子价层电子对数的确定
1)价层电子对数=σ键电子对数(x)+中心原子上的孤电子对数(y)
2) σ键电子对数(x)=中心原子所结合的原子数
3)中心原子上的孤电子对数(y)=1/2(a-xb)
分子中A、B间无论是双键还是三键有且只有一个σ键电子对
(2)中心原子上的孤电子对数 =
—
2
1
(a – xb)
孤电子对数=
2
—
1
(a-xb)
与中心原子结合的原子数
与中心原子结合的原子最多能接受的电子数
对主族元素:a=
对于阳离子:a=
对于阴离子:a=
价电子数-电荷数
最外层电子数
价电子数+电荷数(绝对值)
b: H为1,
其他原子=
中心原子的价电子数
8﹣该原子的价电子数
计算中心原子上的孤电子对数= (a-xb)
2
1
分子或离子 中心原子 a x b 中心原子上的
孤电子对数
CO2
SO2
CO32-
NH4+
C
4
2
2
(4-2×2)÷2=0
S
6
2
2
(6-2×2)÷2=1
(6-3×2)÷2=0
(4-4×1)÷2=0
C
4+2=6
3
2
N
5-1=4
4
1
阳离子:a=中心原子的价电子数-离子的电荷数
阴离子:a=中心原子的价电子数+离子的电荷数(绝对值)
x和b的计算方法不变
分子或离子 孤电子对数 价层电子对数 VSEPR理想模型 VSEPR理想模型名称 分子或离子的空间结构 分子或离子的空间结构名称
CO2 0
SO2 1
CO32- 0
NH4+ 0
0+4=4
0+3=3
1+2=3
0+2=2
直线形
平面
三角形
平面
三角形
正四
面体形
正四
面体形
平面
三角形
直线形
V形
分子 或离子 中心原子 孤电子对数 价层电子对数 VSEPR理想模型 分子的
空间结构
HC≡N
O3
NF3
CHCl3
平面三角形
V形
(6-2×2)÷2=1
1+2=3
(4-1×1-1×3)÷2=0
0+2=2
直线形
直线形
O(O)2
四面体形
三角锥形
(5-3×1)÷2=1
1+3=4
四面体
(4-3×1-1×1)÷2=0
4+0=4
四面体形
代表物 σ键 电子对数 孤电子 对数 价层电子对数 含孤电子对的VSEPR模型 分子的空间结构
H2O
NH3
CH4
2
2
4
3
1
4
4
0
4
“V”形
三角锥形
正四面体形
HCHO
平面三角形
直线形
3
0
3
2
0
2
平面三角形
直线形
BeCl2
归纳
1)中心原子上无孤对电子的分子:VSEPR模型就是其分子的立体结构。
2)中心原子上存在孤对电子的分子:先由价层电子对数得出含有孤对电子的价层电子对互斥模型,然后略去孤对电子在价层电子对互斥模型占有的空间,剩下的就是分子的立体结构。
价层电子对互斥模型的两种类型
由于孤电子对有较大斥力,含孤电子对的分子的实测键角几乎都小于VSEPR模型的预测值。
1.试解释CH4键角(109°28′)、NH3键角(107°)、H2O键角(105°)依次减小的原因。
提示 CH4分子中的C原子没有孤电子对,NH3分子中N原子上有1对孤电子对,H2O分子中O原子上有2对孤电子对,对成键电子对的排斥作用增大,故键角减小。
2.解释BF3分子的空间结构是平面三角形而NF3分子的空间结构是三角锥形?
BF3分子中B原子的3个价电子都与F原子形成共价键,而NF3分子中N原子的3个价电子与F原子形成共价键,还有一对未成键的电子对,占据了N原子周围的空间,参与相互排斥,形成三角锥形
(1)孤电子对对成键电子对的排斥作用,孤电子对越多,排斥力越大,键角越小
(2)价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子。
价层电子对之间相互排斥作用大小的一般规律:
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。
价层电子对互斥(VSEPR)模型
价层电子对数:2
价层电子对数:3
价层电子对数:4
价层电子对数:5
价层电子对数:6
三角双锥形
八面体形
直线形
平面三角形
正四面体形
VSEPR模型预测分子空间结构的步骤
1.计算中心原子的成键电子对数=结合原子数
2.计算中心原子上的孤电子对数
3.价层电子对数=σ键电子对数+孤电子对数
4.确定VSEPR理想模型
5.略去孤电子对,确定分子的空间结构
价层电子对数 VSEPR
理想模型
2 直线形
3 平面三角形
4 正四面体形
教材P51题8
价层电子对互斥模型
略去孤电子
价层电子对数
σ键电子对数
中心原子上的
孤电子对数
+
分子(或离子)的空间结构
课堂 小 结
AB2型分子:直线形或V形
价层电子对
互斥模型
价层电子对互斥模型
价层电子对互斥模型
的应用——预测分子(或离子)空间结构
价层电子对数为=σ键电子对数+孤电子对数
价层电子对相互排斥,趋于尽可能远离而减小斥力
价层电子对数为2时:直线形
价层电子对数为3时:平面三角形、V形
价层电子对数为4时:四面体形、三角锥形、V形
价层电子对数为5时:常见三角双锥形
价层电子对数为6时:正八面体形、平面四边形
分子尽可能采取对称的空间结构
步骤:价层电子对数→ VSEPR模型→空间结构
AB3型分子:平面三角形或三角锥形
AB4型分子:常见四面体形
分子(或离子)
空间结构
巩固练习
(1)分子的VSEPR模型和相应分子的空间结构是相同的( )
(2)所有的三原子分子都是直线形结构( )
(3)SO2与CO2的分子组成相似,故它们分子的空间结构相同( )
(4)由价层电子对互斥模型可知SnBr2分子中Sn—Br的键角小于180°( )
(5)根据价层电子对互斥模型可以判断H3O+与NH3的分子(或离子)的空间结构一致( )
判断正误
×
×
×
√
√
σ键电子对数 孤电子对数 空间结构
1.用价层电子对互斥模型完成下列问题(点“·”的原子为中心原子)。
2 2 V形
3 0 平面三角形
3 1 三角锥形
2 1 V形
4 0 正四面体形
2 2 V形
2 2 V形
2.有X、Y两种活性反应中间体微粒,均含有1个碳原子和3个氢原子,其
球棍模型如图所示: , 。下列说法错误的是
A.X的组成为 B.Y的组成为
C.X的价层电子对数为4 D.Y中键角小于120°
√
平面三角形
三角锥形
3.短周期主族元素A、B可形成AB3分子,下列有关叙述正确的是
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子可能为平面正三角形
C.若A、B为同一主族元素,则AB3分子一定为三角锥形
D.若AB3分子为三角锥形,则AB3分子一定为NH3
√
4.下列说法中正确的是
A.NO2、BF3、NCl3分子中没有一个分子中原子的最外电子层都满足了8
电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C. 的电子式为 ,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
√
D
平面三角形
三角锥形
