江西省宜丰县中2022-2023学年高一上学期2月期末考试化学试卷(含答案)
文档属性
| 名称 | 江西省宜丰县中2022-2023学年高一上学期2月期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 135.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 09:12:36 | ||
图片预览

文档简介
宜丰县中2022-2023学年高一上学期2月期末考试
化学试卷
可能用到的相对原子质量有:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5
一.选择题(1-14为单选,15-17为双选,每小题3分,共51分)
1.化学与生活紧密相关,下列有关说法不正确的是( )
A.重庆素有雾都之称,雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
B.FeSO4作补血剂时可与维生素C同时服用
C.生铁的含碳量比钢的含碳量高,合金的熔点一般比其成分金属的熔点高
D.漂白粉可用于漂白棉、麻、纸张等,其长期露置在空气中会失效
2.对下列各组物质的分类正确的是( )
A.混合物:钢铁、氯水、冰水混合物 B.电解质:胆矾、氯化氢、氨水
C.酸性氧化物:二氧化硫、氧化铝、干冰 D.非电解质:乙醇、四氯化碳、一氧化碳
3.根据元素周期律和周期表,下列推断不合理的是( )
A.第83号元素的最高化合价是+5 B.第53号元素的单质在常温常压下是固体
C.第Ⅷ族含8、9、10 三列共12种元素,为含元素种类最多的族
D.32号元素的单质可作半导体,其同主族的某种元素的同位素可用作考古断代
4.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.强酸性溶液中:K+、Fe2+、NO3-、SO42-
B.能使酚酞变红的溶液中:Na+、Fe3+、Cl-、HCO3-
C.含有0.1mol/L AgNO3溶液中:NH4+、Mg2+、SO42-、CO32-
D.澄清透明的溶液中:Cu2+、Na+、NO3-、SO42-
5.下列说法错误的是( )
A.图I:若MnO2过量,则浓盐酸就可全部消耗
B.图Ⅱ:可利用该装置制备Fe(OH)2并较长时间保持颜色不变
C.图Ⅲ:可利用该实验直接观察纯碱中钠元素的焰色反应
D.图Ⅳ:利用该实验装置可证明起漂白作用的不是Cl2
6.下列除杂的方法(括号里为少量杂质)中,所用试剂或操作不正确的是( )
A.NaHCO3溶液(Na2CO3):通入过量的CO2
B.Fe2O3(Al2O3):加入NaOH溶液再过滤
C.FeCl3溶液(FeCl2):通入足量的氯气
D.CO2(HCl):将气体通过盛有饱和Na2CO3溶液的洗气瓶
7.甲、乙两烧杯中各盛有100mL3mol·L-1的硫酸和氢氧化钠溶液。向两烧杯中分别加入等质量的铝粉,反应结束后生成的气体的体积比为甲:乙=3:4,则加入铝粉的质量为( )
A.3.6g B.5.4g C.7.2g D.10.8g
8.下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:
B.用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+
C.Ca(HCO3)2溶液与少量NaOH溶液反应:
D.Na2O2溶于水产生O2:
9.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论正确的是( )
A.由“Cl2+H2O=HCl+HClO”反应可推出“F2+H2O=HF+HFO”反应也能发生
B.SO3可以和BaCl2反应生成BaSO4,CO2也可以与BaCl2反应生成BaCO3
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
10.下列叙述正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同 ②常温常压下,1gH2和14gN2的体积相同
③28gCO的体积为22.4L ④同温同压下,气体的密度与气体的摩尔质量成正比
⑤2molH2SO4分子的摩尔质量是196g/mol
A.①③④ B.②④ C.③⑤ D.①②③④⑤
11.已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O和未知物X。Na2SO3是其中的反应物之一。下列说法不正确的是( )
A.该未知物X为Na2SO4 B.该反应的氧化剂是KIO3
C.由反应可知还原性强弱顺序为:Na2SO3>I2 D.该反应中,发生氧化反应的过程是KIO3→I2
12.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Y>Z>Q
B.W、Y、Z三种元素可形成离子化合物
C.该化合物中Y原子不满足8电子稳定结构
D.Y的氧化物对应的水化物均为强酸
13.金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化不能全部通过一步反应直接完成的是( )
A.Al→Al2O3→Al(OH)3→AlCl3 B.Na→NaOH→Na2CO3→NaCl
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
14.将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.钠和氯化铝溶液 B.铝和烧碱溶液 C.过氧化钠和氯化亚铁 D.锌和稀硫酸
15.几种短周期元素的原子半径及某些化合价见表:
元素代号 A B D E G H I J
化合价 -1 -2 +4、-4 -1 +5、-3 +3 +2 +1
原子半径/nm 0.071 0.074 0.077 0.099 0.110 0.143 0.160 0.186
分析判断下列说法正确的是( )
A.D、H、J的氧化物分别为酸性氧化物、两性氧化物、碱性氧化物
B.A、H、J的离子半径由大到小的顺序是A>J>H
C.D元素的单质存在多种同素异形体
D.I在DB2中燃烧生成两种化合物
16.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含0.1 mol/LBaCl2的溶液中Cl-数为0.2NA
B.0.1 mol Na2O2与足量的水反应,转移电子的数目为0.1NA
C.0.1 mol Fe和0.1 mol Cl2在点燃条件下反应时转移电子数目为0.3NA
D.44gN2O和CO2组成的混合气体中含有的原子数为3NA
17.某学生配制了100 mL 1mol·L-1的硫酸,然后对溶液浓度做精确测定,且测定过程中一切操作都正确,但测得溶液的物质的量浓度小于1mol·L-1。则下列操作可能导致溶液浓度偏低的是( )
A.量取浓硫酸量筒倒出浓硫酸后,用蒸馏水冲洗,冲洗液也转移到容量瓶中
B.将浓硫酸在烧杯中稀释,立即转移到100 mL的容量瓶中后
C.在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
D.最后颠倒摇匀后,发现液面低于了刻度线,马上用胶头滴管加水至溶液凹液面刚好与刻度线相切
二.填空题(除特别说明外,每空2分,共49分)
18.Ⅰ.现有以下物质:①NaCl固体 ②盐酸 ③Ba(OH)2溶液 ④铜 ⑤CO2 ⑥硫酸氢钾固体
⑦乙醇(C2H5OH) ⑧CuSO4·H2O晶体 ⑨熔融态BaSO4 ⑩液氨,请回答下列问题(用序号):
能导电的是_______________,属于电解质的是________________,属于非电解质的是_______________。
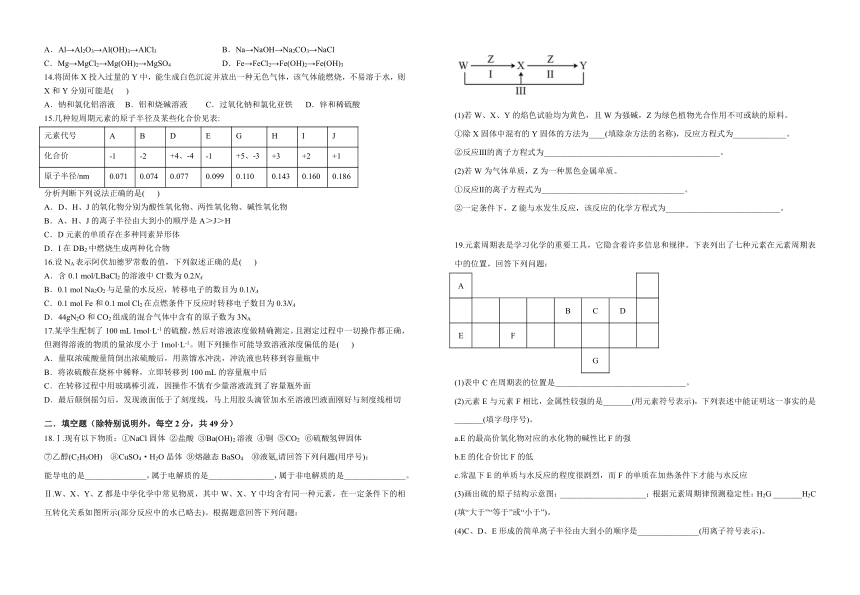
Ⅱ.W、X、Y、Z都是中学化学中常见物质,其中W、X、Y中均含有同一种元素,在一定条件下的相互转化关系如图所示(部分反应中的水已略去)。根据题意回答下列问题:
(1)若W、X、Y的焰色试验均为黄色,且W为强碱,Z为绿色植物光合作用不可或缺的原料。
①除X固体中混有的Y固体的方法为____(填除杂方法的名称),反应方程式为_____________。
②反应Ⅲ的离子方程式为___________________________________________。
(2)若W为气体单质,Z为一种黑色金属单质。
①反应Ⅱ的离子方程式为___________________________________。
②一定条件下,Z能与水发生反应,该反应的化学方程式为____________________________。
19.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表列出了七种元素在元素周期表中的位置,回答下列问题:
A
B C D
E F
G
(1)表中C在周期表的位置是________________________________。
(2)元素E与元素F相比,金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是_______(填字母序号)。
a.E的最高价氧化物对应的水化物的碱性比F的强
b.E的化合价比F的低
c.常温下E的单质与水反应的程度很剧烈,而F的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:_____________________;根据元素周期律预测稳定性:H2G _______H2C (填“大于”“等于”或“小于”)。
(4)C、D、E形成的简单离子半径由大到小的顺序是_______________(用离子符号表示)。
20.铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图:
(1)溶液A中含的阳离子主要有_____________.
(2)写出步骤Ⅲ通入过量的CO2时发生的离子方程式_________________________________,步骤I、II、III都要用到的分离方法是________.
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有________(填化学式).
(4)设计检验滤液A中是否含Fe3+的操作为_________________________________________________;
(5)现有102t含氧化铝50%的铝土矿,经上述流程最终得金属铝20t,则产率为___________.
21. ClO2又称百毒净,可用于水的净化和纸张、纺织品的漂白.用如图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。
回答下列问题:
(1)仪器a的名称为____________。
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为________________。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的_______性.若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______。
(4)D装置的作用是_____________。
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的_______倍(结果保留两位小数)
宜丰县中2022-2023学年高一上学期2月期末考试
化学答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
C D C D A D C C D B D B A A BC BD CD
18.【答案】 Ⅰ. ②③④⑨ ①⑥⑧⑨ ⑤⑦⑩
Ⅱ. (1) 加热(1分) 2NaHCO3Na2CO3+CO2↑+H2O HCO3-+OH-=CO32-+H2O
(2) Fe+2Fe3+=3Fe2+ 4H2O(g)+3FeFe3O4+4H2
19.【答案】(1) 第二周期第ⅥA族 (2) Na ac
(3) 小于 (4)
20.【答案】 (1) Al3+、Fe3+、H+
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 过滤 (3)CO2、NaOH
(4)可取少量滤液A滴加KSCN溶液,若溶液显红色则有Fe3+,否则无Fe3+ (5)74.1%
21.【答案】(1)分液漏斗(1分) (2)
(3) 还原(1分) 红色布条褪色 (4) 尾气处理 (5)1.57
答案第1页,共2页
化学试卷
可能用到的相对原子质量有:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5
一.选择题(1-14为单选,15-17为双选,每小题3分,共51分)
1.化学与生活紧密相关,下列有关说法不正确的是( )
A.重庆素有雾都之称,雾是一种气溶胶,光束透过大雾可观察到丁达尔效应
B.FeSO4作补血剂时可与维生素C同时服用
C.生铁的含碳量比钢的含碳量高,合金的熔点一般比其成分金属的熔点高
D.漂白粉可用于漂白棉、麻、纸张等,其长期露置在空气中会失效
2.对下列各组物质的分类正确的是( )
A.混合物:钢铁、氯水、冰水混合物 B.电解质:胆矾、氯化氢、氨水
C.酸性氧化物:二氧化硫、氧化铝、干冰 D.非电解质:乙醇、四氯化碳、一氧化碳
3.根据元素周期律和周期表,下列推断不合理的是( )
A.第83号元素的最高化合价是+5 B.第53号元素的单质在常温常压下是固体
C.第Ⅷ族含8、9、10 三列共12种元素,为含元素种类最多的族
D.32号元素的单质可作半导体,其同主族的某种元素的同位素可用作考古断代
4.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.强酸性溶液中:K+、Fe2+、NO3-、SO42-
B.能使酚酞变红的溶液中:Na+、Fe3+、Cl-、HCO3-
C.含有0.1mol/L AgNO3溶液中:NH4+、Mg2+、SO42-、CO32-
D.澄清透明的溶液中:Cu2+、Na+、NO3-、SO42-
5.下列说法错误的是( )
A.图I:若MnO2过量,则浓盐酸就可全部消耗
B.图Ⅱ:可利用该装置制备Fe(OH)2并较长时间保持颜色不变
C.图Ⅲ:可利用该实验直接观察纯碱中钠元素的焰色反应
D.图Ⅳ:利用该实验装置可证明起漂白作用的不是Cl2
6.下列除杂的方法(括号里为少量杂质)中,所用试剂或操作不正确的是( )
A.NaHCO3溶液(Na2CO3):通入过量的CO2
B.Fe2O3(Al2O3):加入NaOH溶液再过滤
C.FeCl3溶液(FeCl2):通入足量的氯气
D.CO2(HCl):将气体通过盛有饱和Na2CO3溶液的洗气瓶
7.甲、乙两烧杯中各盛有100mL3mol·L-1的硫酸和氢氧化钠溶液。向两烧杯中分别加入等质量的铝粉,反应结束后生成的气体的体积比为甲:乙=3:4,则加入铝粉的质量为( )
A.3.6g B.5.4g C.7.2g D.10.8g
8.下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:
B.用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+
C.Ca(HCO3)2溶液与少量NaOH溶液反应:
D.Na2O2溶于水产生O2:
9.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论正确的是( )
A.由“Cl2+H2O=HCl+HClO”反应可推出“F2+H2O=HF+HFO”反应也能发生
B.SO3可以和BaCl2反应生成BaSO4,CO2也可以与BaCl2反应生成BaCO3
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
10.下列叙述正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同 ②常温常压下,1gH2和14gN2的体积相同
③28gCO的体积为22.4L ④同温同压下,气体的密度与气体的摩尔质量成正比
⑤2molH2SO4分子的摩尔质量是196g/mol
A.①③④ B.②④ C.③⑤ D.①②③④⑤
11.已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O和未知物X。Na2SO3是其中的反应物之一。下列说法不正确的是( )
A.该未知物X为Na2SO4 B.该反应的氧化剂是KIO3
C.由反应可知还原性强弱顺序为:Na2SO3>I2 D.该反应中,发生氧化反应的过程是KIO3→I2
12.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Y>Z>Q
B.W、Y、Z三种元素可形成离子化合物
C.该化合物中Y原子不满足8电子稳定结构
D.Y的氧化物对应的水化物均为强酸
13.金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化不能全部通过一步反应直接完成的是( )
A.Al→Al2O3→Al(OH)3→AlCl3 B.Na→NaOH→Na2CO3→NaCl
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
14.将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.钠和氯化铝溶液 B.铝和烧碱溶液 C.过氧化钠和氯化亚铁 D.锌和稀硫酸
15.几种短周期元素的原子半径及某些化合价见表:
元素代号 A B D E G H I J
化合价 -1 -2 +4、-4 -1 +5、-3 +3 +2 +1
原子半径/nm 0.071 0.074 0.077 0.099 0.110 0.143 0.160 0.186
分析判断下列说法正确的是( )
A.D、H、J的氧化物分别为酸性氧化物、两性氧化物、碱性氧化物
B.A、H、J的离子半径由大到小的顺序是A>J>H
C.D元素的单质存在多种同素异形体
D.I在DB2中燃烧生成两种化合物
16.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含0.1 mol/LBaCl2的溶液中Cl-数为0.2NA
B.0.1 mol Na2O2与足量的水反应,转移电子的数目为0.1NA
C.0.1 mol Fe和0.1 mol Cl2在点燃条件下反应时转移电子数目为0.3NA
D.44gN2O和CO2组成的混合气体中含有的原子数为3NA
17.某学生配制了100 mL 1mol·L-1的硫酸,然后对溶液浓度做精确测定,且测定过程中一切操作都正确,但测得溶液的物质的量浓度小于1mol·L-1。则下列操作可能导致溶液浓度偏低的是( )
A.量取浓硫酸量筒倒出浓硫酸后,用蒸馏水冲洗,冲洗液也转移到容量瓶中
B.将浓硫酸在烧杯中稀释,立即转移到100 mL的容量瓶中后
C.在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
D.最后颠倒摇匀后,发现液面低于了刻度线,马上用胶头滴管加水至溶液凹液面刚好与刻度线相切
二.填空题(除特别说明外,每空2分,共49分)
18.Ⅰ.现有以下物质:①NaCl固体 ②盐酸 ③Ba(OH)2溶液 ④铜 ⑤CO2 ⑥硫酸氢钾固体
⑦乙醇(C2H5OH) ⑧CuSO4·H2O晶体 ⑨熔融态BaSO4 ⑩液氨,请回答下列问题(用序号):
能导电的是_______________,属于电解质的是________________,属于非电解质的是_______________。
Ⅱ.W、X、Y、Z都是中学化学中常见物质,其中W、X、Y中均含有同一种元素,在一定条件下的相互转化关系如图所示(部分反应中的水已略去)。根据题意回答下列问题:
(1)若W、X、Y的焰色试验均为黄色,且W为强碱,Z为绿色植物光合作用不可或缺的原料。
①除X固体中混有的Y固体的方法为____(填除杂方法的名称),反应方程式为_____________。
②反应Ⅲ的离子方程式为___________________________________________。
(2)若W为气体单质,Z为一种黑色金属单质。
①反应Ⅱ的离子方程式为___________________________________。
②一定条件下,Z能与水发生反应,该反应的化学方程式为____________________________。
19.元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表列出了七种元素在元素周期表中的位置,回答下列问题:
A
B C D
E F
G
(1)表中C在周期表的位置是________________________________。
(2)元素E与元素F相比,金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是_______(填字母序号)。
a.E的最高价氧化物对应的水化物的碱性比F的强
b.E的化合价比F的低
c.常温下E的单质与水反应的程度很剧烈,而F的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:_____________________;根据元素周期律预测稳定性:H2G _______H2C (填“大于”“等于”或“小于”)。
(4)C、D、E形成的简单离子半径由大到小的顺序是_______________(用离子符号表示)。
20.铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图:
(1)溶液A中含的阳离子主要有_____________.
(2)写出步骤Ⅲ通入过量的CO2时发生的离子方程式_________________________________,步骤I、II、III都要用到的分离方法是________.
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有________(填化学式).
(4)设计检验滤液A中是否含Fe3+的操作为_________________________________________________;
(5)现有102t含氧化铝50%的铝土矿,经上述流程最终得金属铝20t,则产率为___________.
21. ClO2又称百毒净,可用于水的净化和纸张、纺织品的漂白.用如图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。
回答下列问题:
(1)仪器a的名称为____________。
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为________________。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的_______性.若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______。
(4)D装置的作用是_____________。
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的_______倍(结果保留两位小数)
宜丰县中2022-2023学年高一上学期2月期末考试
化学答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
C D C D A D C C D B D B A A BC BD CD
18.【答案】 Ⅰ. ②③④⑨ ①⑥⑧⑨ ⑤⑦⑩
Ⅱ. (1) 加热(1分) 2NaHCO3Na2CO3+CO2↑+H2O HCO3-+OH-=CO32-+H2O
(2) Fe+2Fe3+=3Fe2+ 4H2O(g)+3FeFe3O4+4H2
19.【答案】(1) 第二周期第ⅥA族 (2) Na ac
(3) 小于 (4)
20.【答案】 (1) Al3+、Fe3+、H+
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 过滤 (3)CO2、NaOH
(4)可取少量滤液A滴加KSCN溶液,若溶液显红色则有Fe3+,否则无Fe3+ (5)74.1%
21.【答案】(1)分液漏斗(1分) (2)
(3) 还原(1分) 红色布条褪色 (4) 尾气处理 (5)1.57
答案第1页,共2页
同课章节目录
