1.1.3.原子结构课件(共16张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.3.原子结构课件(共16张PPT)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 575.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 00:00:00 | ||
图片预览



文档简介
(共16张PPT)
第一章 原子结构与性质
第一节 原子结构
第3课时
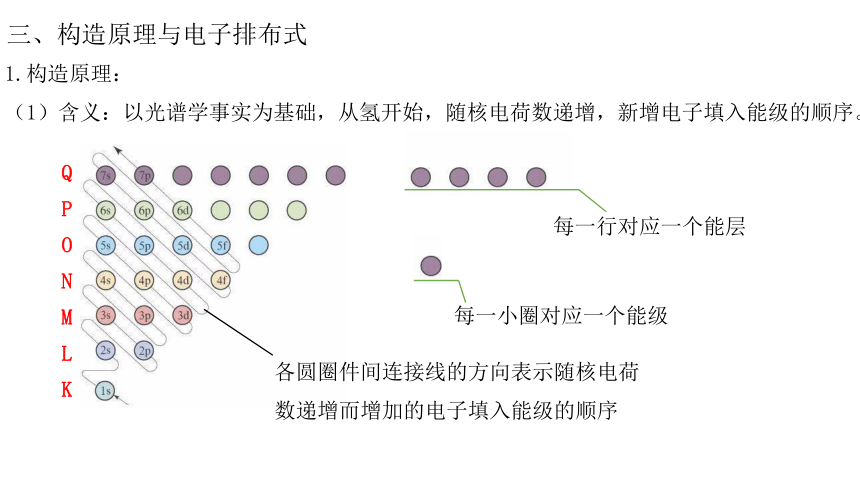
三、构造原理与电子排布式
1.构造原理:
(1)含义:以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序。
每一行对应一个能层
每一小圈对应一个能级
各圆圈件间连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序
QPONMLK
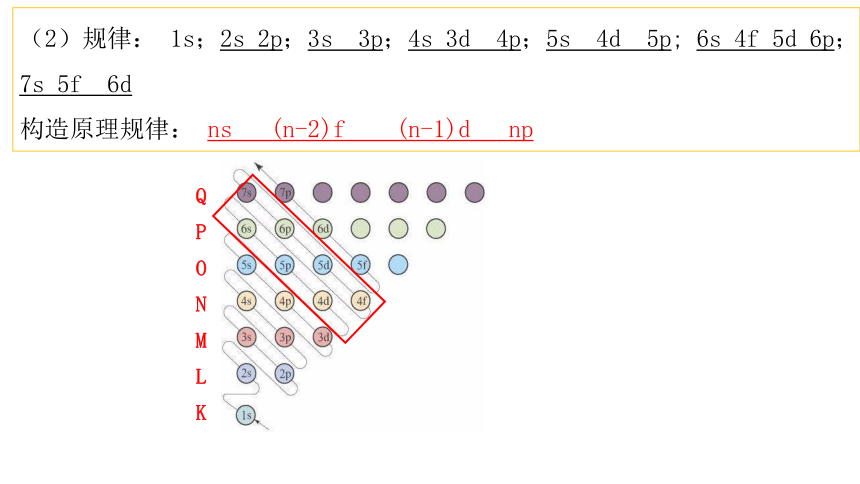
(2)规律: 1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
构造原理规律: ns (n-2)f (n-1)d np
QPONMLK
2、电子排布式
(1)理论依据:构造原理
①元素核电荷数每递增一个,同时增加一个核电荷和核外电子,就得到一个
基态原子的电子排布。
②电子填满一个能级,就开始填入下一个能级。
从氢到碳的基态原子电子排布式如下:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢 → 氦 → 锂 → 铍 → 硼 → 碳
(2)表示:用数字在能级符号右上角表明该能级上的排布的电子数。
练习1.书写下列元素基态原子的电子排布式
1s22s22p63s23p63d14s2
1s22s22p63s23p64s23d1 ×
书写21号钪(Sc)的基态原子电子排布式:
书写19号钾(K)的基态原子电子排布式:
1s22s22p63s23p64s1
注意:填充顺序以构造原理为指导书写顺序:能层低的能级写左
填充顺序不是书写顺序!
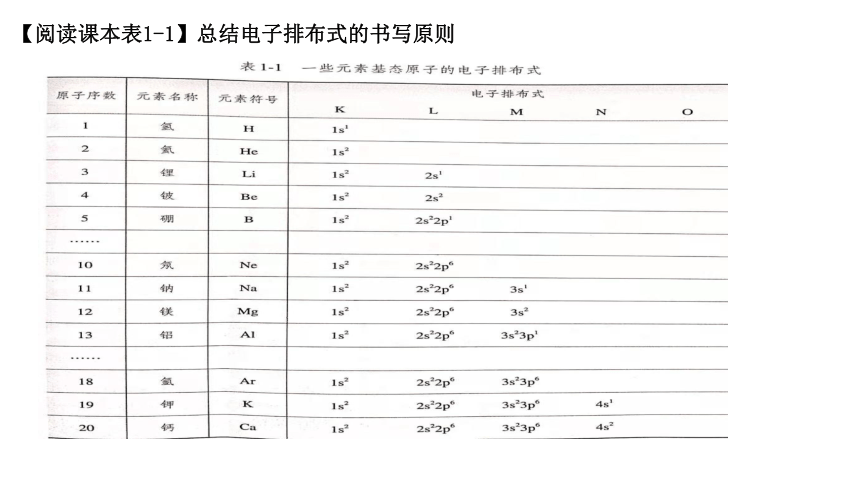
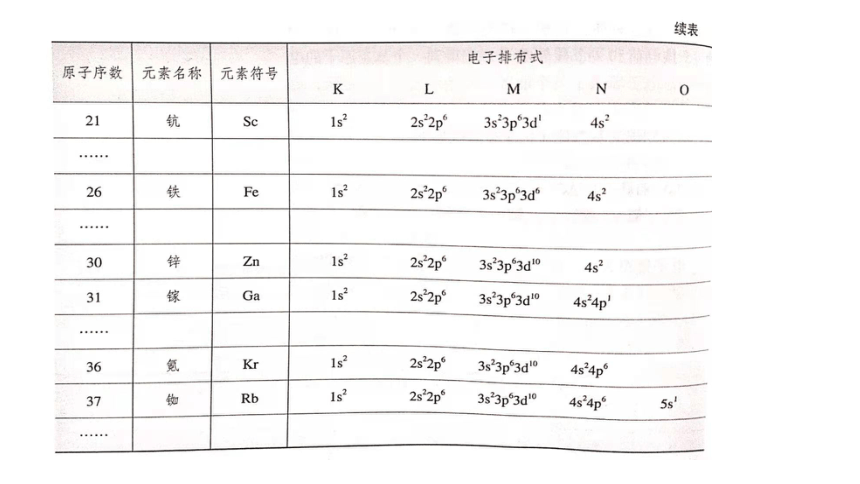
【阅读课本表1-1】总结电子排布式的书写原则
(3)电子排布式书写原则
A.按照构造原理将电子依次填充到能量逐渐升高的能级中
a.相同能层的不同能级的能量高低顺序 :
各能级的能量高低顺序
ns<np<nd<nf
1s<2s<3s<4s;2p<3p<4p; 3d<4d
b.英文字母相同的不同能级的能量高低顺序:
c.能级交错
随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的,这种现象被称为能级交错。从第三能层开始出现能级交错现象,能级交错排列的顺序即电子能量由低到高的顺序,即ns<(n-2)f<(n-1)d<np (n为能层序数)。
源于光谱学事实
B.一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
例如26Fe
虽然先排4s后排3d,但电子排布式中先写3d,后写4s。26Fe(铁)电子排布式中最后2个能级应写为3d64s2,而不能写成4s23d6。
特别提醒:失电子的顺序:从外层到内层逐渐失去。
Fe3+:
Fe2+:
先按能量从低到高排列为1s22s22p63s24s23d6
同一能层的移到一起,即该原子的电子排布式为1s22s22p63s23p63d64s2
1s12s22p63s23p63d6
1s12s22p63s23p63d5
C.当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。
基态铬、铜的核外电子排布不符合构造原理
Cr基态原子的电子排布式:
Cu基态原子的电子排布式:
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
半充满
全充满
构造原理顺序不一定是电子排布式顺序!!!!
要求:熟练书写1-36号元素原子的电子排布式
【思考与讨论】
(1)按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2 Ne 2s22p6
Ar 3s23p6 Kr 4s24p6
Xe 5s25p6 Rn 6s26p6
通式:ns2np6
(2)电子排布式可以简化,如Na的电子排布式可简化为[Ne]3s1,
上述方括号的意义是什么?
仿照Na的简化电子排布式,写出O、Si、Cu的简化电子排布式。
O [He] 2s22p4
Si [Ne]3s23p2
Cu [Ar] 3d104s1
表示方法:用“[ ]+价层电子”的形式表示。
注:括号里面的意义是该元素前一个周期的惰性气体电子排布结构。
(3)为突出化合价与电子排布式的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。例如,Fe的简化电子排布式为[Ar]3d64s2,
价电子排布式为3d64s2 (价电子指原子核外电子中能与其他原子相互作用形成化学键的电子,为原子核外跟元素化合价有关的电子。主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子)
通常元素周期表只给出价层电子排布式,请写出Na、Al、Cl、Mn、Br的价层电子排布式。
Na 3s1 Al 3s23p1
Cl 3s23p5 Mn 3d54s2
Br 4s24p5
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
能层
能级
符号:K L M N O P Q
能量:K → Q依次升高
符号:s、p、d、f
能级数=能层序数
【课堂小结】
第一章 原子结构与性质
第一节 原子结构
第3课时
三、构造原理与电子排布式
1.构造原理:
(1)含义:以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序。
每一行对应一个能层
每一小圈对应一个能级
各圆圈件间连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序
QPONMLK
(2)规律: 1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
构造原理规律: ns (n-2)f (n-1)d np
QPONMLK
2、电子排布式
(1)理论依据:构造原理
①元素核电荷数每递增一个,同时增加一个核电荷和核外电子,就得到一个
基态原子的电子排布。
②电子填满一个能级,就开始填入下一个能级。
从氢到碳的基态原子电子排布式如下:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢 → 氦 → 锂 → 铍 → 硼 → 碳
(2)表示:用数字在能级符号右上角表明该能级上的排布的电子数。
练习1.书写下列元素基态原子的电子排布式
1s22s22p63s23p63d14s2
1s22s22p63s23p64s23d1 ×
书写21号钪(Sc)的基态原子电子排布式:
书写19号钾(K)的基态原子电子排布式:
1s22s22p63s23p64s1
注意:填充顺序以构造原理为指导书写顺序:能层低的能级写左
填充顺序不是书写顺序!
【阅读课本表1-1】总结电子排布式的书写原则
(3)电子排布式书写原则
A.按照构造原理将电子依次填充到能量逐渐升高的能级中
a.相同能层的不同能级的能量高低顺序 :
各能级的能量高低顺序
ns<np<nd<nf
1s<2s<3s<4s;2p<3p<4p; 3d<4d
b.英文字母相同的不同能级的能量高低顺序:
c.能级交错
随着电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的,电子是按能量由低到高的顺序填充的,这种现象被称为能级交错。从第三能层开始出现能级交错现象,能级交错排列的顺序即电子能量由低到高的顺序,即ns<(n-2)f<(n-1)d<np (n为能层序数)。
源于光谱学事实
B.一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
例如26Fe
虽然先排4s后排3d,但电子排布式中先写3d,后写4s。26Fe(铁)电子排布式中最后2个能级应写为3d64s2,而不能写成4s23d6。
特别提醒:失电子的顺序:从外层到内层逐渐失去。
Fe3+:
Fe2+:
先按能量从低到高排列为1s22s22p63s24s23d6
同一能层的移到一起,即该原子的电子排布式为1s22s22p63s23p63d64s2
1s12s22p63s23p63d6
1s12s22p63s23p63d5
C.当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。
基态铬、铜的核外电子排布不符合构造原理
Cr基态原子的电子排布式:
Cu基态原子的电子排布式:
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
半充满
全充满
构造原理顺序不一定是电子排布式顺序!!!!
要求:熟练书写1-36号元素原子的电子排布式
【思考与讨论】
(1)按构造原理写出稀有气体氦、氖、氩、氪、氙、氡的基态原子的最外层电子排布; 除氦外它们的通式是什么?
He 1s2 Ne 2s22p6
Ar 3s23p6 Kr 4s24p6
Xe 5s25p6 Rn 6s26p6
通式:ns2np6
(2)电子排布式可以简化,如Na的电子排布式可简化为[Ne]3s1,
上述方括号的意义是什么?
仿照Na的简化电子排布式,写出O、Si、Cu的简化电子排布式。
O [He] 2s22p4
Si [Ne]3s23p2
Cu [Ar] 3d104s1
表示方法:用“[ ]+价层电子”的形式表示。
注:括号里面的意义是该元素前一个周期的惰性气体电子排布结构。
(3)为突出化合价与电子排布式的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。例如,Fe的简化电子排布式为[Ar]3d64s2,
价电子排布式为3d64s2 (价电子指原子核外电子中能与其他原子相互作用形成化学键的电子,为原子核外跟元素化合价有关的电子。主族元素的价电子就是主族元素原子的最外层电子;过渡元素的价电子不仅是最外层电子,次外层电子及某些元素的倒数第三层电子也可成为价电子)
通常元素周期表只给出价层电子排布式,请写出Na、Al、Cl、Mn、Br的价层电子排布式。
Na 3s1 Al 3s23p1
Cl 3s23p5 Mn 3d54s2
Br 4s24p5
原子核外电子排布
构造原理
电子排布式
核外电子的填充顺序
实质:各能级的能量高低顺序
能级交错现象
概念
书写方法
能层
能级
符号:K L M N O P Q
能量:K → Q依次升高
符号:s、p、d、f
能级数=能层序数
【课堂小结】
