1.2.1研究有机化合物的一般方法 课件 (共50张PPT) 2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1研究有机化合物的一般方法 课件 (共50张PPT) 2022-2023学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 24.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 11:32:24 | ||
图片预览








文档简介
(共50张PPT)
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第一课时
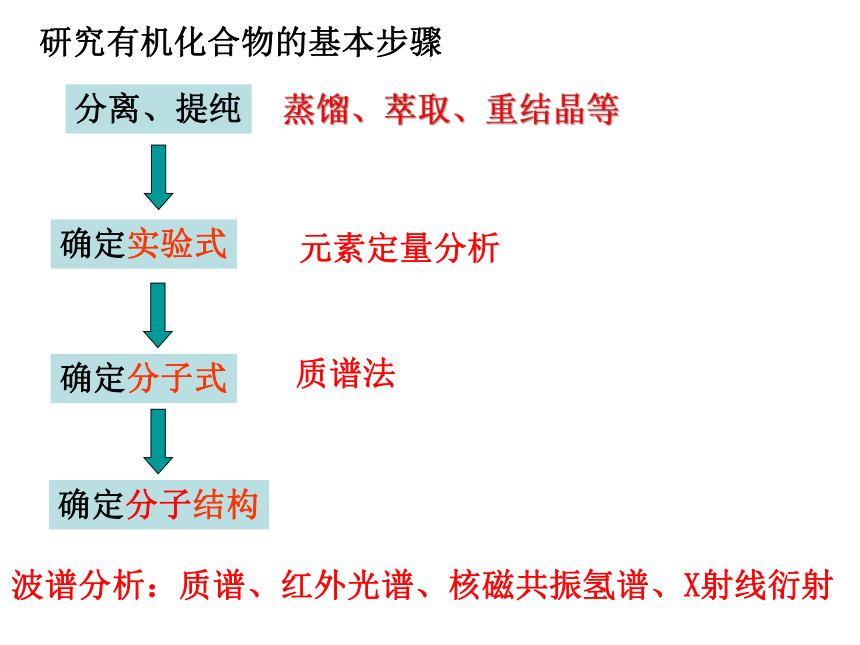
研究有机化合物的基本步骤
分离、提纯
确定实验式
确定分子式
确定分子结构
蒸馏、萃取、重结晶等
元素定量分析
质谱法
波谱分析:质谱、红外光谱、核磁共振氢谱、X射线衍射
1.分离:将两种或多种物质的混合物彼此分开,得到几种纯净物的过程。
2.提纯:除去物质中混有少量杂质而得到纯净物的过程。
(1) 基本原则
不增(不引入新杂质)
不减(不减少被提纯物质)
易分离(被提纯物质易与杂质分离)
易复原(被提纯物易复原)
一、分离、提纯
(2)注意事项
①除杂试剂应过量:
②过量试剂需除尽;
③去除多种杂质时,
要考虑加入试剂的顺序;
④选择最佳的除杂途径。
(2)物理方法:
利用有机物与杂质的物理性质的差异将它们分离。
有机物分离的常用物理方法
蒸馏
重结晶
萃取
(1)化学方法:
一般加入某种试剂进行化学反应
3、有机物的分离与提纯的方法
4、蒸馏
(1)适用范围:
蒸馏是分离、提纯液态有机化合物的常用方法。
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
(2)适用条件:
①液体有机物中含有少量杂质
②有机物热稳定性较强
如何将工业酒精进行分离、提纯?
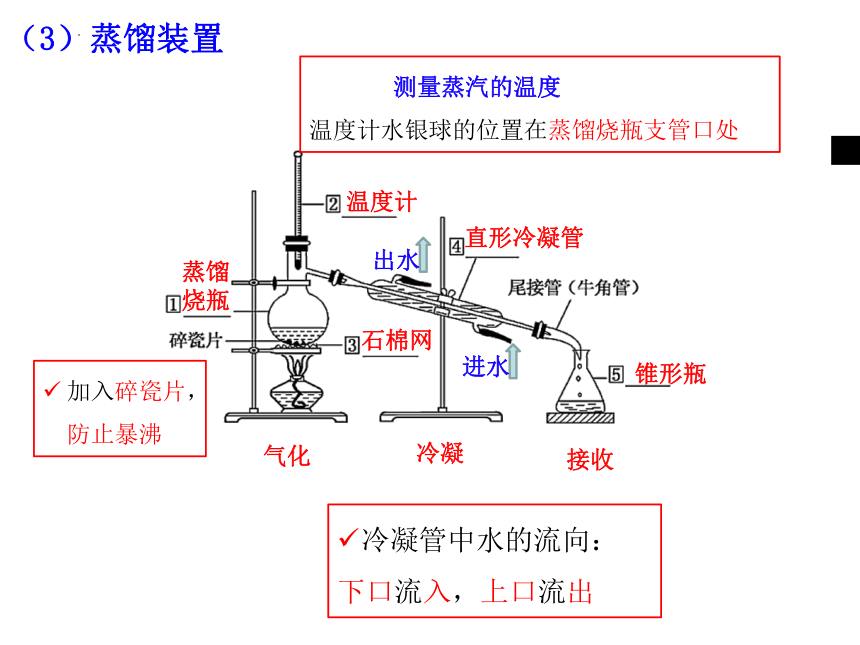
蒸馏烧瓶
石棉网
温度计
直形冷凝管
锥形瓶
气化
冷凝
接收
测量蒸汽的温度
温度计水银球的位置在蒸馏烧瓶支管口处
出水
进水
冷凝管中水的流向:
下口流入,上口流出
加入碎瓷片,防止暴沸
(3)蒸馏装置
注意二者的区别
球形冷凝管
用于冷凝回流沸点高
的液体。
蛇形冷凝管
用于冷凝回流沸点低
的液体。
直形冷凝管,多用于蒸馏操作。
例如
(4)注意事项
a.加热时应垫石棉网
b.烧瓶中放少量沸石或碎瓷片(防止暴沸)
c.烧瓶中所盛放液体不能超过2/3
d.温度计水银球的部位(蒸馏烧瓶支管处)
e.冷凝管中水的流向:下口流入,上口流出
f.用锥形瓶收集馏分
练习1、甲烷与氯气在光照条件下反应,得到的产物中含有二氯甲烷(液体,沸点40℃)、三氯甲烷(液体,沸点62℃)和四氯化碳(液体,沸点77℃),分离它们的操作方法是( )
A.萃取 B.蒸馏
C.过滤 D.重结晶
B
练习2、 粗产品蒸馏提纯时,下来装置中温度计位置正确
的是________________,可能会导致收集到的产品中混有
低沸点杂质的装置是________________。
含杂工业乙醇
工业乙醇(95.6%)
无水乙醇(99.5%以上)
蒸馏
加CaO
蒸馏
练习3、欲用96%的工业酒精制取无水乙醇时,可选用的方法是 ( )
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出来
B
练习4、将甲、乙两种有机物在常温常压下的混合物分离,已知它们的物理性质如下:
物质 密度/(g/cm3) 沸点/℃ 水溶性 溶解性
甲 0.7893 68.5 溶 溶于乙
乙 1.220 100.7 溶 溶于甲
则应采用的分离方法是( )
A.分液 B.蒸馏 C.过滤 D.萃取
B
5、萃取
(1)原理
液 液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
固 液萃取:用溶剂从固体物质中溶解出待分离组分的过程。
(2)萃取剂的选择依据
a.萃取剂和原溶剂互不相溶
b.溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
c.萃取剂与原溶液不反应
(3)常用萃取剂:
乙醚、乙酸乙酯、二氯甲烷等
小孔
凹槽
萃取碘水中的碘单质
(4)操作过程
振荡
半倒立斜向上,轻轻旋转活塞即可
萃取操作过程中,倒转分液漏斗振荡时,漏斗中某些物质挥发变成气体,会使分液漏斗中压强增大,所以要适时旋开活塞放气,以防止压强过大导致把活塞顶出.
静置分层
分液
(5)萃取装置注意事项:
a.使用前先检查分液漏斗是否漏液
b.分液漏斗内液体的总体积不超过容积的2/3。
c.振荡时双手托住分液漏斗,右手按住玻璃塞,
平放,用力振荡。(振荡后注意放气)
d.振荡后,打开上方的玻璃塞或使玻璃塞凹槽和小孔对齐,静置分层。
e.分液时,分液漏斗下端尖嘴部分紧靠烧杯内壁。
下层的为密度大的液体,从下面放出,上层的为密度相对小的液体,从上面倒出。
练习1、(不定项)下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
A、乙酸乙酯和水,酒精和水,植物油和水
B、四氯化碳和水,溴苯和水,硝基苯和水
C、甘油和水,乙酸和水,乙酸和乙醇
D、汽油和水,苯和水,己烷和水
BD
练习2.下列说法中错误的是( )
A.用酒精萃取甲苯水溶液中甲苯的操作可选用分液漏斗,然后静置分液
B.进行分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.对于密度不同、互不相溶的液体混合物,可采用分液的方法将它们分离
D.对于热稳定性较强、沸点较高的液态有机物和沸点较低的杂质可用蒸馏法除杂
A
6、重结晶
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
(1)适用范围:
提纯固体有机化合物的常用方法
(2)提纯原理:
(3)溶剂要求:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶。
重结晶要选择适当的溶剂(关键)
①杂质在此溶剂中溶解度很小或者很大,易于除去。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
【问题】
某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要
经过哪些步骤?
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【资料】
苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,
其结构可表示为 熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。
苯甲酸在水中的溶解度如下
【探究】重结晶法提纯苯甲酸
重结晶法提纯苯甲酸
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
【实验】
加热溶解
趁热过滤
冷却结晶
苯甲酸的重结晶P14图1-9
粗产品
加热溶解
趁热过滤
冷却结晶
提纯产品
重结晶法提纯苯甲酸实验步骤流程图解
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
【讨论】
【提示】泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤。
【提示】加热:使苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
【讨论】
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
【提示】玻璃棒:加热溶解——搅拌,加速苯甲酸溶解,过滤——引流
【讨论】
【提示】取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
【讨论】
(5)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
【提示】温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
【讨论】
(1)洗涤沉淀或晶体的方法:
往盛有晶体的过滤器中注入蒸馏水直至晶体被浸没,待水完全滤出后,重复两至三次,直至晶体被洗净。
(2)检验沉淀或晶体是否洗涤干净:
取最后一次的洗出液,再选择适当的试剂,是否检验出含有某些离子或物质。
如何洗涤沉淀或晶体?如何检验沉淀或晶体洗净与否?
练习1、(不定选)某同学拟用重结晶的方法除去某产品中的杂质,为此需要选用合适的溶剂。具有下列特点的溶剂中,不可取的溶剂是( )
A.产品在溶剂中的溶解度随温度的变化不大
B.在溶剂中产品比杂质更难溶解
C.杂质在溶剂中的溶解度在高温或低温时都很大
D.室温时产品在溶剂中很容易溶解
AD
练习2、乙酰苯胺是一种具有解热镇痛的白色晶体,20℃时在乙醇中的溶解度为36.9g,在水中的溶解度如下表:
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
某种乙酰苯胺样品中混入了少量氯化钠杂质,下列提纯乙酰苯胺的方法正确的是( )(注:氯化钠可分散在乙醇中形成胶体。)
A.用水溶解后分液 B.用乙醇溶解后过滤
C.用水作溶剂进行重结晶 D.用乙醇作溶剂进行重结晶
C
结晶:热的饱和溶液冷却后,溶质以晶体的形式析出这一过程。
结晶=已溶解的晶体(液态)→固态晶体,即【液态→固】
重结晶:将晶体溶于溶剂以后,又重新从溶液中结晶的
过程。又称再结晶.重结晶可以使不纯净的物质获得纯化,或使混合在一起的盐类彼此分离。
重结晶:晶体→溶解为液态→结晶,
即【固态→液态→固态】
一组概念的比较
蒸发结晶:在较高温度下析出结晶,主要是用于溶解度对温度变化小的物质。
蒸发浓缩冷却结晶(过滤):在较低温度下结晶,主要用于溶解度随温度变化大的物质。
练习1、根据右图信息,下列实验的步骤是什么?
(1)提纯KNO3、NaCl (少量)混合物中KNO3
(2)提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中。
溶解,蒸发浓缩,冷却结晶,过滤得到KNO3晶体,杂质NaCl留在滤液中。
练习2、下列各组混合物的分离或提纯方法不正确的是( )
A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
B.用重结晶法提纯NaCl和KNO3的混合物中的KNO3
C.用蒸馏法分离乙醇和甲醇的混合物
D.用萃取和分液的方法可以分离碘和水的混合物
A
练习3、将除去下列括号内的杂质通常采用的方法填在横线上:
(1 ) KNO3 (NaCl) : __________________。
(2) (Br2):____________________。
(3)C2H5OH(CH3COOH):________________。
(4)H2O(NaCl): __________________。
(5)CH3OH(H2O):______________________。
(注:甲醇,沸点为64.7 ℃)
重结晶
萃取分液(常选用的是NaOH溶液)
加NaOH后蒸馏
蒸馏
蒸馏(可加入生石灰)
(6)NaCl (KNO3 ) 。
蒸发溶剂、趁热过滤
色谱法起源于20世纪初,1906年俄国植物学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,以石油醚洗脱植物色素的提取液,经过一段时间洗脱之后,植物色素在碳酸钙柱中实现分离,由一
条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和维生素结构中,应用色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
科学 技术 社会
第一章 有机化合物的结构特点与研究方法
第二节 研究有机化合物的一般方法
第一课时
研究有机化合物的基本步骤
分离、提纯
确定实验式
确定分子式
确定分子结构
蒸馏、萃取、重结晶等
元素定量分析
质谱法
波谱分析:质谱、红外光谱、核磁共振氢谱、X射线衍射
1.分离:将两种或多种物质的混合物彼此分开,得到几种纯净物的过程。
2.提纯:除去物质中混有少量杂质而得到纯净物的过程。
(1) 基本原则
不增(不引入新杂质)
不减(不减少被提纯物质)
易分离(被提纯物质易与杂质分离)
易复原(被提纯物易复原)
一、分离、提纯
(2)注意事项
①除杂试剂应过量:
②过量试剂需除尽;
③去除多种杂质时,
要考虑加入试剂的顺序;
④选择最佳的除杂途径。
(2)物理方法:
利用有机物与杂质的物理性质的差异将它们分离。
有机物分离的常用物理方法
蒸馏
重结晶
萃取
(1)化学方法:
一般加入某种试剂进行化学反应
3、有机物的分离与提纯的方法
4、蒸馏
(1)适用范围:
蒸馏是分离、提纯液态有机化合物的常用方法。
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
(2)适用条件:
①液体有机物中含有少量杂质
②有机物热稳定性较强
如何将工业酒精进行分离、提纯?
蒸馏烧瓶
石棉网
温度计
直形冷凝管
锥形瓶
气化
冷凝
接收
测量蒸汽的温度
温度计水银球的位置在蒸馏烧瓶支管口处
出水
进水
冷凝管中水的流向:
下口流入,上口流出
加入碎瓷片,防止暴沸
(3)蒸馏装置
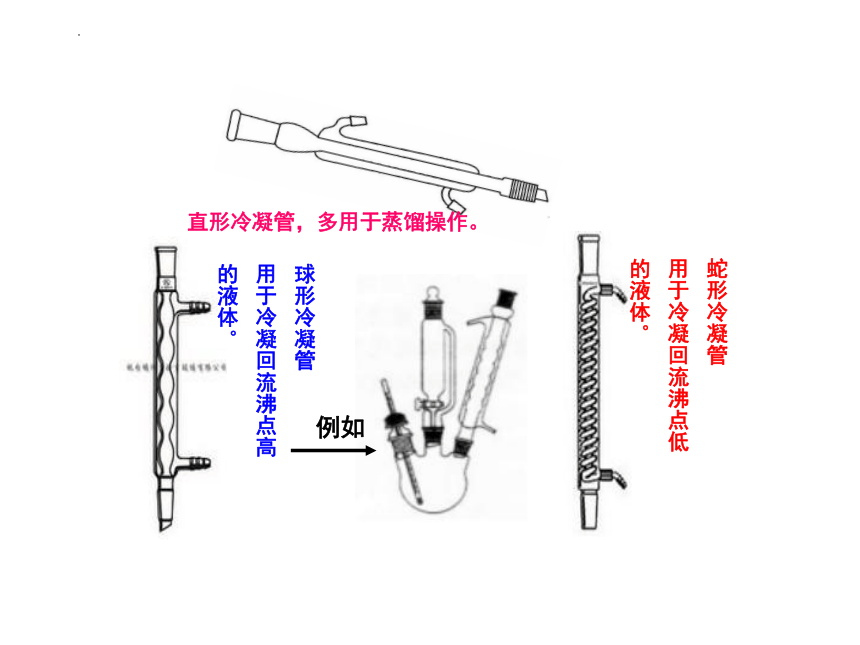
注意二者的区别
球形冷凝管
用于冷凝回流沸点高
的液体。
蛇形冷凝管
用于冷凝回流沸点低
的液体。
直形冷凝管,多用于蒸馏操作。
例如
(4)注意事项
a.加热时应垫石棉网
b.烧瓶中放少量沸石或碎瓷片(防止暴沸)
c.烧瓶中所盛放液体不能超过2/3
d.温度计水银球的部位(蒸馏烧瓶支管处)
e.冷凝管中水的流向:下口流入,上口流出
f.用锥形瓶收集馏分
练习1、甲烷与氯气在光照条件下反应,得到的产物中含有二氯甲烷(液体,沸点40℃)、三氯甲烷(液体,沸点62℃)和四氯化碳(液体,沸点77℃),分离它们的操作方法是( )
A.萃取 B.蒸馏
C.过滤 D.重结晶
B
练习2、 粗产品蒸馏提纯时,下来装置中温度计位置正确
的是________________,可能会导致收集到的产品中混有
低沸点杂质的装置是________________。
含杂工业乙醇
工业乙醇(95.6%)
无水乙醇(99.5%以上)
蒸馏
加CaO
蒸馏
练习3、欲用96%的工业酒精制取无水乙醇时,可选用的方法是 ( )
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.将96%的乙醇溶液直接加热蒸馏出来
B
练习4、将甲、乙两种有机物在常温常压下的混合物分离,已知它们的物理性质如下:
物质 密度/(g/cm3) 沸点/℃ 水溶性 溶解性
甲 0.7893 68.5 溶 溶于乙
乙 1.220 100.7 溶 溶于甲
则应采用的分离方法是( )
A.分液 B.蒸馏 C.过滤 D.萃取
B
5、萃取
(1)原理
液 液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解度不同,将其从一种溶剂转移到另一种溶剂的过程。
固 液萃取:用溶剂从固体物质中溶解出待分离组分的过程。
(2)萃取剂的选择依据
a.萃取剂和原溶剂互不相溶
b.溶质在萃取剂中的溶解度大于在原溶剂中的溶解度
c.萃取剂与原溶液不反应
(3)常用萃取剂:
乙醚、乙酸乙酯、二氯甲烷等
小孔
凹槽
萃取碘水中的碘单质
(4)操作过程
振荡
半倒立斜向上,轻轻旋转活塞即可
萃取操作过程中,倒转分液漏斗振荡时,漏斗中某些物质挥发变成气体,会使分液漏斗中压强增大,所以要适时旋开活塞放气,以防止压强过大导致把活塞顶出.
静置分层
分液
(5)萃取装置注意事项:
a.使用前先检查分液漏斗是否漏液
b.分液漏斗内液体的总体积不超过容积的2/3。
c.振荡时双手托住分液漏斗,右手按住玻璃塞,
平放,用力振荡。(振荡后注意放气)
d.振荡后,打开上方的玻璃塞或使玻璃塞凹槽和小孔对齐,静置分层。
e.分液时,分液漏斗下端尖嘴部分紧靠烧杯内壁。
下层的为密度大的液体,从下面放出,上层的为密度相对小的液体,从上面倒出。
练习1、(不定项)下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
A、乙酸乙酯和水,酒精和水,植物油和水
B、四氯化碳和水,溴苯和水,硝基苯和水
C、甘油和水,乙酸和水,乙酸和乙醇
D、汽油和水,苯和水,己烷和水
BD
练习2.下列说法中错误的是( )
A.用酒精萃取甲苯水溶液中甲苯的操作可选用分液漏斗,然后静置分液
B.进行分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.对于密度不同、互不相溶的液体混合物,可采用分液的方法将它们分离
D.对于热稳定性较强、沸点较高的液态有机物和沸点较低的杂质可用蒸馏法除杂
A
6、重结晶
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
(1)适用范围:
提纯固体有机化合物的常用方法
(2)提纯原理:
(3)溶剂要求:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶。
重结晶要选择适当的溶剂(关键)
①杂质在此溶剂中溶解度很小或者很大,易于除去。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
【问题】
某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要
经过哪些步骤?
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【资料】
苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,
其结构可表示为 熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。
苯甲酸在水中的溶解度如下
【探究】重结晶法提纯苯甲酸
重结晶法提纯苯甲酸
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
【实验】
加热溶解
趁热过滤
冷却结晶
苯甲酸的重结晶P14图1-9
粗产品
加热溶解
趁热过滤
冷却结晶
提纯产品
重结晶法提纯苯甲酸实验步骤流程图解
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
【讨论】
【提示】泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤。
【提示】加热:使苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出。
【讨论】
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
【提示】玻璃棒:加热溶解——搅拌,加速苯甲酸溶解,过滤——引流
【讨论】
【提示】取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
【讨论】
(5)温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
【提示】温度过低,杂质的溶解度也会降低,部分杂质也会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
【讨论】
(1)洗涤沉淀或晶体的方法:
往盛有晶体的过滤器中注入蒸馏水直至晶体被浸没,待水完全滤出后,重复两至三次,直至晶体被洗净。
(2)检验沉淀或晶体是否洗涤干净:
取最后一次的洗出液,再选择适当的试剂,是否检验出含有某些离子或物质。
如何洗涤沉淀或晶体?如何检验沉淀或晶体洗净与否?
练习1、(不定选)某同学拟用重结晶的方法除去某产品中的杂质,为此需要选用合适的溶剂。具有下列特点的溶剂中,不可取的溶剂是( )
A.产品在溶剂中的溶解度随温度的变化不大
B.在溶剂中产品比杂质更难溶解
C.杂质在溶剂中的溶解度在高温或低温时都很大
D.室温时产品在溶剂中很容易溶解
AD
练习2、乙酰苯胺是一种具有解热镇痛的白色晶体,20℃时在乙醇中的溶解度为36.9g,在水中的溶解度如下表:
温度/℃ 25 50 80 100
溶解度/g 0.56 0.84 3.5 5.5
某种乙酰苯胺样品中混入了少量氯化钠杂质,下列提纯乙酰苯胺的方法正确的是( )(注:氯化钠可分散在乙醇中形成胶体。)
A.用水溶解后分液 B.用乙醇溶解后过滤
C.用水作溶剂进行重结晶 D.用乙醇作溶剂进行重结晶
C
结晶:热的饱和溶液冷却后,溶质以晶体的形式析出这一过程。
结晶=已溶解的晶体(液态)→固态晶体,即【液态→固】
重结晶:将晶体溶于溶剂以后,又重新从溶液中结晶的
过程。又称再结晶.重结晶可以使不纯净的物质获得纯化,或使混合在一起的盐类彼此分离。
重结晶:晶体→溶解为液态→结晶,
即【固态→液态→固态】
一组概念的比较
蒸发结晶:在较高温度下析出结晶,主要是用于溶解度对温度变化小的物质。
蒸发浓缩冷却结晶(过滤):在较低温度下结晶,主要用于溶解度随温度变化大的物质。
练习1、根据右图信息,下列实验的步骤是什么?
(1)提纯KNO3、NaCl (少量)混合物中KNO3
(2)提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中。
溶解,蒸发浓缩,冷却结晶,过滤得到KNO3晶体,杂质NaCl留在滤液中。
练习2、下列各组混合物的分离或提纯方法不正确的是( )
A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
B.用重结晶法提纯NaCl和KNO3的混合物中的KNO3
C.用蒸馏法分离乙醇和甲醇的混合物
D.用萃取和分液的方法可以分离碘和水的混合物
A
练习3、将除去下列括号内的杂质通常采用的方法填在横线上:
(1 ) KNO3 (NaCl) : __________________。
(2) (Br2):____________________。
(3)C2H5OH(CH3COOH):________________。
(4)H2O(NaCl): __________________。
(5)CH3OH(H2O):______________________。
(注:甲醇,沸点为64.7 ℃)
重结晶
萃取分液(常选用的是NaOH溶液)
加NaOH后蒸馏
蒸馏
蒸馏(可加入生石灰)
(6)NaCl (KNO3 ) 。
蒸发溶剂、趁热过滤
色谱法起源于20世纪初,1906年俄国植物学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,以石油醚洗脱植物色素的提取液,经过一段时间洗脱之后,植物色素在碳酸钙柱中实现分离,由一
条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和维生素结构中,应用色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
科学 技术 社会
