2.3.3 分子间的作用力 课件 (共19张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.3 分子间的作用力 课件 (共19张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
第三课时 分子间的作用力
【思考与讨论】
冰山融化现象是物理变化还是化学变化?
冰山融化过程中有没有破坏其中的化学键?
那为什么冰山融化过程仍要吸收能量呢?
水分子间存在着相互作用力
1、概念:把分子聚集在一起的作用力,叫分子间作用力,也叫范德华力。
一、范德华力及其对物质性质的影响
2、特点:
②分子间的静电作用,没有方向性和饱和性
①只存在于分子中
③范德华力很弱,比化学键的键能小1~2个数量级。
练习:下列物质有范德华力的有
Ar、H2、P4、S8、C60、Mg、金刚石、晶体硅、石墨、CO2、H2SO4、HF、H2O、AlCl3、CH3CH2OH、NaCl、Al2O3、SiO2、SiC
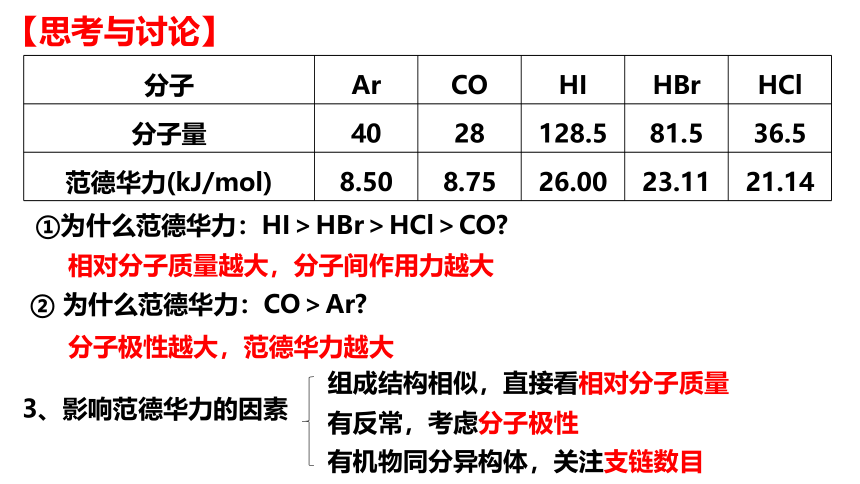
分子 Ar CO HI HBr HCl
分子量 40 28 128.5 81.5 36.5
范德华力(kJ/mol) 8.50 8.75 26.00 23.11 21.14
①为什么范德华力:HI>HBr>HCl>CO
相对分子质量越大,分子间作用力越大
② 为什么范德华力:CO>Ar
分子极性越大,范德华力越大
3、影响范德华力的因素
组成结构相似,直接看相对分子质量
有反常,考虑分子极性
【思考与讨论】
有机物同分异构体,关注支链数目
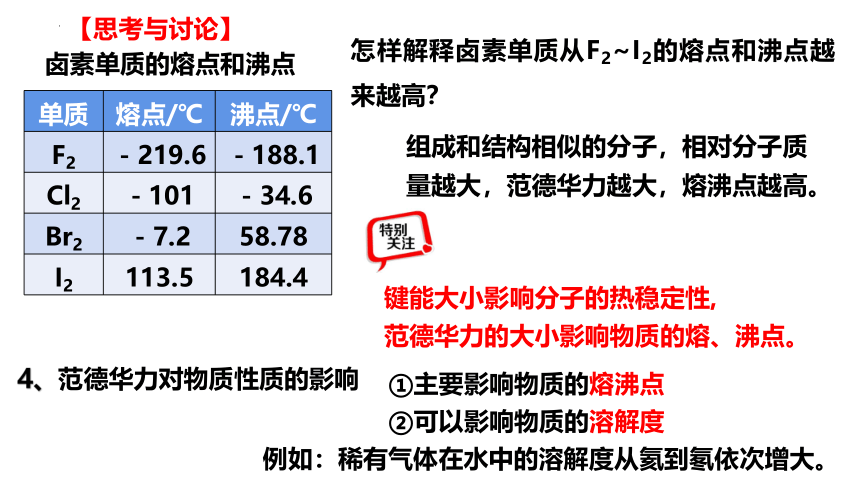
组成和结构相似的分子,相对分子质量越大,范德华力越大,熔沸点越高。
怎样解释卤素单质从F2~I2的熔点和沸点越来越高?
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
卤素单质的熔点和沸点
键能大小影响分子的热稳定性,
范德华力的大小影响物质的熔、沸点。
【思考与讨论】
①主要影响物质的熔沸点
②可以影响物质的溶解度
4、范德华力对物质性质的影响
例如:稀有气体在水中的溶解度从氦到氡依次增大。
B
练习1:下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的区别是作用力的强弱问题
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏分子间的范德华力不需要消耗能量
练习2:下列关于范德华力影响物质性质的叙述中,正确的是( )
A.范德华力是决定由分子构成的物质的熔、沸点高低的唯一因素
B.范德华力与物质的性质没有必然的联系
C.范德华力能够影响物质的化学性质和物理性质
D.范德华力仅影响物质的部分物理性质
D
A
练习3:下列物质的变化中,破坏的主要是范德华力的是( )
A.碘单质的升华 B.NaCl溶于水
C.将冰加热变为液态 D.NH4Cl受热分解
练习4:人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘蛛之所以不能从天花板上掉下的主要原因是( )
A.蜘蛛脚的尖端锋利,能抓住天花板B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
C
科学 技术 社会-----壁虎与范德华力
壁虎为什么能在天花板土爬行自如?这曾是一个困扰科学家一百多年的谜。用电子显微镜可观察到,壁虎的四足覆盖着几十万条纤细的由角蛋白构成的纳米级尺寸的毛。壁虎的足有多大吸力?实验证明,如果在一个分币的面积上布满100万条壁虎足的细毛,可以吊起20kg重的物体。近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之间的范德华力。
【分析】H2O分子间存在着一种不同于范德华力的特殊作用力。
【思考讨论】已知水分子间的范德华力是 16.4kJ/mol,硫化氢分子间的范德华力为21.14kJ/mol,但 H2O的沸点比H2S高1390C,这是为什么?
【疑惑】氢键强度如何?有方向性吗?有饱和性吗?
氢键
二、氢键对物质性质的影响
①X、Y为N、O、F
②X、Y可以相同,也可以不同
③“—”表示共价键,“ ”表示形成的氢键
1、概念:它是由已经与电负性很大的原子(如N、F、O)形成共价键的 氢原子与另一分子中电负性很大的原子之间的作用力。
2、表示: 氢键通常用X—H···Y —表示,“—”表示共价键,“···”表示形成的氢键(X、Y为N、O、F)
δ+
X H
一个分子中
电负性很大的原子 H 原子
共价键
δ-
Y
另一个分子中
电负性很大的原子
δ-
共价键
···
氢键
H—O键极性很强
无内层电子,几乎成为“裸露”的质子
电负性大,半径小
氢键
O
H
H
O
H
H
δ+
δ+
δ-
δ-
…
3、特征
①方向性 X—H…Y三个原子一般在同一方向上
②饱和性 每一个X一H只能与个Y原子形成氢键
③强度 化学键>氢键>范德华力
氢键一般存在于含N—H、H—O、H—F的物质中
【思考】根据氢键的形成条件,哪些物质中会存在氢键?
HF、NH3、H2O、N2H4、醇类和羧酸类等物质中含有氢键
①部分裸露的氢原子核
②电负性很大且半径小的原子提供孤电子对
4、形成条件:
I、从物质种类看
II、从成键形式看
①分子间氢键:H2O NH3 HF
图 1
分子内氢键
图 2
分子间氢键
②分子内氢键:例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构。
如:HF、H2O、NH3 相互之间,C2H5OH、CH3COOH、H2O相互之间
5、对物理性质的影响
I、对物质熔、沸点的影响
分子内氢键
分子间氢键
①存在分子间氢键的物质一般具有较高的熔、沸点。
②存在分子内氢键使物质熔、沸点降低。
【观察与分析】通过观察上面2个图,能得出什么结论?
II、对物质溶解性的影响
相似相溶
①分子极性相似
非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
②分子结构相似
如蔗糖和氨易溶于水,难溶于四氯化碳;萘和碘易溶于四氯化碳,难溶于水。
溶质和溶剂的分子结构相似程度越大,其溶解性越大。
乙醇与水互溶,而戊醇在水中的溶解度相对较小。
③氢键:溶剂和溶质之间的氢键作用力越大,溶解性越好。
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
NH3为极性分子,CH4为非极性分子,而水为极性分子,根据相似相溶规律,NH3易溶于水,而CH4不易溶于水。且NH3与水分子之间可形成氢键,使得NH3更易溶于水。
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
【思考讨论】
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。
资料卡片:气体的溶解度(气体的压强为1.01×105 Pa,温度为293K,在100 g水中的溶解度),利用相似相溶原理解释上表数据
①乙炔、乙烯、已烷、甲烷、氢气、氮气、氧气都是非极性分子,在水中的溶解度都很小。
②SO2和CO2都能和水反应,但SO2是极性分子,CO2是非极性分子,所以SO2(11.28 g)比CO2 (0.169 g)在水中的溶解度大很多。
③氯气也是非极性分子,但氯气能和水反应,生成物HCl、HClO能溶于水,所以氯气的溶解性比其他非金属单质要好。
④NH3分子能和H2O分子形成分子间氢键,所以NH,在水中的溶解度很大(52.9 g)。
(1)同样是直线形非极性分子,常温下二氧化碳是气体而二硫化碳是液体。
(2)同样是三角锥形氢化物,氨气在水中极易溶解,并且很容易液化。而
同主族的磷化氢( PH3 )却没有这些性质。
练习:请解释下列现象
二硫化碳相对分子质量较大 → 范德华力较大 → 沸点较高→常温液态。
PH3 无氢键作用
无这些性质
氨分子间存在氢键
氨气容易液化
氨分子为极性分子
氨分子与水分子间形成氢键
氨气在水中极易溶解
第二章 分子结构与性质
第三节 分子结构与物质的性质
第三课时 分子间的作用力
【思考与讨论】
冰山融化现象是物理变化还是化学变化?
冰山融化过程中有没有破坏其中的化学键?
那为什么冰山融化过程仍要吸收能量呢?
水分子间存在着相互作用力
1、概念:把分子聚集在一起的作用力,叫分子间作用力,也叫范德华力。
一、范德华力及其对物质性质的影响
2、特点:
②分子间的静电作用,没有方向性和饱和性
①只存在于分子中
③范德华力很弱,比化学键的键能小1~2个数量级。
练习:下列物质有范德华力的有
Ar、H2、P4、S8、C60、Mg、金刚石、晶体硅、石墨、CO2、H2SO4、HF、H2O、AlCl3、CH3CH2OH、NaCl、Al2O3、SiO2、SiC
分子 Ar CO HI HBr HCl
分子量 40 28 128.5 81.5 36.5
范德华力(kJ/mol) 8.50 8.75 26.00 23.11 21.14
①为什么范德华力:HI>HBr>HCl>CO
相对分子质量越大,分子间作用力越大
② 为什么范德华力:CO>Ar
分子极性越大,范德华力越大
3、影响范德华力的因素
组成结构相似,直接看相对分子质量
有反常,考虑分子极性
【思考与讨论】
有机物同分异构体,关注支链数目
组成和结构相似的分子,相对分子质量越大,范德华力越大,熔沸点越高。
怎样解释卤素单质从F2~I2的熔点和沸点越来越高?
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
卤素单质的熔点和沸点
键能大小影响分子的热稳定性,
范德华力的大小影响物质的熔、沸点。
【思考与讨论】
①主要影响物质的熔沸点
②可以影响物质的溶解度
4、范德华力对物质性质的影响
例如:稀有气体在水中的溶解度从氦到氡依次增大。
B
练习1:下列关于范德华力的叙述中,正确的是( )
A.范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B.范德华力与化学键的区别是作用力的强弱问题
C.任何分子间在任意情况下都会产生范德华力
D.范德华力非常微弱,故破坏分子间的范德华力不需要消耗能量
练习2:下列关于范德华力影响物质性质的叙述中,正确的是( )
A.范德华力是决定由分子构成的物质的熔、沸点高低的唯一因素
B.范德华力与物质的性质没有必然的联系
C.范德华力能够影响物质的化学性质和物理性质
D.范德华力仅影响物质的部分物理性质
D
A
练习3:下列物质的变化中,破坏的主要是范德华力的是( )
A.碘单质的升华 B.NaCl溶于水
C.将冰加热变为液态 D.NH4Cl受热分解
练习4:人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘蛛之所以不能从天花板上掉下的主要原因是( )
A.蜘蛛脚的尖端锋利,能抓住天花板B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
C
科学 技术 社会-----壁虎与范德华力
壁虎为什么能在天花板土爬行自如?这曾是一个困扰科学家一百多年的谜。用电子显微镜可观察到,壁虎的四足覆盖着几十万条纤细的由角蛋白构成的纳米级尺寸的毛。壁虎的足有多大吸力?实验证明,如果在一个分币的面积上布满100万条壁虎足的细毛,可以吊起20kg重的物体。近年来,有人用计算机模拟,证明壁虎的足与墙体之间的作用力在本质上是它的细毛与墙体之间的范德华力。
【分析】H2O分子间存在着一种不同于范德华力的特殊作用力。
【思考讨论】已知水分子间的范德华力是 16.4kJ/mol,硫化氢分子间的范德华力为21.14kJ/mol,但 H2O的沸点比H2S高1390C,这是为什么?
【疑惑】氢键强度如何?有方向性吗?有饱和性吗?
氢键
二、氢键对物质性质的影响
①X、Y为N、O、F
②X、Y可以相同,也可以不同
③“—”表示共价键,“ ”表示形成的氢键
1、概念:它是由已经与电负性很大的原子(如N、F、O)形成共价键的 氢原子与另一分子中电负性很大的原子之间的作用力。
2、表示: 氢键通常用X—H···Y —表示,“—”表示共价键,“···”表示形成的氢键(X、Y为N、O、F)
δ+
X H
一个分子中
电负性很大的原子 H 原子
共价键
δ-
Y
另一个分子中
电负性很大的原子
δ-
共价键
···
氢键
H—O键极性很强
无内层电子,几乎成为“裸露”的质子
电负性大,半径小
氢键
O
H
H
O
H
H
δ+
δ+
δ-
δ-
…
3、特征
①方向性 X—H…Y三个原子一般在同一方向上
②饱和性 每一个X一H只能与个Y原子形成氢键
③强度 化学键>氢键>范德华力
氢键一般存在于含N—H、H—O、H—F的物质中
【思考】根据氢键的形成条件,哪些物质中会存在氢键?
HF、NH3、H2O、N2H4、醇类和羧酸类等物质中含有氢键
①部分裸露的氢原子核
②电负性很大且半径小的原子提供孤电子对
4、形成条件:
I、从物质种类看
II、从成键形式看
①分子间氢键:H2O NH3 HF
图 1
分子内氢键
图 2
分子间氢键
②分子内氢键:例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构。
如:HF、H2O、NH3 相互之间,C2H5OH、CH3COOH、H2O相互之间
5、对物理性质的影响
I、对物质熔、沸点的影响
分子内氢键
分子间氢键
①存在分子间氢键的物质一般具有较高的熔、沸点。
②存在分子内氢键使物质熔、沸点降低。
【观察与分析】通过观察上面2个图,能得出什么结论?
II、对物质溶解性的影响
相似相溶
①分子极性相似
非极性溶质一般能溶于非极性溶剂,
极性溶质一般能溶于极性溶剂。
②分子结构相似
如蔗糖和氨易溶于水,难溶于四氯化碳;萘和碘易溶于四氯化碳,难溶于水。
溶质和溶剂的分子结构相似程度越大,其溶解性越大。
乙醇与水互溶,而戊醇在水中的溶解度相对较小。
③氢键:溶剂和溶质之间的氢键作用力越大,溶解性越好。
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
NH3为极性分子,CH4为非极性分子,而水为极性分子,根据相似相溶规律,NH3易溶于水,而CH4不易溶于水。且NH3与水分子之间可形成氢键,使得NH3更易溶于水。
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
【思考讨论】
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。
资料卡片:气体的溶解度(气体的压强为1.01×105 Pa,温度为293K,在100 g水中的溶解度),利用相似相溶原理解释上表数据
①乙炔、乙烯、已烷、甲烷、氢气、氮气、氧气都是非极性分子,在水中的溶解度都很小。
②SO2和CO2都能和水反应,但SO2是极性分子,CO2是非极性分子,所以SO2(11.28 g)比CO2 (0.169 g)在水中的溶解度大很多。
③氯气也是非极性分子,但氯气能和水反应,生成物HCl、HClO能溶于水,所以氯气的溶解性比其他非金属单质要好。
④NH3分子能和H2O分子形成分子间氢键,所以NH,在水中的溶解度很大(52.9 g)。
(1)同样是直线形非极性分子,常温下二氧化碳是气体而二硫化碳是液体。
(2)同样是三角锥形氢化物,氨气在水中极易溶解,并且很容易液化。而
同主族的磷化氢( PH3 )却没有这些性质。
练习:请解释下列现象
二硫化碳相对分子质量较大 → 范德华力较大 → 沸点较高→常温液态。
PH3 无氢键作用
无这些性质
氨分子间存在氢键
氨气容易液化
氨分子为极性分子
氨分子与水分子间形成氢键
氨气在水中极易溶解
