3.1.2物质的聚集状态与晶体的常识 课件 (共44张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.1.2物质的聚集状态与晶体的常识 课件 (共44张PPT) 2022-2023学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 00:00:00 | ||
图片预览


文档简介
(共44张PPT)
第三章 晶体结构与性质
第一节 物质的聚集状态与晶体的常识
第3课时 晶 胞
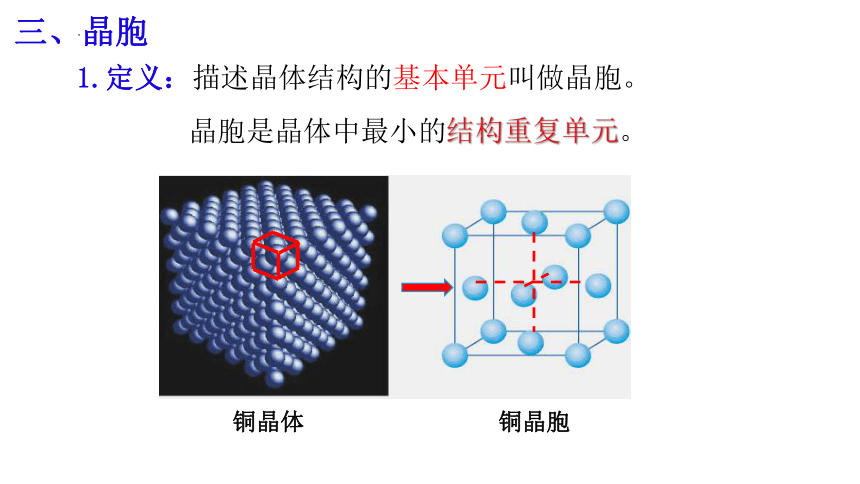
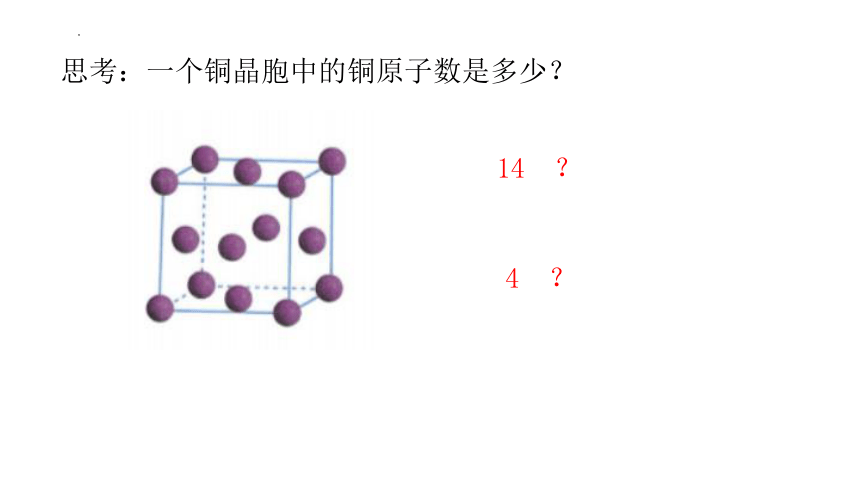
铜晶体
铜晶胞
三、晶胞
1.定义:描述晶体结构的基本单元叫做晶胞。
晶胞是晶体中最小的结构重复单元。
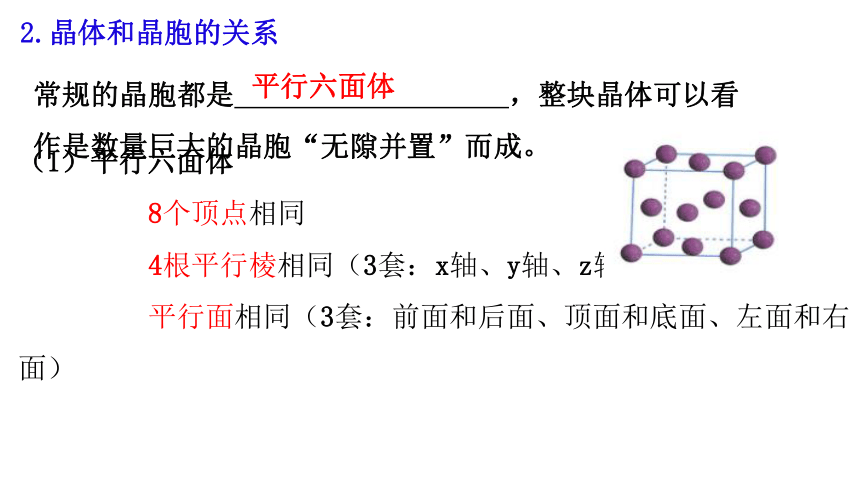
2.晶体和晶胞的关系
常规的晶胞都是 ,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
平行六面体
(1)平行六面体
8个顶点相同
4根平行棱相同(3套:x轴、y轴、z轴)
平行面相同(3套:前面和后面、顶面和底面、左面和右面)
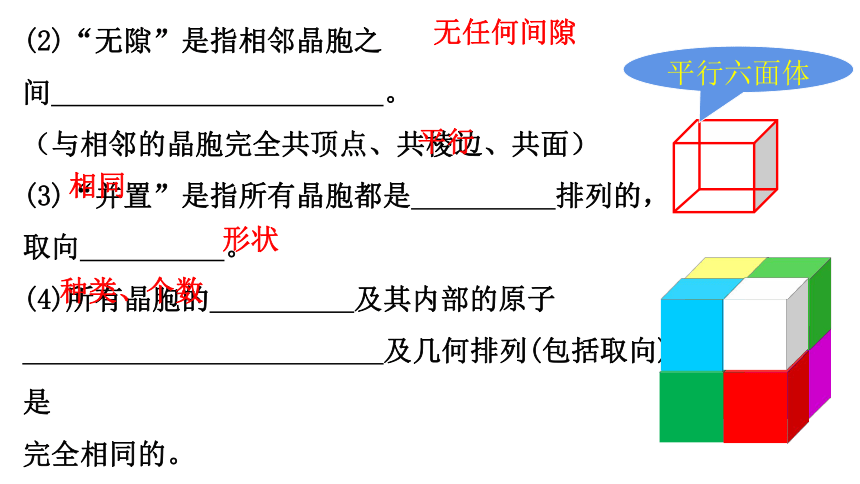
(2)“无隙”是指相邻晶胞之间 。
(与相邻的晶胞完全共顶点、共棱边、共面)
(3)“并置”是指所有晶胞都是 排列的,取向 。
(4)所有晶胞的 及其内部的原子
及几何排列(包括取向)是
完全相同的。
无任何间隙
平行
相同
形状
种类、个数
平行六面体
体心立方
简单立方
面心立方
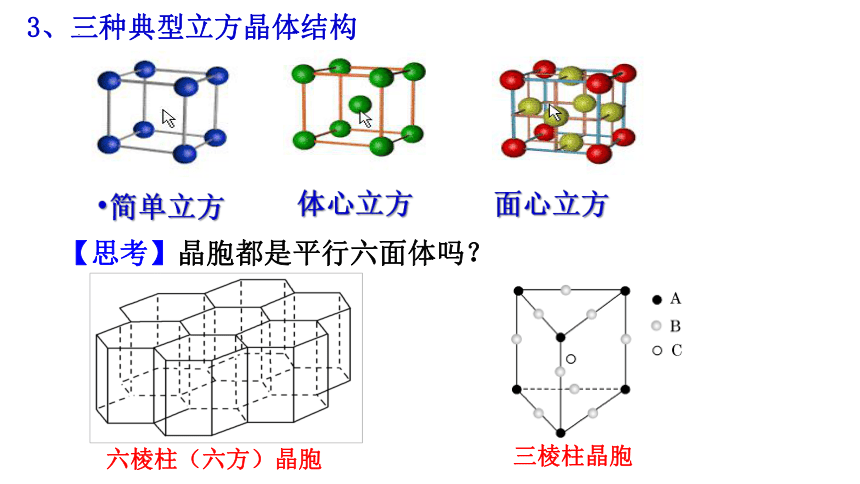
3、三种典型立方晶体结构
【思考】晶胞都是平行六面体吗?
六棱柱(六方)晶胞
三棱柱晶胞
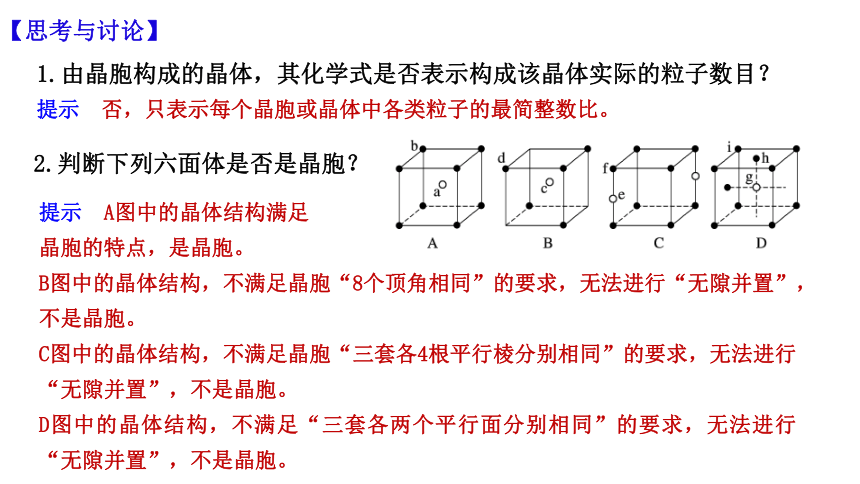
1.由晶胞构成的晶体,其化学式是否表示构成该晶体实际的粒子数目?
提示 否,只表示每个晶胞或晶体中各类粒子的最简整数比。
【思考与讨论】
2.判断下列六面体是否是晶胞?
提示 A图中的晶体结构满足
晶胞的特点,是晶胞。
B图中的晶体结构,不满足晶胞“8个顶角相同”的要求,无法进行“无隙并置”,不是晶胞。
C图中的晶体结构,不满足晶胞“三套各4根平行棱分别相同”的要求,无法进行“无隙并置”,不是晶胞。
D图中的晶体结构,不满足“三套各两个平行面分别相同”的要求,无法进行“无隙并置”,不是晶胞。
思考:一个铜晶胞中的铜原子数是多少?
14 ?
4 ?
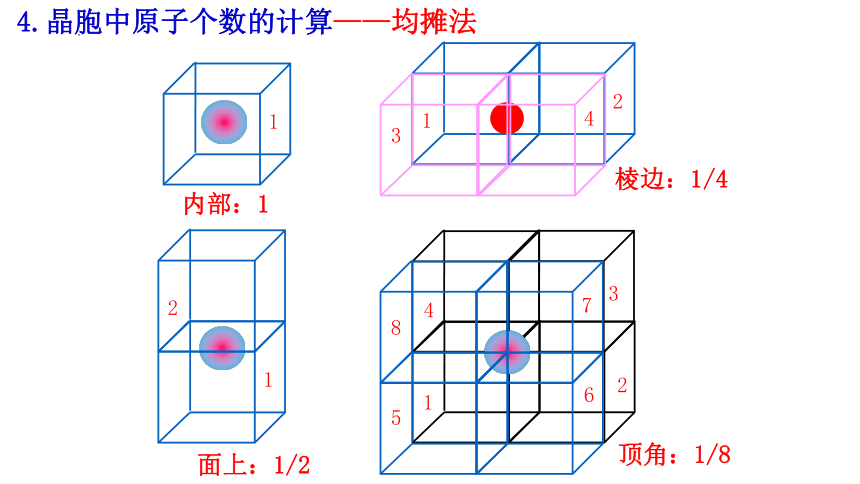
1
内部:1
1
2
面上:1/2
2
1
3
4
棱边:1/4
1
2
4
3
7
6
8
5
顶角:1/8
4.晶胞中原子个数的计算——均摊法
金属铜的一个晶胞的原子数=8× +6× =4
2
1
8
1
一个铜晶胞中的铜原子数
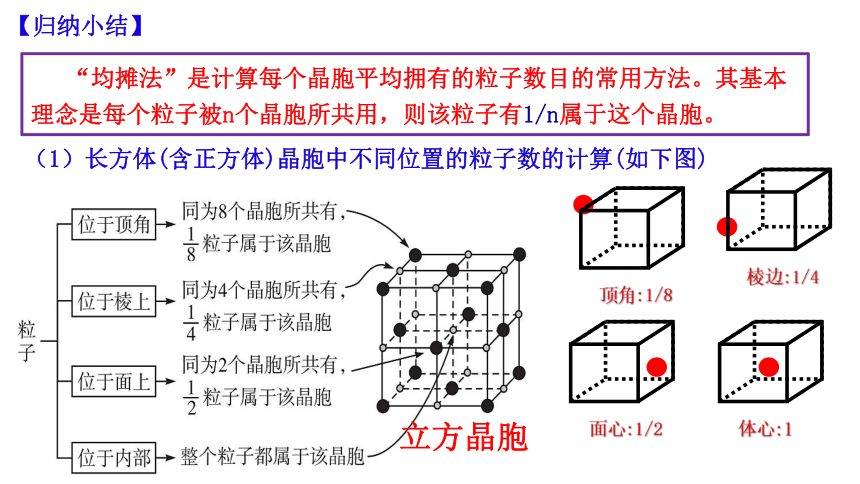
立方晶胞
顶角:1/8
面心:1/2
体心:1
棱边:1/4
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有1/n属于这个晶胞。
【归纳小结】
(1)长方体(含正方体)晶胞中不同位置的粒子数的计算(如下图)
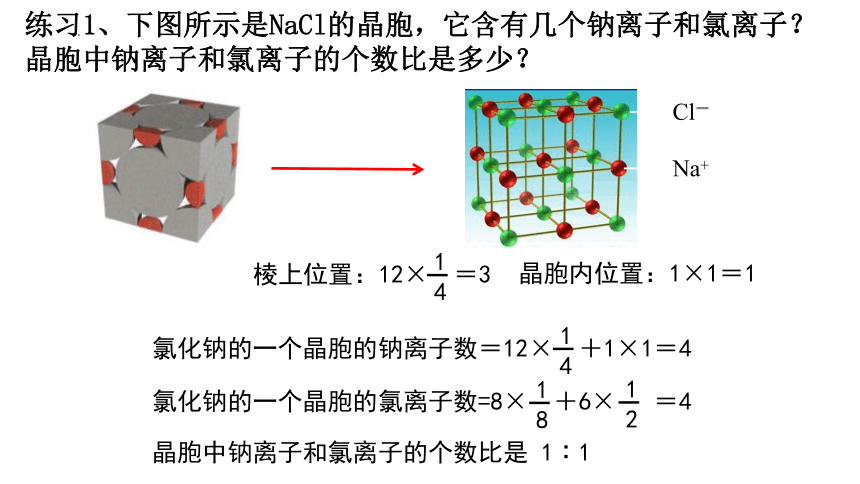
晶胞内位置:1×1=1
棱上位置:12× =3
4
1
氯化钠的一个晶胞的钠离子数=12× +1×1=4
4
1
氯化钠的一个晶胞的氯离子数=8× +6× =4
2
1
8
1
晶胞中钠离子和氯离子的个数比是 1∶1
练习1、下图所示是NaCl的晶胞,它含有几个钠离子和氯离子?晶胞中钠离子和氯离子的个数比是多少?
Cl-
Na+
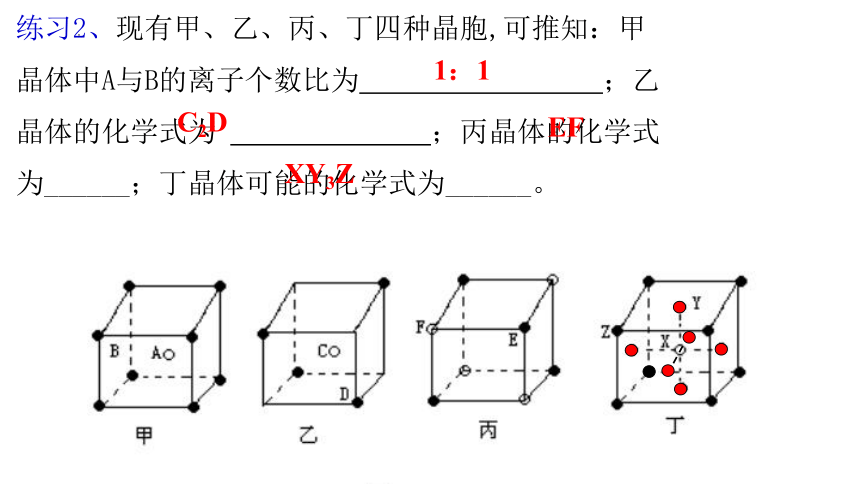
练习2、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体可能的化学式为______。
1:1
C2D
EF
XY3Z
练习3、下图为高温超导领域的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
1)在该物质的晶体中,每个钛离子周围与它最接近且距离相等的钛离子共有 个
2)该晶体结构单元中,氧、钛、钙离子的个数比是 。
6
3∶1∶1
Ti
O
Ca
O:12×1/4=3
Ti: 8 ×1/8=1
Ca:1
思考与讨论(1)晶胞有几套平行棱?有几套平行面?
晶胞有3套平行棱,有3套平行面?
1.金属钠的一个晶胞的原子数=
2.金属锌的一个晶胞的原子数=
3.碘的一个晶胞的原子数=
思考与讨论(2)
下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
金刚石:8×1/8+6×1/2+4=8。
(2)六方晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部1
(3)正三棱柱晶胞中粒子的计算方法
不
顶点:1/12
侧棱:1/6
内部:1
上下棱:1/4
练习4、2001年报道的硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如图所示的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
A、MgB
B、 MgB2
C、Mg2B
D、Mg3B2
Mg原子的数目:
12×1/6+2×1/2=3
B原子的数目:6
故化学式可表示为:MgB2
B
练习6、如图所示的晶体中,A、B、C三种粒子数之比
是 。
1:4:2
练习7、话筒是声电转换的换能器,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶胞的结构示意图,可知它的化学式是( )
A.BaTi8O12 B.BaTi4O6
C.BaTi2O4 D.BaTiO3
解析:仔细观察钛酸钡晶胞的结构示意图可知:Ba在立方体的体心,完全属于该晶胞;Ti处于立方体的8个顶点,O处于立方体的12条棱的中点,故晶胞中Ba、Ti、O三种原子的个数比为
D
练习8、某晶体结构模型如图所示。该晶体的化学式是__________________,在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个。
解析:晶胞中含有O:6× =3个,含Co:8× =1个,含Ti:1个,故化学式为CoTiO3。
Ti原子位于晶胞的中心,其周围距离最近的O原子位于6个面的中心,所以周围距
离最近的O原子数目为6个;Co原子位于晶胞的顶点,O原子位于晶胞的面心,所以
Co原子周围距离最近的O原子数目为12个。
练习9、如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
(1)在该物质的晶体中,每个钛离子周围与它最接近的
且等距离的钛离子共有 个。
(2)该晶体中,元素氧、钛、钙的粒子个数比是 。
6
3∶1∶1
解析:回答第(1)小题要注意发挥空间想象力,在晶胞的上、下、左、右、前、后都有完全等同的晶胞,依据一个晶胞我们能观察到3个与钛离子最接近且等距离的钛离子,在与这3个钛离子相反的位置还有3个钛离子,所以共有6个钛离子。对于第(2)小题我们可以使用均摊法求得
练习10、科学家发现一种由钛原子和碳原子构成的气态团簇分子,如图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.TiC B.Ti6C7 C.Ti14C13 D.Ti13C14
D
若该图是一个晶胞,则这种计算正确,但它是一个气态团簇分子,其化学式就是其分子式,应直接数出原子数。
小结:团簇分子或纳米颗粒中,所含微粒为其本身所有,不与其他分子或颗粒共用。
练习10、某离子晶体晶胞结构如右图所示,X位于立方体的顶点, Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角∠XYX的角度为:
A. 90° B. 60° C. 120° D. 109°28′
5、晶体微粒与M、ρ之间的换算
ρ = m/V
根据晶胞结构确定各种粒子的数目
根据晶胞的边长或微粒间的距离
晶胞质量
晶胞体积
求
求
练习1、某晶体的立方体晶胞如下图,计算其密度
1mol该晶胞的体积:
边长a pm
摩尔质量为M g/mol
NA×(a×10-10)3 cm3
1mol该晶胞的质量:
M g
该晶胞的密度:
练习2.如图是CsCl晶体的晶胞,已知晶体中2个最近的Cs+核间距离为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则CsCl晶体的密度为( )g/cm3 。
A、8M/a3NA B、a3M/8NA
C、M/a3NA D、a3M/NA
顶点-Cs+ 中心-Cl﹣
C
练习3、ZnS在荧光体颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,则该晶体密度为
g·cm-3(列式不必计算,ZnS相对分子质量为97)。
1m=103mm=106um=109nm=1012pm
ρ=
4×97
(540×10-10)3·NA
练习4、(2020·天津等级考)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为______g·cm-3。铁、钴、镍三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为 。
解析:该晶胞中Co2+个数为12× +1=4,O2-个数为8× +6× =4,晶胞质量为
晶胞体积为(a×10-7 cm)3,故晶体的密度为 ÷(a
×10-7cm)3= g·cm-3。三种元素二价氧化物均为离子晶体,由于离子半
径:Fe2+>Co2+>Ni2+,则晶格能:NiO>CoO>FeO,故熔点:NiO>CoO>FeO。
NiO>CoO>FeO
练习1、若CaTiO3的相对分子质量为M,密度为 A g/cm3,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为_______。
6、计算晶胞微粒间的距离
练习2、测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为 ( )
C
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体。具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性。普通晶体只能具有二次、三次、四次或六次旋转对称性,但是准晶的布拉格衍射图具有其他的对称性,例如五次对称性或者更高的如六次以上的对称性。获得2011年诺贝尔化学奖的丹·舍特曼是第一个正式报道发现了准晶的人。1984年他和以色列理工学院的同事们在快速冷却的铝锰合金中发现了一种新的金属相,其电子衍射斑具有明显的五次对称性。准晶体具有独特的属性,其坚硬又有弹性、非常平滑,而且,与大多数金属不同的是,其导电、导热性很差,在日常生活中可用来制造不粘锅、发光二极管、热电转化设备等。
【探究] 准晶
四、晶体结构的测定
1.X射线衍射原理
单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
X射线衍射仪
非晶态和晶态二氧化硅粉末X射线衍射图谱的对比
2.X射线衍射实验获得晶胞信息
A、晶胞的形状和大小
B、分子或原子在微观空间有序排列的对称性
C、原子在晶胞里的数目和位置
D、结合晶体化学组成的信息推出原子间的相互关系
3.X射线衍射实验获得分子信息
通过晶体X射线衍射实验,可以测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
乙酸晶体
乙酸晶胞
乙酸分子的空间结构
练习1、下列有关说法正确的是( )
A.测定晶体结构最常用的仪器是X射线衍射仪
B.石英玻璃和水晶的衍射图谱相同
C.通过乙酸晶体的X射线衍射实验,只能测定晶胞中含有的乙酸分子数,不能推出乙酸分子的空间结构
D.晶体的X射线衍射实验不能判断晶体中存在哪些化学键,也不能确定键长和键角
A
石英玻璃是非晶态二氧化硅,水晶是晶态的二氧化硅
练习2、(双选)晶体是一类非常重要的材料,在很多领域都有广泛的应用。下列对晶体硅的叙述正确的是( )
A.形成晶体硅的速率越快越好
B.晶体硅有固定的熔点
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.粉末状的固体一定不是晶体
答案:BC
解析:A选项,晶体的形成都有一定的条件,如温度、压强、结晶速率等,并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,A项说法错误;晶体有固定的熔点,B选项说法正确;X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列就能区分晶体与非晶体,C选项说法正确;粉末状的固体也可能是晶体,在光学显微镜下可以观察到晶体的规则外形,D项说法错误。
练习3、因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同,对铁晶体用X射线衍射进行测定,测得A、B两种晶胞,其晶胞结构示意图如下:
则A、B两种晶胞中含有的铁原子数分别是:____、____。
2
4
第三章 晶体结构与性质
第一节 物质的聚集状态与晶体的常识
第3课时 晶 胞
铜晶体
铜晶胞
三、晶胞
1.定义:描述晶体结构的基本单元叫做晶胞。
晶胞是晶体中最小的结构重复单元。
2.晶体和晶胞的关系
常规的晶胞都是 ,整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
平行六面体
(1)平行六面体
8个顶点相同
4根平行棱相同(3套:x轴、y轴、z轴)
平行面相同(3套:前面和后面、顶面和底面、左面和右面)
(2)“无隙”是指相邻晶胞之间 。
(与相邻的晶胞完全共顶点、共棱边、共面)
(3)“并置”是指所有晶胞都是 排列的,取向 。
(4)所有晶胞的 及其内部的原子
及几何排列(包括取向)是
完全相同的。
无任何间隙
平行
相同
形状
种类、个数
平行六面体
体心立方
简单立方
面心立方
3、三种典型立方晶体结构
【思考】晶胞都是平行六面体吗?
六棱柱(六方)晶胞
三棱柱晶胞
1.由晶胞构成的晶体,其化学式是否表示构成该晶体实际的粒子数目?
提示 否,只表示每个晶胞或晶体中各类粒子的最简整数比。
【思考与讨论】
2.判断下列六面体是否是晶胞?
提示 A图中的晶体结构满足
晶胞的特点,是晶胞。
B图中的晶体结构,不满足晶胞“8个顶角相同”的要求,无法进行“无隙并置”,不是晶胞。
C图中的晶体结构,不满足晶胞“三套各4根平行棱分别相同”的要求,无法进行“无隙并置”,不是晶胞。
D图中的晶体结构,不满足“三套各两个平行面分别相同”的要求,无法进行“无隙并置”,不是晶胞。
思考:一个铜晶胞中的铜原子数是多少?
14 ?
4 ?
1
内部:1
1
2
面上:1/2
2
1
3
4
棱边:1/4
1
2
4
3
7
6
8
5
顶角:1/8
4.晶胞中原子个数的计算——均摊法
金属铜的一个晶胞的原子数=8× +6× =4
2
1
8
1
一个铜晶胞中的铜原子数
立方晶胞
顶角:1/8
面心:1/2
体心:1
棱边:1/4
“均摊法”是计算每个晶胞平均拥有的粒子数目的常用方法。其基本理念是每个粒子被n个晶胞所共用,则该粒子有1/n属于这个晶胞。
【归纳小结】
(1)长方体(含正方体)晶胞中不同位置的粒子数的计算(如下图)
晶胞内位置:1×1=1
棱上位置:12× =3
4
1
氯化钠的一个晶胞的钠离子数=12× +1×1=4
4
1
氯化钠的一个晶胞的氯离子数=8× +6× =4
2
1
8
1
晶胞中钠离子和氯离子的个数比是 1∶1
练习1、下图所示是NaCl的晶胞,它含有几个钠离子和氯离子?晶胞中钠离子和氯离子的个数比是多少?
Cl-
Na+
练习2、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体可能的化学式为______。
1:1
C2D
EF
XY3Z
练习3、下图为高温超导领域的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
1)在该物质的晶体中,每个钛离子周围与它最接近且距离相等的钛离子共有 个
2)该晶体结构单元中,氧、钛、钙离子的个数比是 。
6
3∶1∶1
Ti
O
Ca
O:12×1/4=3
Ti: 8 ×1/8=1
Ca:1
思考与讨论(1)晶胞有几套平行棱?有几套平行面?
晶胞有3套平行棱,有3套平行面?
1.金属钠的一个晶胞的原子数=
2.金属锌的一个晶胞的原子数=
3.碘的一个晶胞的原子数=
思考与讨论(2)
下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子?
金刚石:8×1/8+6×1/2+4=8。
(2)六方晶胞中粒子的计算方法
顶角:1/6
上、下棱:1/4
侧棱:1/3
面上:1/2
内部1
(3)正三棱柱晶胞中粒子的计算方法
不
顶点:1/12
侧棱:1/6
内部:1
上下棱:1/4
练习4、2001年报道的硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如图所示的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为( )
A、MgB
B、 MgB2
C、Mg2B
D、Mg3B2
Mg原子的数目:
12×1/6+2×1/2=3
B原子的数目:6
故化学式可表示为:MgB2
B
练习6、如图所示的晶体中,A、B、C三种粒子数之比
是 。
1:4:2
练习7、话筒是声电转换的换能器,在话筒中有一种材料的结构如图所示,它的主要成分是钛酸钡,根据晶胞的结构示意图,可知它的化学式是( )
A.BaTi8O12 B.BaTi4O6
C.BaTi2O4 D.BaTiO3
解析:仔细观察钛酸钡晶胞的结构示意图可知:Ba在立方体的体心,完全属于该晶胞;Ti处于立方体的8个顶点,O处于立方体的12条棱的中点,故晶胞中Ba、Ti、O三种原子的个数比为
D
练习8、某晶体结构模型如图所示。该晶体的化学式是__________________,在晶体中1个Ti原子、1个Co原子周围距离最近的O原子数目分别为________个。
解析:晶胞中含有O:6× =3个,含Co:8× =1个,含Ti:1个,故化学式为CoTiO3。
Ti原子位于晶胞的中心,其周围距离最近的O原子位于6个面的中心,所以周围距
离最近的O原子数目为6个;Co原子位于晶胞的顶点,O原子位于晶胞的面心,所以
Co原子周围距离最近的O原子数目为12个。
练习9、如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
(1)在该物质的晶体中,每个钛离子周围与它最接近的
且等距离的钛离子共有 个。
(2)该晶体中,元素氧、钛、钙的粒子个数比是 。
6
3∶1∶1
解析:回答第(1)小题要注意发挥空间想象力,在晶胞的上、下、左、右、前、后都有完全等同的晶胞,依据一个晶胞我们能观察到3个与钛离子最接近且等距离的钛离子,在与这3个钛离子相反的位置还有3个钛离子,所以共有6个钛离子。对于第(2)小题我们可以使用均摊法求得
练习10、科学家发现一种由钛原子和碳原子构成的气态团簇分子,如图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.TiC B.Ti6C7 C.Ti14C13 D.Ti13C14
D
若该图是一个晶胞,则这种计算正确,但它是一个气态团簇分子,其化学式就是其分子式,应直接数出原子数。
小结:团簇分子或纳米颗粒中,所含微粒为其本身所有,不与其他分子或颗粒共用。
练习10、某离子晶体晶胞结构如右图所示,X位于立方体的顶点, Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角∠XYX的角度为:
A. 90° B. 60° C. 120° D. 109°28′
5、晶体微粒与M、ρ之间的换算
ρ = m/V
根据晶胞结构确定各种粒子的数目
根据晶胞的边长或微粒间的距离
晶胞质量
晶胞体积
求
求
练习1、某晶体的立方体晶胞如下图,计算其密度
1mol该晶胞的体积:
边长a pm
摩尔质量为M g/mol
NA×(a×10-10)3 cm3
1mol该晶胞的质量:
M g
该晶胞的密度:
练习2.如图是CsCl晶体的晶胞,已知晶体中2个最近的Cs+核间距离为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则CsCl晶体的密度为( )g/cm3 。
A、8M/a3NA B、a3M/8NA
C、M/a3NA D、a3M/NA
顶点-Cs+ 中心-Cl﹣
C
练习3、ZnS在荧光体颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,则该晶体密度为
g·cm-3(列式不必计算,ZnS相对分子质量为97)。
1m=103mm=106um=109nm=1012pm
ρ=
4×97
(540×10-10)3·NA
练习4、(2020·天津等级考)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为______g·cm-3。铁、钴、镍三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为 。
解析:该晶胞中Co2+个数为12× +1=4,O2-个数为8× +6× =4,晶胞质量为
晶胞体积为(a×10-7 cm)3,故晶体的密度为 ÷(a
×10-7cm)3= g·cm-3。三种元素二价氧化物均为离子晶体,由于离子半
径:Fe2+>Co2+>Ni2+,则晶格能:NiO>CoO>FeO,故熔点:NiO>CoO>FeO。
NiO>CoO>FeO
练习1、若CaTiO3的相对分子质量为M,密度为 A g/cm3,阿伏加德罗常数为NA,则晶体中钙离子与钛离子之间的最短距离为_______。
6、计算晶胞微粒间的距离
练习2、测知氯化钠晶体中相邻的Na+与Cl-的距离为a cm,该晶体密度为d g·cm-3,则阿伏加德罗常数可表示为 ( )
C
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体。具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性。普通晶体只能具有二次、三次、四次或六次旋转对称性,但是准晶的布拉格衍射图具有其他的对称性,例如五次对称性或者更高的如六次以上的对称性。获得2011年诺贝尔化学奖的丹·舍特曼是第一个正式报道发现了准晶的人。1984年他和以色列理工学院的同事们在快速冷却的铝锰合金中发现了一种新的金属相,其电子衍射斑具有明显的五次对称性。准晶体具有独特的属性,其坚硬又有弹性、非常平滑,而且,与大多数金属不同的是,其导电、导热性很差,在日常生活中可用来制造不粘锅、发光二极管、热电转化设备等。
【探究] 准晶
四、晶体结构的测定
1.X射线衍射原理
单一波长的X射线通过晶体时,X射线和晶体中的电子相互作用,会在记录仪上产生分立的斑点或明锐的衍射峰。
X射线衍射仪
非晶态和晶态二氧化硅粉末X射线衍射图谱的对比
2.X射线衍射实验获得晶胞信息
A、晶胞的形状和大小
B、分子或原子在微观空间有序排列的对称性
C、原子在晶胞里的数目和位置
D、结合晶体化学组成的信息推出原子间的相互关系
3.X射线衍射实验获得分子信息
通过晶体X射线衍射实验,可以测定晶胞中各个原子的位置(坐标),根据原子坐标,可以计算原子间的距离,判断哪些原子之间存在化学键,确定键长和键角,得出分子的空间结构。
乙酸晶体
乙酸晶胞
乙酸分子的空间结构
练习1、下列有关说法正确的是( )
A.测定晶体结构最常用的仪器是X射线衍射仪
B.石英玻璃和水晶的衍射图谱相同
C.通过乙酸晶体的X射线衍射实验,只能测定晶胞中含有的乙酸分子数,不能推出乙酸分子的空间结构
D.晶体的X射线衍射实验不能判断晶体中存在哪些化学键,也不能确定键长和键角
A
石英玻璃是非晶态二氧化硅,水晶是晶态的二氧化硅
练习2、(双选)晶体是一类非常重要的材料,在很多领域都有广泛的应用。下列对晶体硅的叙述正确的是( )
A.形成晶体硅的速率越快越好
B.晶体硅有固定的熔点
C.可用X射线衍射实验来鉴别晶体硅和玻璃
D.粉末状的固体一定不是晶体
答案:BC
解析:A选项,晶体的形成都有一定的条件,如温度、压强、结晶速率等,并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,A项说法错误;晶体有固定的熔点,B选项说法正确;X射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列就能区分晶体与非晶体,C选项说法正确;粉末状的固体也可能是晶体,在光学显微镜下可以观察到晶体的规则外形,D项说法错误。
练习3、因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同,对铁晶体用X射线衍射进行测定,测得A、B两种晶胞,其晶胞结构示意图如下:
则A、B两种晶胞中含有的铁原子数分别是:____、____。
2
4
