3.2.1醇 酚 课件 (共38张PPT)2022-2023学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.2.1醇 酚 课件 (共38张PPT)2022-2023学年高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 00:00:00 | ||
图片预览





文档简介
(共38张PPT)
第三章 烃的衍生物
第二节 醇 酚
第1课时
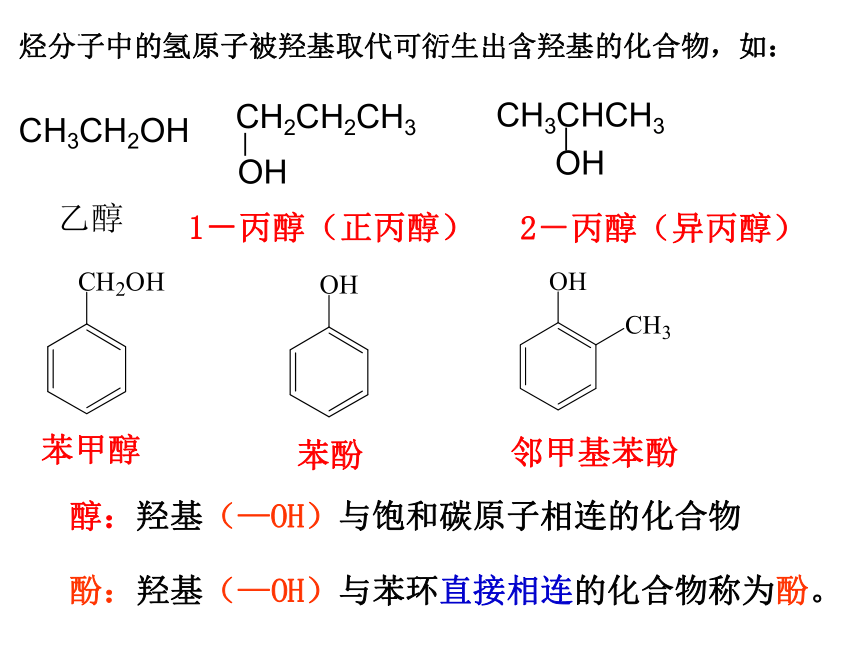
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
CH3CH2OH
乙醇
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
醇:羟基(—OH)与饱和碳原子相连的化合物
酚:羟基(—OH)与苯环直接相连的化合物称为酚。
1、命名
(2)编号位
(1)选主链
(3)写名称
选含—OH所连碳在内的最长碳链为主链,称某醇。
从离—OH最近的一端起编号
取代基位置→ 取代基名称 → 羟基位置→
母体名称(羟基的数目用“二”、“三”等表示,写在“醇”字前面。)
一、醇
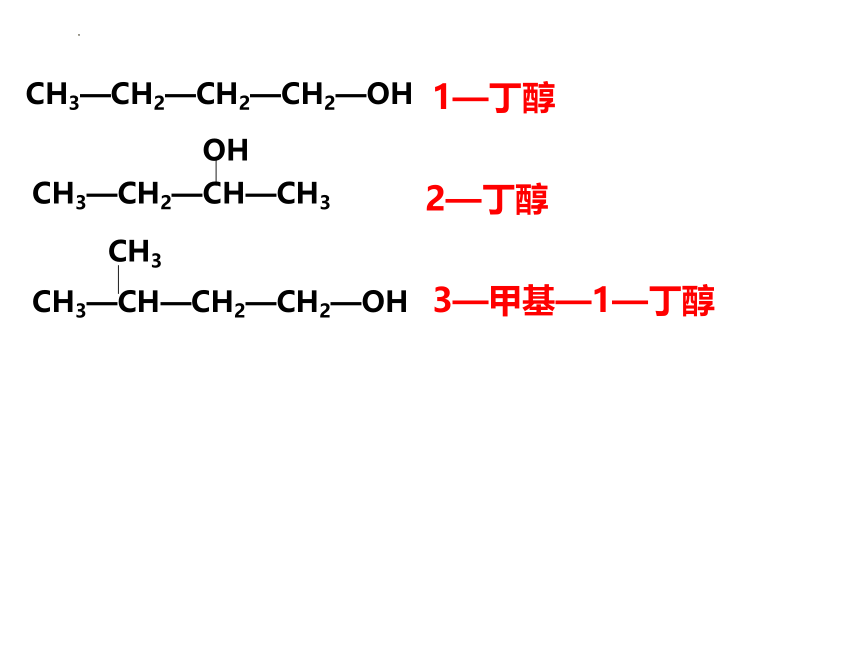
CH3—CH—CH2—CH2—OH
CH3
3—甲基—1—丁醇
CH3—CH2—CH—CH3
OH
2—丁醇
CH3—CH2—CH2—CH2—OH
1—丁醇
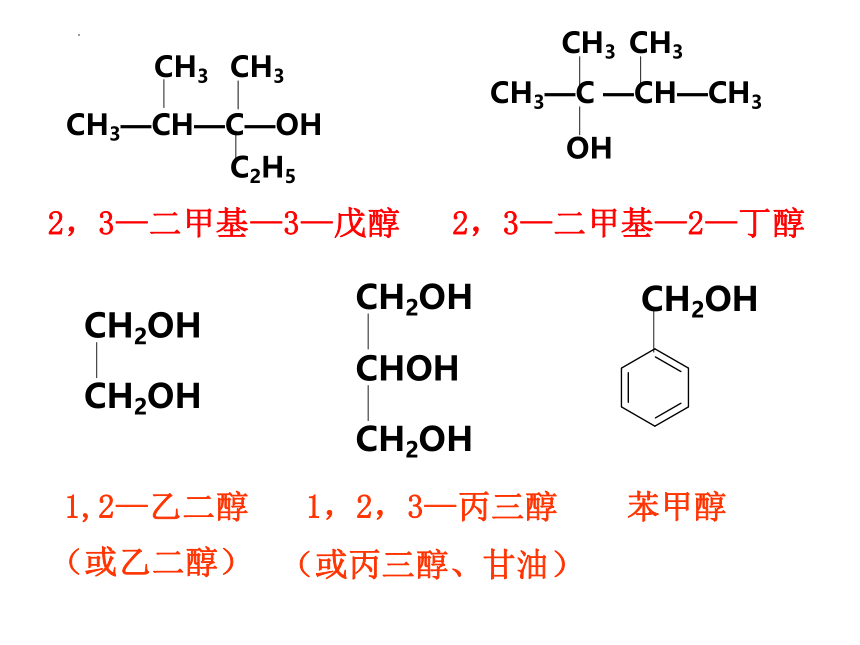
CH2OH
苯甲醇
CH2OH
CH2OH
(或乙二醇)
CH2OH
CH2OH
CHOH
1,2,3—丙三醇
(或丙三醇、甘油)
1,2—乙二醇
CH3—CH—C—OH
CH3
C2H5
CH3
2,3—二甲基—3—戊醇
2,3—二甲基—2—丁醇
CH3—C —CH—CH3
CH3
OH
CH3
2、醇的分类
一元醇:只含一个羟基的醇。
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
如甲醇、乙醇
二元醇:含两个羟基的醇。如乙二醇
多元醇:含两个以上羟基的醇。如丙三醇
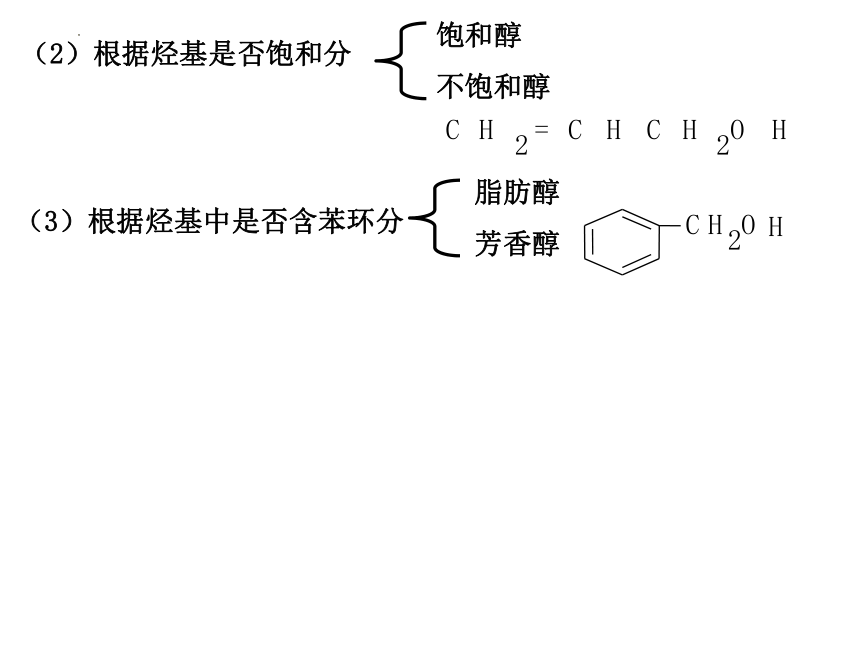
(1)根据分子内所含羟基的数目不同分
(2)根据烃基是否饱和分
饱和醇
不饱和醇
(3)根据烃基中是否含苯环分
脂肪醇
芳香醇
C
H
2
=
C
H
C
H
2
O
H
C
H
2
O
H
3、几种典型的醇
(1)甲醇(CH3OH)是无色、有挥发性的液体、易溶于水,沸点65℃。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛用于化工生产,也可作车用燃料。
(2)乙二醇和丙三醇都是无色粘稠的液体,都易溶于水和乙醇,
是重要的化工原料。
乙二醇可做汽车防冻剂
丙三醇配制化妆品
吸湿性,护肤
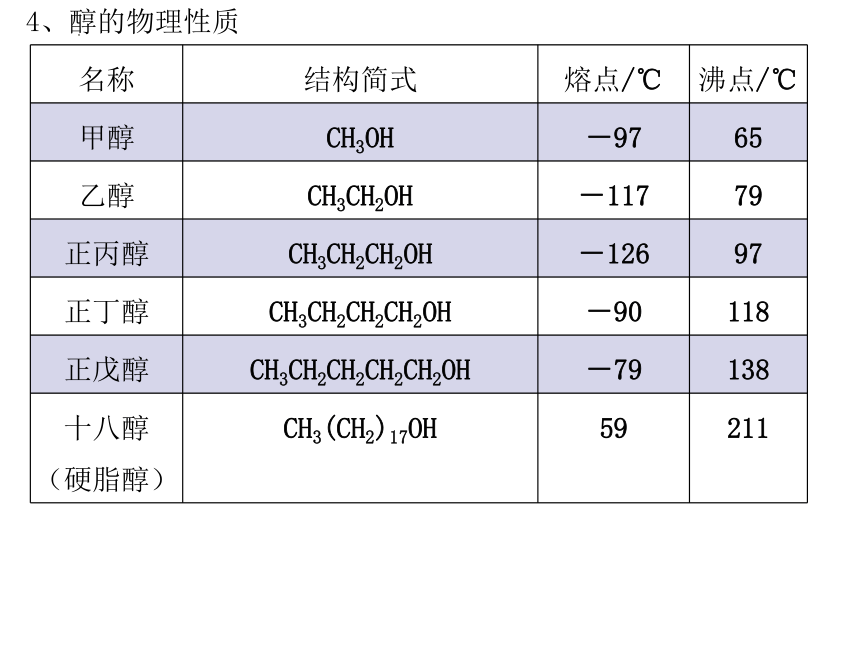
4、醇的物理性质
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
表3-3列举了几种相对分子质量相近的醇与烷经的沸点。请仔细阅读并对比表格中的数据,你能得出什么结论
名 称 结构简式 相对分子质量 沸点/℃
甲 烷 CH4 16 -161.5
甲 醇 CH3OH 32 65
乙 烷 C2H6 30 -89
乙 醇 C2H5OH 46 78
丙 烷 C3H8 44 -42
丙 醇 C3H7OH 60 97
正 丁 烷 C4H10 58 -0.5
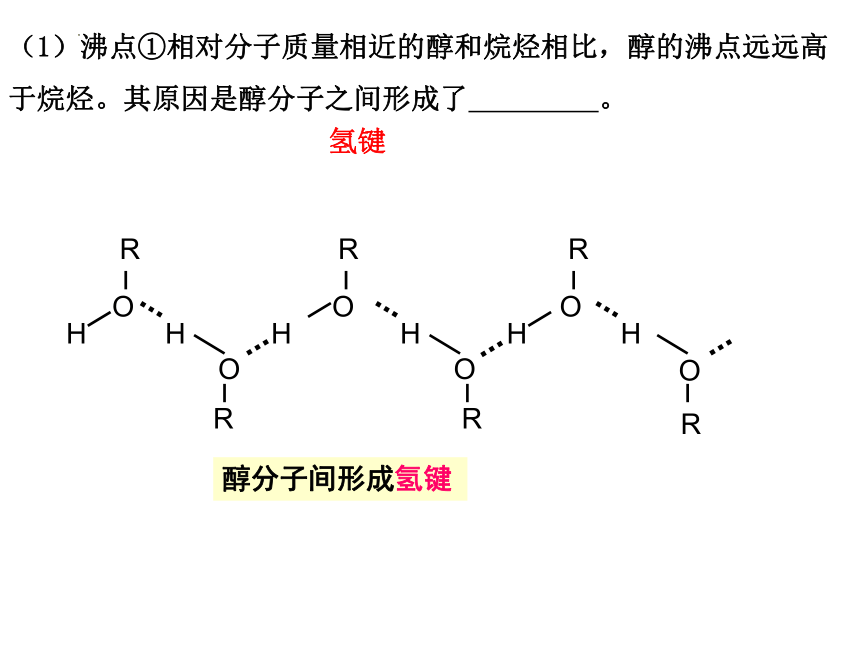
(1)沸点①相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。其原因是醇分子之间形成了 。
氢键
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
醇分子间形成氢键
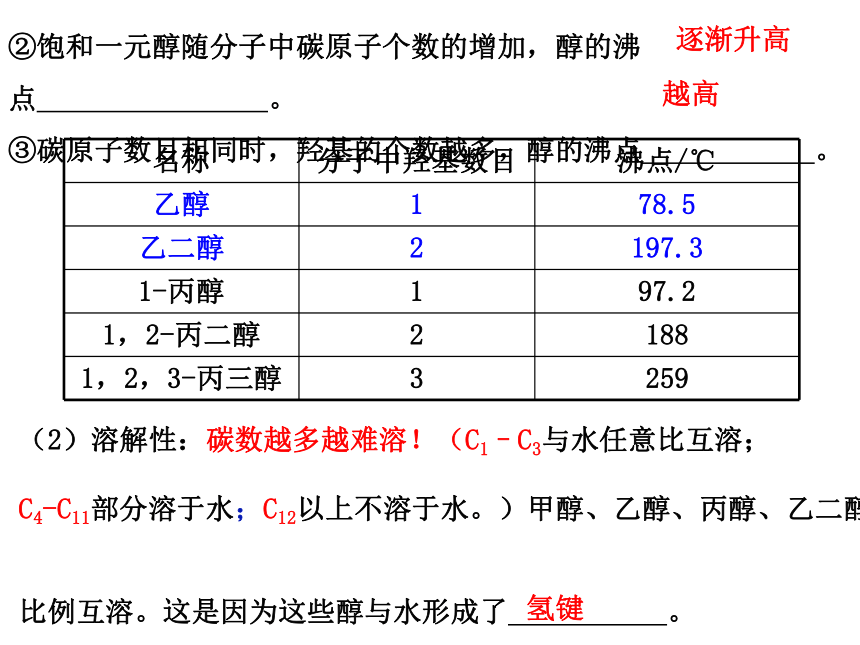
②饱和一元醇随分子中碳原子个数的增加,醇的沸点 。
③碳原子数目相同时,羟基的个数越多,醇的沸点 。
逐渐升高
越高
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
(2)溶解性:碳数越多越难溶!(C1–C3与水任意比互溶;
C4-C11部分溶于水;C12以上不溶于水。)甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意
比例互溶。这是因为这些醇与水形成了 。
氢键
练习1、下列物质的沸点按照由高到低的顺序排列正确的是( )
①丙三醇 ②丙烷 ③乙二醇 ④乙醇
A. ① ② ③ ④ B. ④ ③ ② ①
C. ① ③ ④ ② D. ① ③ ② ④
C
5、醇的结构(以乙醇为例)
乙醇分子的空间填充模型
乙醇的核磁共振氢谱
乙醇分子的球棍模型
H—C—C—O—H
H
H
H
H
决定醇的化学性质
醇的化学性质主要由羟基官能团所决定
(1)在醇分子中,氧原子吸引电子的能力比氢原子和碳原子的强,
使O—H和C—O的电子都向氧原子偏移。
(2)醇在发生反应时, O—H容易断裂,使羟基中的氢原子被取代
(3)C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
图示:CH3CH2—O—H
练习2、向甲醇、乙二醇、丙三醇中分别加入足量的金属钠后收集到等体积的氢气(相同条件),则上述三种醇的物质的量之比为( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
6. 醇的化学性质(以乙醇为例)
(1)置换反应
2CH3CH2OH + 2Na → 2CH3CH2ONa﹢H2↑
乙醇钠
现象:缓慢产生气泡,金属钠沉于底部或上下浮动。
剧烈程度不如水!!!
乙醇羟基上的氢原子没有水中的氢原子活泼
醇可以与氢卤酸发生取代反应生成卤代烃和水。反应时醇分子中的C—O断裂,卤素原子取代了羟基而生成卤代烃。
乙醇与浓氢溴酸混合加热后发生取代反应,生成溴乙烷,
这是制备溴乙烷的方法之一。
CH3CH2OH+HBr CH3CH2Br+H2O
△
(2)取代反应:
a.与浓氢溴酸反应
乙醇 氯乙烷:
CH3CH2—Cl+NaOH CH3CH2—OH+NaCl
水
△
CH3CH2—OH+H—Cl CH3CH2—Cl+H—OH
△
氯乙烷 乙醇:
碱性条件、—X被—OH取代
酸性条件、—OH被—X取代
建立模型:
卤代烷
醇
b.酯化反应
CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
浓硫酸
△
酯化反应的实质是:
酸脱羟基,醇脱羟基上的氢,酯化反应能进行
c.分子间脱水生成醚
乙醇和浓硫酸的混合物的温度控制在140℃左右,乙醇将以另一种方式脱水,即每两个乙醇分子间会脱去一个水分子而生成乙醚。
C2H5OH+C2H5OH C2H5OC2H5+H2O
140℃
浓硫酸
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用
乙醚微溶于水,易溶于有机溶剂
乙醚本身是一种优良溶剂,能溶解多种有机物
3.消去反应(分子内脱水成烯)
乙醇在浓硫酸的作用下,加热至170℃时生成乙烯,
反应方程式为
反应时乙醇分子断的键是C—H与C—O。
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
H C C O H
H
H
H
H
C=C
H
H
H
H
断键位置:
脱去 —OH 和与 —OH 相邻的碳原子上的1个H
【演示实验3-2】
在圆底烧瓶中加入乙醇和液硫酸(体积比约为1:3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸。
加热混合液,使液体温度迅速升到170℃,
将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
注意事项:
(1)向烧瓶中加入反应物的正确顺序是:
先加乙醇(1体积)再慢慢注入浓H2SO4(3体积),类似于浓硫酸的稀释。
(2)加热时应迅速升到170℃,因140℃时发生副反应:
2CH3CH2OH CH3CH2OCH2CH3+H2O。
浓H2SO4
140℃
因此温度计的位置应置于反应物的中央位置。
(3)浓硫酸的作用:
催化剂和脱水剂
(4)在加热过程中,混合液的颜色由无色逐渐变成棕色,甚至变成黑色,其原因是:
CH3CH2OH+2H2SO4(浓) 2C+2SO2↑+5H2O
△
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
△
所以制取的乙烯中还可能混有CO2 、SO2等杂质气体。
原因: 1.乙烯能使溴的CCl4溶液褪色;
2.乙烯能使酸性KMnO4溶液褪色;
3.点燃纯净的乙烯,燃烧,火焰明亮伴有黑烟。
溴的CCl4溶液
或KMnO4溶液
品红
溶液
烧碱
溶液
品红
溶液
反应完,应先熄灭酒精灯还是先把导管从水槽中移出
产生的混合气体
检验SO2
吸收SO2
证明SO2
被吸收完全
检验乙烯
先把导管从水槽中移出再熄灭酒精灯。
点燃
思考:如何检验刺激性气味的气体
特别提醒:
4.氧化反应
①燃烧:
【演示实验3-3]
2CO2 +3H2O
C2H5OH +3 O2
点燃
重铬酸钾由橙色变为绿色
Cr2O72-(H+):橙色→Cr3+绿色(检验酒驾)
②与强氧化剂反应:
乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
CH3CH2OH CH3CHO CH3COOH
KMnO4(H+):紫色→无色——直接被氧化成乙酸
若加入酸性KMnO4溶液
③催化氧化:
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
醇能否被氧化以及被氧化的产物的类别,取决于与羟基相连的碳原子上的氢原子的个数
本碳有氢
练习3、写出下列有机物催化氧化的反应方程式:
CH3CH2CH2OH
CH3CH(OH)CH3
2 + O2 → CH3CH2C-H + H2O
=
O
Cu
△
2 + O2 → CH3-C-CH3 + H2O
=
O
Cu
△
有机化合物分子中失去氢原子或加入氧原子的反应叫做氧化反应。
(加氧或去氢)
有机化合物分子中加入氢原子或失去氧原子的反应叫做还原反应。(加氢或去氧)
练习5、下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是( )
A.CH3OH B.CH2OHCH2CH3
C.(CH3)3 COH D.(CH3)2COHCH2CH3
B
练习4、丙烯醇(CH2=CHCH2OH)可发生的化学反应有 ( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.只有①②③ B.只有①②③④
C.①②③④⑤ D.只有①③④
C
断裂①
CH3CH2ONa
CH3COOCH2CH3
断裂②
C2H5Br
断裂①③
CH3CHO
醇的化学性质总结(以乙醇为例)
CH3CH2OCH2CH3
断裂①②
断裂②④
CH2=CH2
取代反应
消去反应
氧化反应
置换反应
资料卡片:在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
乙醛脱氢酶
乙醇脱氢酶
醉酒
乙醇脱氢酶
不醉酒
缺少乙醛脱氢酶
第三章 烃的衍生物
第二节 醇 酚
第1课时
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
CH3CH2OH
乙醇
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
醇:羟基(—OH)与饱和碳原子相连的化合物
酚:羟基(—OH)与苯环直接相连的化合物称为酚。
1、命名
(2)编号位
(1)选主链
(3)写名称
选含—OH所连碳在内的最长碳链为主链,称某醇。
从离—OH最近的一端起编号
取代基位置→ 取代基名称 → 羟基位置→
母体名称(羟基的数目用“二”、“三”等表示,写在“醇”字前面。)
一、醇
CH3—CH—CH2—CH2—OH
CH3
3—甲基—1—丁醇
CH3—CH2—CH—CH3
OH
2—丁醇
CH3—CH2—CH2—CH2—OH
1—丁醇
CH2OH
苯甲醇
CH2OH
CH2OH
(或乙二醇)
CH2OH
CH2OH
CHOH
1,2,3—丙三醇
(或丙三醇、甘油)
1,2—乙二醇
CH3—CH—C—OH
CH3
C2H5
CH3
2,3—二甲基—3—戊醇
2,3—二甲基—2—丁醇
CH3—C —CH—CH3
CH3
OH
CH3
2、醇的分类
一元醇:只含一个羟基的醇。
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
如甲醇、乙醇
二元醇:含两个羟基的醇。如乙二醇
多元醇:含两个以上羟基的醇。如丙三醇
(1)根据分子内所含羟基的数目不同分
(2)根据烃基是否饱和分
饱和醇
不饱和醇
(3)根据烃基中是否含苯环分
脂肪醇
芳香醇
C
H
2
=
C
H
C
H
2
O
H
C
H
2
O
H
3、几种典型的醇
(1)甲醇(CH3OH)是无色、有挥发性的液体、易溶于水,沸点65℃。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛用于化工生产,也可作车用燃料。
(2)乙二醇和丙三醇都是无色粘稠的液体,都易溶于水和乙醇,
是重要的化工原料。
乙二醇可做汽车防冻剂
丙三醇配制化妆品
吸湿性,护肤
4、醇的物理性质
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
表3-3列举了几种相对分子质量相近的醇与烷经的沸点。请仔细阅读并对比表格中的数据,你能得出什么结论
名 称 结构简式 相对分子质量 沸点/℃
甲 烷 CH4 16 -161.5
甲 醇 CH3OH 32 65
乙 烷 C2H6 30 -89
乙 醇 C2H5OH 46 78
丙 烷 C3H8 44 -42
丙 醇 C3H7OH 60 97
正 丁 烷 C4H10 58 -0.5
(1)沸点①相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃。其原因是醇分子之间形成了 。
氢键
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
醇分子间形成氢键
②饱和一元醇随分子中碳原子个数的增加,醇的沸点 。
③碳原子数目相同时,羟基的个数越多,醇的沸点 。
逐渐升高
越高
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
(2)溶解性:碳数越多越难溶!(C1–C3与水任意比互溶;
C4-C11部分溶于水;C12以上不溶于水。)甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意
比例互溶。这是因为这些醇与水形成了 。
氢键
练习1、下列物质的沸点按照由高到低的顺序排列正确的是( )
①丙三醇 ②丙烷 ③乙二醇 ④乙醇
A. ① ② ③ ④ B. ④ ③ ② ①
C. ① ③ ④ ② D. ① ③ ② ④
C
5、醇的结构(以乙醇为例)
乙醇分子的空间填充模型
乙醇的核磁共振氢谱
乙醇分子的球棍模型
H—C—C—O—H
H
H
H
H
决定醇的化学性质
醇的化学性质主要由羟基官能团所决定
(1)在醇分子中,氧原子吸引电子的能力比氢原子和碳原子的强,
使O—H和C—O的电子都向氧原子偏移。
(2)醇在发生反应时, O—H容易断裂,使羟基中的氢原子被取代
(3)C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
图示:CH3CH2—O—H
练习2、向甲醇、乙二醇、丙三醇中分别加入足量的金属钠后收集到等体积的氢气(相同条件),则上述三种醇的物质的量之比为( )
A.2∶3∶6 B.3∶2∶1
C.4∶3∶1 D.6∶3∶2
D
6. 醇的化学性质(以乙醇为例)
(1)置换反应
2CH3CH2OH + 2Na → 2CH3CH2ONa﹢H2↑
乙醇钠
现象:缓慢产生气泡,金属钠沉于底部或上下浮动。
剧烈程度不如水!!!
乙醇羟基上的氢原子没有水中的氢原子活泼
醇可以与氢卤酸发生取代反应生成卤代烃和水。反应时醇分子中的C—O断裂,卤素原子取代了羟基而生成卤代烃。
乙醇与浓氢溴酸混合加热后发生取代反应,生成溴乙烷,
这是制备溴乙烷的方法之一。
CH3CH2OH+HBr CH3CH2Br+H2O
△
(2)取代反应:
a.与浓氢溴酸反应
乙醇 氯乙烷:
CH3CH2—Cl+NaOH CH3CH2—OH+NaCl
水
△
CH3CH2—OH+H—Cl CH3CH2—Cl+H—OH
△
氯乙烷 乙醇:
碱性条件、—X被—OH取代
酸性条件、—OH被—X取代
建立模型:
卤代烷
醇
b.酯化反应
CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
浓硫酸
△
酯化反应的实质是:
酸脱羟基,醇脱羟基上的氢,酯化反应能进行
c.分子间脱水生成醚
乙醇和浓硫酸的混合物的温度控制在140℃左右,乙醇将以另一种方式脱水,即每两个乙醇分子间会脱去一个水分子而生成乙醚。
C2H5OH+C2H5OH C2H5OC2H5+H2O
140℃
浓硫酸
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用
乙醚微溶于水,易溶于有机溶剂
乙醚本身是一种优良溶剂,能溶解多种有机物
3.消去反应(分子内脱水成烯)
乙醇在浓硫酸的作用下,加热至170℃时生成乙烯,
反应方程式为
反应时乙醇分子断的键是C—H与C—O。
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
H C C O H
H
H
H
H
C=C
H
H
H
H
断键位置:
脱去 —OH 和与 —OH 相邻的碳原子上的1个H
【演示实验3-2】
在圆底烧瓶中加入乙醇和液硫酸(体积比约为1:3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸。
加热混合液,使液体温度迅速升到170℃,
将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
注意事项:
(1)向烧瓶中加入反应物的正确顺序是:
先加乙醇(1体积)再慢慢注入浓H2SO4(3体积),类似于浓硫酸的稀释。
(2)加热时应迅速升到170℃,因140℃时发生副反应:
2CH3CH2OH CH3CH2OCH2CH3+H2O。
浓H2SO4
140℃
因此温度计的位置应置于反应物的中央位置。
(3)浓硫酸的作用:
催化剂和脱水剂
(4)在加热过程中,混合液的颜色由无色逐渐变成棕色,甚至变成黑色,其原因是:
CH3CH2OH+2H2SO4(浓) 2C+2SO2↑+5H2O
△
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
△
所以制取的乙烯中还可能混有CO2 、SO2等杂质气体。
原因: 1.乙烯能使溴的CCl4溶液褪色;
2.乙烯能使酸性KMnO4溶液褪色;
3.点燃纯净的乙烯,燃烧,火焰明亮伴有黑烟。
溴的CCl4溶液
或KMnO4溶液
品红
溶液
烧碱
溶液
品红
溶液
反应完,应先熄灭酒精灯还是先把导管从水槽中移出
产生的混合气体
检验SO2
吸收SO2
证明SO2
被吸收完全
检验乙烯
先把导管从水槽中移出再熄灭酒精灯。
点燃
思考:如何检验刺激性气味的气体
特别提醒:
4.氧化反应
①燃烧:
【演示实验3-3]
2CO2 +3H2O
C2H5OH +3 O2
点燃
重铬酸钾由橙色变为绿色
Cr2O72-(H+):橙色→Cr3+绿色(检验酒驾)
②与强氧化剂反应:
乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
CH3CH2OH CH3CHO CH3COOH
KMnO4(H+):紫色→无色——直接被氧化成乙酸
若加入酸性KMnO4溶液
③催化氧化:
2Cu + O2 2CuO 红色变为黑色
△
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
黑色变为红色,产生有刺激性气味的液体。
醇能否被氧化以及被氧化的产物的类别,取决于与羟基相连的碳原子上的氢原子的个数
本碳有氢
练习3、写出下列有机物催化氧化的反应方程式:
CH3CH2CH2OH
CH3CH(OH)CH3
2 + O2 → CH3CH2C-H + H2O
=
O
Cu
△
2 + O2 → CH3-C-CH3 + H2O
=
O
Cu
△
有机化合物分子中失去氢原子或加入氧原子的反应叫做氧化反应。
(加氧或去氢)
有机化合物分子中加入氢原子或失去氧原子的反应叫做还原反应。(加氢或去氧)
练习5、下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是( )
A.CH3OH B.CH2OHCH2CH3
C.(CH3)3 COH D.(CH3)2COHCH2CH3
B
练习4、丙烯醇(CH2=CHCH2OH)可发生的化学反应有 ( )
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.只有①②③ B.只有①②③④
C.①②③④⑤ D.只有①③④
C
断裂①
CH3CH2ONa
CH3COOCH2CH3
断裂②
C2H5Br
断裂①③
CH3CHO
醇的化学性质总结(以乙醇为例)
CH3CH2OCH2CH3
断裂①②
断裂②④
CH2=CH2
取代反应
消去反应
氧化反应
置换反应
资料卡片:在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
乙醛脱氢酶
乙醇脱氢酶
醉酒
乙醇脱氢酶
不醉酒
缺少乙醛脱氢酶
