人教版(2019)必修一 1.3.1 氧化还原反应 课件(共26张PPT)
文档属性
| 名称 | 人教版(2019)必修一 1.3.1 氧化还原反应 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 803.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 16:15:42 | ||
图片预览






文档简介
(共26张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应
切开的苹果其表面的颜色会逐渐变深
喝红酒之前要先把红酒倒入醒酒器中,敞口放置一段时间,喝起来更加绵柔滑润,更加可口
情景导入
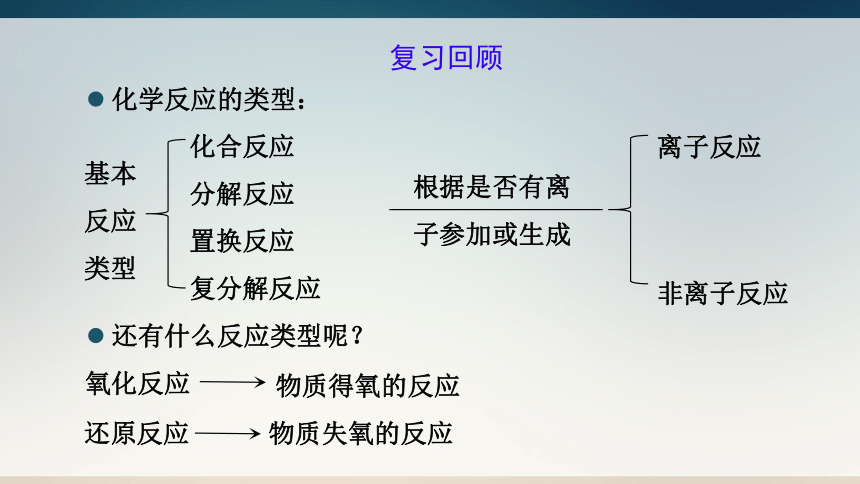
化合反应
分解反应
置换反应
复分解反应
基本反应类型
离子反应
非离子反应
根据是否有离
子参加或生成
氧化反应
还原反应
物质得氧的反应
物质失氧的反应
复习回顾
化学反应的类型:
还有什么反应类型呢?
反应 得氧物质 反应类型
C + 2CuO 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
初中从得失氧的角度来定义氧化反应和还原反应(有物质得氧的同时一定有物质失氧,即氧化反应和还原反应应该在一个反应中同时发生,这就是氧化还原反应),请同学们根据这个定义填写下表:
氧化还原反应
标出上表两个反应中各物质所含元素的化合价,比较反应前后化合价有无变化。
反应中元素的化合价有变化
0 +2 -2 0 +4 -2
+3 -2 +2 -2 0 +4 -2
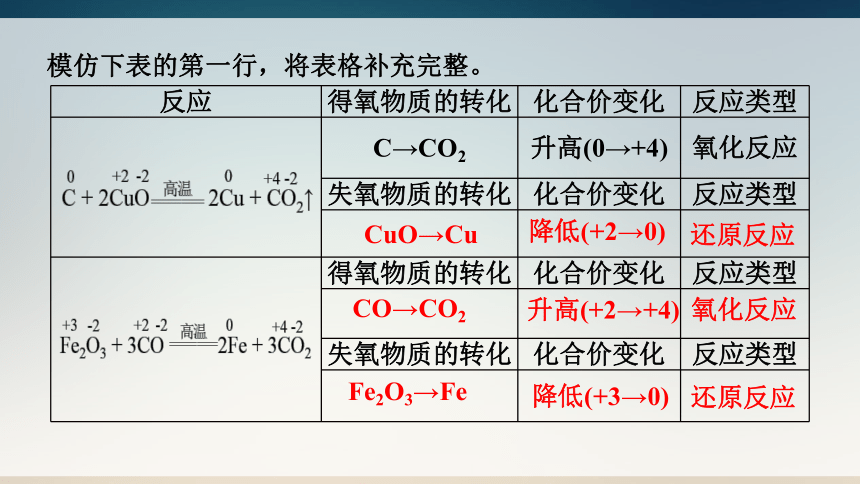
反应 得氧物质的转化 化合价变化 反应类型
C→CO2 升高(0→+4) 氧化反应
失氧物质的转化 化合价变化 反应类型
得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
模仿下表的第一行,将表格补充完整。
CuO→Cu
降低(+2→0)
还原反应
CO→CO2
升高(+2→+4)
氧化反应
Fe2O3→Fe
降低(+3→0)
还原反应
1. 氧化反应和还原反应:
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
练习:判断下列过程是氧化反应还是还原反应:
(1)Cu→CuO ( )(2)Cu→CuCl2 ( )
(3)N2→NH3 ( )(4)FeCl2→FeCl3( )
氧化反应
氧化反应
氧化反应
还原反应
0 +2
0 +2
+2 +3
0 -3
氧化还原反应
2. 氧化还原反应:元素化合价发生变化的反应
反应中一定同时存在元素化合价的升高与降低
氧化还原反应
非氧化还原反应
根据是否有
化合价变化
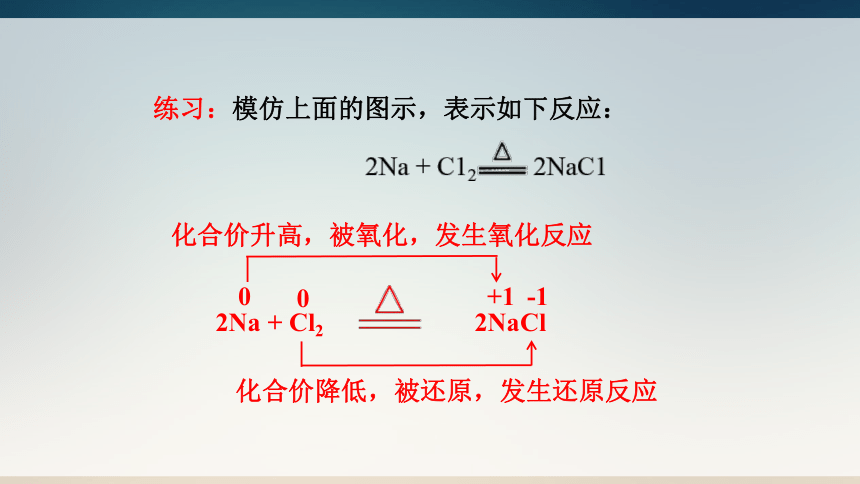
练习:模仿上面的图示,表示如下反应:
0
+1
化合价升高,被氧化,发生氧化反应
-1
0
化合价降低,被还原,发生还原反应
2Na + Cl2 2NaCl
练习:下列反应中,属于非氧化还原反应的是 ( )
A.Cl2+2KOH==KCl+KClO+H2O
B.3NO2+H2O==2HNO3+NO
C.Na2O2+SO2==Na2SO4
D.2NaHCO3 Na2CO3+CO2↑+H2O
0
-1
+1
氧化还原反应
+4
+5
+2
氧化还原反应
-1
+4
-2
氧化还原反应
+6
+1 +1+4 -2
+1 +4 -2
+4 -2
+1 -2
非氧化还原反应
D
练习:下列反应转化关系(未配平)肯定不正确的是 ( )
A.S+KOH→K2SO3+K2S+H2O
B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu2O+H2SO4→CuSO4+Cu+H2O
D.NH4NO3→N2O+H2O
0
氧化还原反应中一定同时存在元素化合价的升高与降低
+4
-2
+2
+3
+1
+2
0
-3
+5
+1
无化合价降低
B
红酒与氧气充分接触,使某些化学物质被氧化,从而使口感更柔和
切开的苹果中的某些化学物质与空气中的氧气接触,该化学物质被氧化,颜色发生了变化
3. 氧化还原反应的本质:
0
+1
-1
0
2Na + Cl2 2NaCl
Na+ Cl-
Na
Na+
0
+1
失去最外
层1个电子
Na失去的电子去哪里了?
给了Cl原子
Cl
Cl-
0
-1
最外层得
到1个电子
Na原子的最外层只有1个电子,Cl原子的最外层有7个电子
●
Na
Cl
●●
●
●
●●
●
●●
●
●
●●
●
●
Cl-
Na+
还原反应
氧化反应
Cl原子得到Na原子失去的1个电子,转化为Cl-;Na失去最外层的1个电子转化为Na+
Na失电子,化合价升高,被氧化,发生氧化反应;Cl得电子,化合价降低,被还原,发生还原反应
反应的本质是电子的得失
4. 反应的电子得失可以进行如下的表示:
0
+1
失去2×e-,化合价升高,被氧化
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
反应中每个Na原子失去1个电子,一共有2个Na原子失电子,表示为失去2×e-,
反应中每个Cl原子得到1个电子,一共有2个Cl原子得电子,表示为得到2×e-,
0
+1
失去2×e-,化合价升高,被氧化
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
得失电子要用m×ne-的形式进行表示,其中m代表发生电子得失的原子个数,n代表每个原子得失的电子数(当m或n为1时要省略)
双线桥
练习:以上面的双线桥表示形式为例,对下面的反应进行双线桥分析:
(1)Zn + 2H+ == Zn2+ + H2↑
0
+2
失去2e-,化合价升高,被氧化
0
+1
得到2×e-,化合价降低,被还原
Zn + 2H+ == Zn2+ + H2↑
0
+1
失去2×e-,化合价升高,被氧化
-2
0
得到2e-,化合价降低,被还原
2K + S == K2S
练习:以上面的双线桥表示形式为例,对下面的反应进行双线桥分析:
(2)2K + S == K2S
有的电解质是以分子的形式存在的,既然该物质不是以离子形式存在的,那么形成该物质的过程发生的就不会是电子的转移,以H2和Cl2反应生成HCl为例,来分析此类物质形成过程中化合价变化的原因
该反应中H的化合价由0价升高到+1价,被氧化;Cl的化合价由0价降低到-1价,被还原。
以上过程中,元素化合价的变化是如何实现的呢?
H2 + C12 == 2HC1
0 0 +1-1
点燃
H原子的最外层只有1个电子,Cl原子的最外层有7个电子
●
H
Cl
●●
●
●
●●
●
两者各以最外层1个电子组成一个共用电子对。该电子对受到两个原子核的共同吸引,两个原子可以共同占有这1对电子,从而使两个原子都达到了稳定结构
H原子达到稳定结构
Cl原子达到稳定结构
H
Cl
●●
●
●
●●
●
●
氯原子吸引共用电子对的能力强于氢原子,共用电子对偏向于氯原子而偏离于氢原子,所以在HCl中H的化合价为+1,Cl的化合价为-1
+1
-1
化合价变化的原因是:发生了共用电子对的偏移
H
N
●●
●
●
根据上面的分析,同学们互相讨论回答下面的问题:NH3中N和H的化合价为什么分别是-3和+1?
●
●
●
H
●
H
H
N
●●
●
●
根据上面的分析,同学们互相讨论回答下面的问题:NH3中N和H的化合价为什么分别是-3和+1?
●
●
●
H
●
H
3个H原子中每个H原子都有1个共用电子对偏离,所以3个H都显+1价
NH3中N原子和H原子之间形成了3个共用电子对,其中3个共用电子对都偏向于N原子,所以N显-3价;
氧化还原反应的本质是电子的转移(电子得失或共用电子对偏移)。失电子(或电子对偏离),化合价升高,被氧化,发生氧化反应;得电子(或电子对偏向),化合价降低,被还原,发生还原反应。
氧化还原反应和之前学习的四个基本反应类型之间存在什么关系呢?如果以一个圆形表示氧化还原反应,同学们能不能画出四个基本反应类型与这个圆形的图示关系呢?
NaOH + HCl == NaCl + H2O
Zn + 2HCl == ZnCl2 + H2↑
氧化还原反应与四个基本反应类型的关系
CaO+ H2O == Ca(OH)2
2CO + O2 == 2CO2
点燃
2H2O == O2↑ + 2H2↑
通电
CaCO3== CaO + CO2↑
高温
小结
1. 氧化还原反应:有化合价变化的反应,其本质是电子的转移(电子得失或共用电子对的偏移)
2. 氧化反应:化合价升高的反应,失电子或共用电子对偏离。
3. 还原反应:化合价降低的反应,得电子或共用电子对偏向
4. 双线桥的表示:
0
+1
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
失去2×e-,化合价升高,被氧化
第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应
切开的苹果其表面的颜色会逐渐变深
喝红酒之前要先把红酒倒入醒酒器中,敞口放置一段时间,喝起来更加绵柔滑润,更加可口
情景导入
化合反应
分解反应
置换反应
复分解反应
基本反应类型
离子反应
非离子反应
根据是否有离
子参加或生成
氧化反应
还原反应
物质得氧的反应
物质失氧的反应
复习回顾
化学反应的类型:
还有什么反应类型呢?
反应 得氧物质 反应类型
C + 2CuO 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
初中从得失氧的角度来定义氧化反应和还原反应(有物质得氧的同时一定有物质失氧,即氧化反应和还原反应应该在一个反应中同时发生,这就是氧化还原反应),请同学们根据这个定义填写下表:
氧化还原反应
标出上表两个反应中各物质所含元素的化合价,比较反应前后化合价有无变化。
反应中元素的化合价有变化
0 +2 -2 0 +4 -2
+3 -2 +2 -2 0 +4 -2
反应 得氧物质的转化 化合价变化 反应类型
C→CO2 升高(0→+4) 氧化反应
失氧物质的转化 化合价变化 反应类型
得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
模仿下表的第一行,将表格补充完整。
CuO→Cu
降低(+2→0)
还原反应
CO→CO2
升高(+2→+4)
氧化反应
Fe2O3→Fe
降低(+3→0)
还原反应
1. 氧化反应和还原反应:
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
练习:判断下列过程是氧化反应还是还原反应:
(1)Cu→CuO ( )(2)Cu→CuCl2 ( )
(3)N2→NH3 ( )(4)FeCl2→FeCl3( )
氧化反应
氧化反应
氧化反应
还原反应
0 +2
0 +2
+2 +3
0 -3
氧化还原反应
2. 氧化还原反应:元素化合价发生变化的反应
反应中一定同时存在元素化合价的升高与降低
氧化还原反应
非氧化还原反应
根据是否有
化合价变化
练习:模仿上面的图示,表示如下反应:
0
+1
化合价升高,被氧化,发生氧化反应
-1
0
化合价降低,被还原,发生还原反应
2Na + Cl2 2NaCl
练习:下列反应中,属于非氧化还原反应的是 ( )
A.Cl2+2KOH==KCl+KClO+H2O
B.3NO2+H2O==2HNO3+NO
C.Na2O2+SO2==Na2SO4
D.2NaHCO3 Na2CO3+CO2↑+H2O
0
-1
+1
氧化还原反应
+4
+5
+2
氧化还原反应
-1
+4
-2
氧化还原反应
+6
+1 +1+4 -2
+1 +4 -2
+4 -2
+1 -2
非氧化还原反应
D
练习:下列反应转化关系(未配平)肯定不正确的是 ( )
A.S+KOH→K2SO3+K2S+H2O
B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu2O+H2SO4→CuSO4+Cu+H2O
D.NH4NO3→N2O+H2O
0
氧化还原反应中一定同时存在元素化合价的升高与降低
+4
-2
+2
+3
+1
+2
0
-3
+5
+1
无化合价降低
B
红酒与氧气充分接触,使某些化学物质被氧化,从而使口感更柔和
切开的苹果中的某些化学物质与空气中的氧气接触,该化学物质被氧化,颜色发生了变化
3. 氧化还原反应的本质:
0
+1
-1
0
2Na + Cl2 2NaCl
Na+ Cl-
Na
Na+
0
+1
失去最外
层1个电子
Na失去的电子去哪里了?
给了Cl原子
Cl
Cl-
0
-1
最外层得
到1个电子
Na原子的最外层只有1个电子,Cl原子的最外层有7个电子
●
Na
Cl
●●
●
●
●●
●
●●
●
●
●●
●
●
Cl-
Na+
还原反应
氧化反应
Cl原子得到Na原子失去的1个电子,转化为Cl-;Na失去最外层的1个电子转化为Na+
Na失电子,化合价升高,被氧化,发生氧化反应;Cl得电子,化合价降低,被还原,发生还原反应
反应的本质是电子的得失
4. 反应的电子得失可以进行如下的表示:
0
+1
失去2×e-,化合价升高,被氧化
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
反应中每个Na原子失去1个电子,一共有2个Na原子失电子,表示为失去2×e-,
反应中每个Cl原子得到1个电子,一共有2个Cl原子得电子,表示为得到2×e-,
0
+1
失去2×e-,化合价升高,被氧化
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
得失电子要用m×ne-的形式进行表示,其中m代表发生电子得失的原子个数,n代表每个原子得失的电子数(当m或n为1时要省略)
双线桥
练习:以上面的双线桥表示形式为例,对下面的反应进行双线桥分析:
(1)Zn + 2H+ == Zn2+ + H2↑
0
+2
失去2e-,化合价升高,被氧化
0
+1
得到2×e-,化合价降低,被还原
Zn + 2H+ == Zn2+ + H2↑
0
+1
失去2×e-,化合价升高,被氧化
-2
0
得到2e-,化合价降低,被还原
2K + S == K2S
练习:以上面的双线桥表示形式为例,对下面的反应进行双线桥分析:
(2)2K + S == K2S
有的电解质是以分子的形式存在的,既然该物质不是以离子形式存在的,那么形成该物质的过程发生的就不会是电子的转移,以H2和Cl2反应生成HCl为例,来分析此类物质形成过程中化合价变化的原因
该反应中H的化合价由0价升高到+1价,被氧化;Cl的化合价由0价降低到-1价,被还原。
以上过程中,元素化合价的变化是如何实现的呢?
H2 + C12 == 2HC1
0 0 +1-1
点燃
H原子的最外层只有1个电子,Cl原子的最外层有7个电子
●
H
Cl
●●
●
●
●●
●
两者各以最外层1个电子组成一个共用电子对。该电子对受到两个原子核的共同吸引,两个原子可以共同占有这1对电子,从而使两个原子都达到了稳定结构
H原子达到稳定结构
Cl原子达到稳定结构
H
Cl
●●
●
●
●●
●
●
氯原子吸引共用电子对的能力强于氢原子,共用电子对偏向于氯原子而偏离于氢原子,所以在HCl中H的化合价为+1,Cl的化合价为-1
+1
-1
化合价变化的原因是:发生了共用电子对的偏移
H
N
●●
●
●
根据上面的分析,同学们互相讨论回答下面的问题:NH3中N和H的化合价为什么分别是-3和+1?
●
●
●
H
●
H
H
N
●●
●
●
根据上面的分析,同学们互相讨论回答下面的问题:NH3中N和H的化合价为什么分别是-3和+1?
●
●
●
H
●
H
3个H原子中每个H原子都有1个共用电子对偏离,所以3个H都显+1价
NH3中N原子和H原子之间形成了3个共用电子对,其中3个共用电子对都偏向于N原子,所以N显-3价;
氧化还原反应的本质是电子的转移(电子得失或共用电子对偏移)。失电子(或电子对偏离),化合价升高,被氧化,发生氧化反应;得电子(或电子对偏向),化合价降低,被还原,发生还原反应。
氧化还原反应和之前学习的四个基本反应类型之间存在什么关系呢?如果以一个圆形表示氧化还原反应,同学们能不能画出四个基本反应类型与这个圆形的图示关系呢?
NaOH + HCl == NaCl + H2O
Zn + 2HCl == ZnCl2 + H2↑
氧化还原反应与四个基本反应类型的关系
CaO+ H2O == Ca(OH)2
2CO + O2 == 2CO2
点燃
2H2O == O2↑ + 2H2↑
通电
CaCO3== CaO + CO2↑
高温
小结
1. 氧化还原反应:有化合价变化的反应,其本质是电子的转移(电子得失或共用电子对的偏移)
2. 氧化反应:化合价升高的反应,失电子或共用电子对偏离。
3. 还原反应:化合价降低的反应,得电子或共用电子对偏向
4. 双线桥的表示:
0
+1
-1
0
得到2×e-,化合价降低,被还原
2Na + Cl2 2NaCl
失去2×e-,化合价升高,被氧化
