人教版(2019)必修一 2.1.3 碳酸钠和碳酸氢钠 焰色试验 课件(共25张PPT)
文档属性
| 名称 | 人教版(2019)必修一 2.1.3 碳酸钠和碳酸氢钠 焰色试验 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 16:17:02 | ||
图片预览




文档简介
(共25张PPT)
第一节 钠及其化合物
第3课时 碳酸钠和碳酸氢钠 焰色试验
第二章 海水中的重要元素
——钠和氯
通过探究实验,比较碳酸钠、碳酸氢钠的性质,了解它们在生产和生活中的应用,掌握鉴别它们的方法。
碳酸钠和碳酸氢钠的性质及其鉴别方法。
学习目标
重点难点
在烹制面包时常常用到小苏打,你知道小苏打的成分是什么吗?
碳酸钠(Na2CO3)俗名叫纯碱,也叫苏打;
碳酸氢钠(NaHCO3)俗名叫小苏打。
情境引入
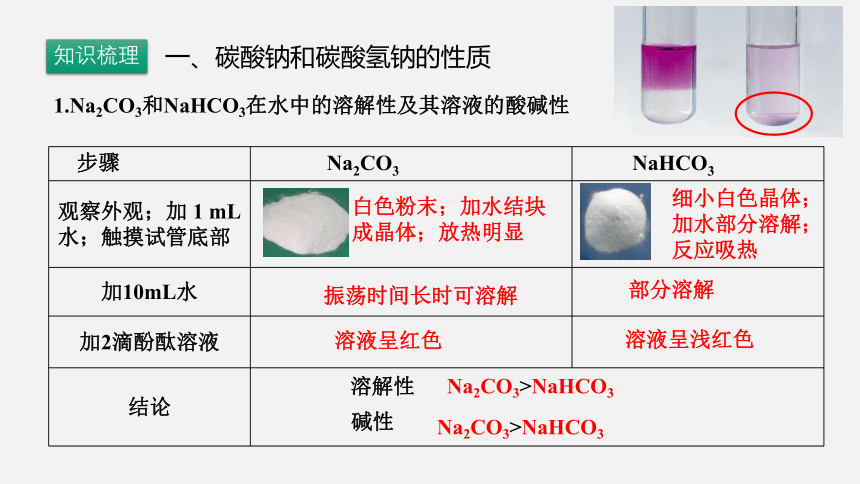
1.Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
步骤 Na2CO3 NaHCO3
观察外观;加 1 mL 水;触摸试管底部
加10mL水
加2滴酚酞溶液
结论 细小白色晶体;加水部分溶解;反应吸热
白色粉末;加水结块成晶体;放热明显
振荡时间长时可溶解
部分溶解
溶液呈红色
溶液呈浅红色
Na2CO3>NaHCO3
Na2CO3>NaHCO3
溶解性
碱性
一、碳酸钠和碳酸氢钠的性质
知识梳理
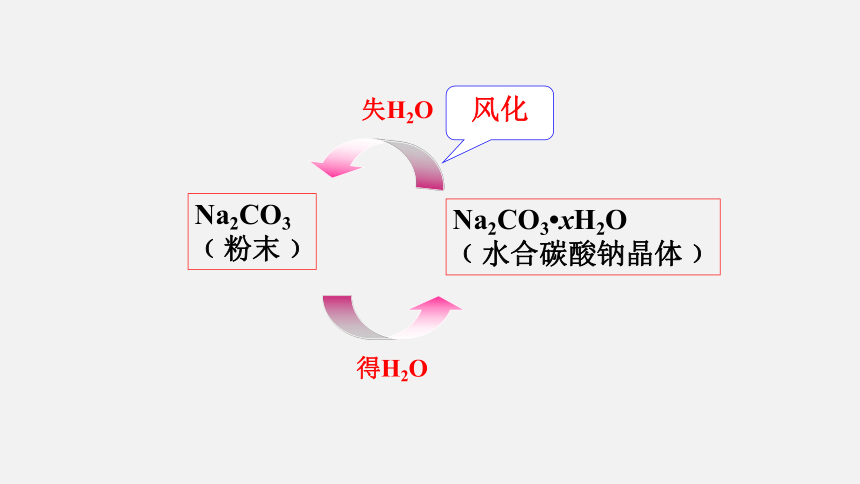
Na2CO3
﹙粉末﹚
失H2O
Na2CO3 xH2O
﹙水合碳酸钠晶体﹚
得H2O
风化
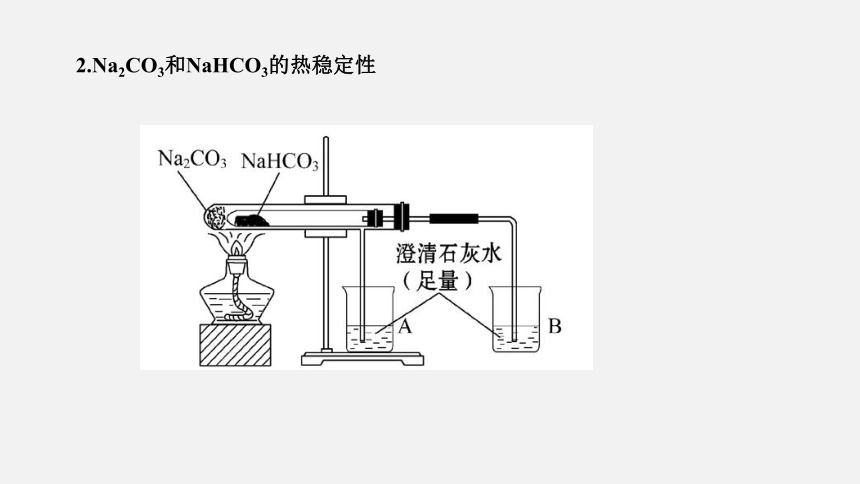
2.Na2CO3和NaHCO3的热稳定性
现象 发生反应的化学方程式 结论
Na2CO3
NaHCO3
无现象
有大量气体生成,澄清的石灰水变浑浊
△
2NaHCO3===Na2CO3+H2O+CO2↑
受热不 分解
碳酸氢钠不稳定受热易分解
结论:热稳定性:Na2CO3 > NaHCO3
记录现象
无
热 稳 定 性 规 律
Na、K的碳酸盐:正盐 > 酸式盐
Na2CO3 > NaHCO3
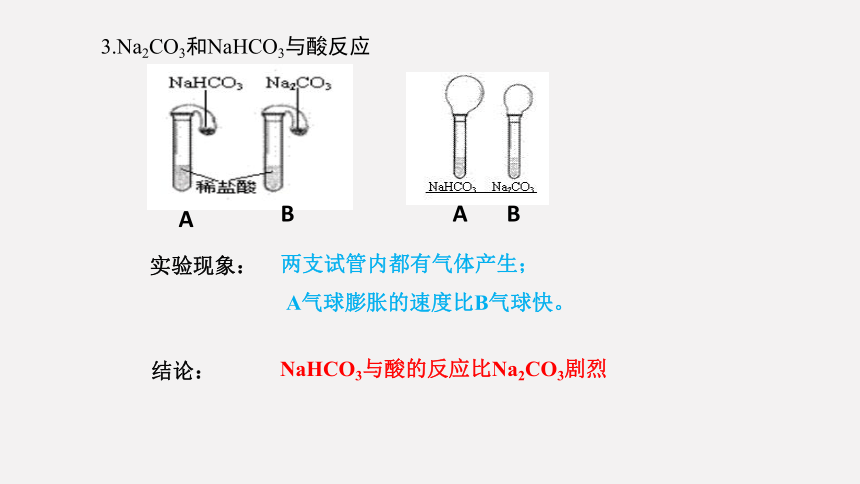
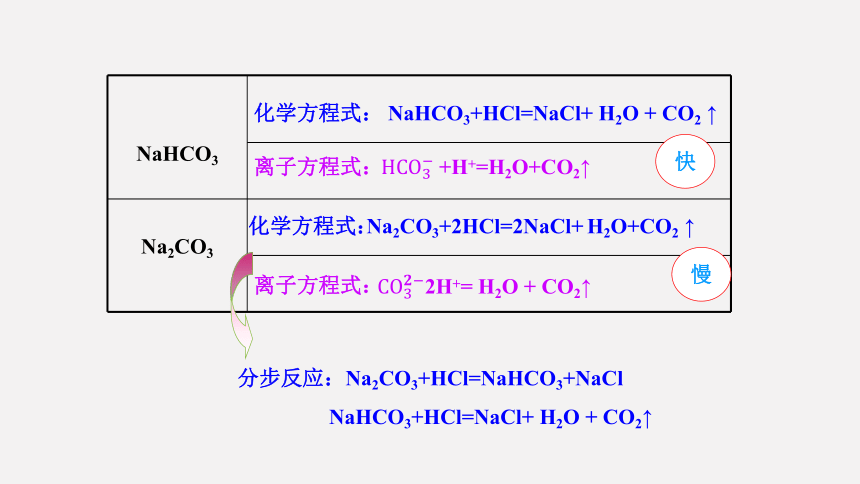
3.Na2CO3和NaHCO3与酸反应
实验现象:
两支试管内都有气体产生;
A气球膨胀的速度比B气球快。
NaHCO3与酸的反应比Na2CO3剧烈
结论:
A
B
B
A
NaHCO3
Na2CO3
Na2CO3+2HCl=2NaCl+ H2O+CO2 ↑
2H+= H2O + CO2↑
NaHCO3+HCl=NaCl+ H2O + CO2 ↑
+H+=H2O+CO2↑
分步反应:Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+ H2O + CO2↑
快
慢
化学方程式:
离子方程式:
离子方程式:
化学方程式:
思 考:向饱和Na2CO3溶液中通入过量的CO2,有何现象?为什么?
原因:Na2CO3 + CO2 + H2O == 2NaHCO3
溶解度: Na2CO3 > NaHCO3
CaCO3 < Ca(HCO3)2
现象:溶液变浑浊。
由于同温下,NaHCO3的溶解度比Na2CO3的溶解度小,所以有固体析出。
CO2↑ + H2O
H+
H+
2H+
OH-
2OH-
OH-
+ OH - = H2O +
CO2 + OH - =
CO2 + 2OH - = H2O +
CO2与 NaOH:
4.碳酸钠与碳酸氢钠的相互转化
(1)Na2CO3与CO2反应:
(2)NaHCO3:与碱反应生成碳酸钠和水。
NaHCO3+NaOH===Na2CO3+H2O
Na2CO3+ CO2+H2O ===2NaHCO3
2NaHCO3 === Na2CO3+H2O+CO2↑
5.Na2CO3和NaHCO3 用途
制玻璃
制肥皂
造纸
纺织等
发酵剂
灭火剂等
Na2CO3
NaHCO3
制药
交流与讨论1:
有两瓶无色溶液HCl和Na2CO3,不使用任何其它的试剂,如何利用化学性质区分出二者?
盐酸逐滴加入碳酸钠溶液中
+ 2H+ = H2O + CO2↑
+ H+ = HCO3 -
+ H+ = H2O + CO2↑
碳酸钠溶液逐滴加入盐酸中
现象:开始无明显现象,逐渐出现气泡。
现象:立刻出现气泡。
化学式 Na2CO3 NaHCO3
俗名
色、态
水中溶解度大 水溶液碱性 与酸反应快慢、化学方程式 比 快 热稳定性、方程式 碳酸钠与碳酸氢钠
纯碱 、苏打
小苏打
白色粉末
细小白色晶体
Na2CO3>NaHCO3
Na2CO3
Na2CO3>NaHCO3
NaHCO3
NaHCO3+HCl===NaCl+ H2O + CO2↑
Na2CO3+2HCl===2NaCl+ H2O+CO2↑
△
2NaHCO3===Na2CO3+H2O+CO2↑
归纳总结
Na2CO3>NaHCO3
如何鉴别碳酸钠和碳酸氢钠?
溶液
固体
沉淀法:
气体法:
酚酞法:
测pH法:
加热法:
加酸法:
加少量水:
加入BaCl2(CaCl2)溶液,产生沉淀的是Na2CO3
逐滴加入盐酸,立即产生气泡的是NaHCO3
向等浓度的Na2CO3和NaHCO3溶液中滴入几滴酚酞,溶液明显变红的是Na2CO3溶液。
用pH试纸测溶液的pH,pH大的是Na2CO3溶液
加热产生使澄清石灰水变浑浊的气体的是NaHCO3
加少量水Na2CO3结块,且有明显的放热现象,加大量水Na2CO3完全溶解,NaHCO3部分溶解。
加入少量的酸,NaHCO3比Na2CO3反应更剧烈。
交流与讨论2:
1.为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加BaCl2溶液,看有无沉淀
C.溶于水后加石灰水,看有无沉淀
D.取固体试样加盐酸,看是否有气泡产生
解析 对上述物质加热,只能证明有NaHCO3,而不能证明含有Na2CO3;NaHCO3与Na2CO3都能与石灰水反应产生沉淀,都能与盐酸反应产生气泡而无法鉴别。
B
跟踪训练
C
2.除去小苏打溶液中少量苏打的方法是( )
A.加热 B.加NaOH
C.通CO2气体 D.加盐酸
解析 Na2CO3+CO2+H2O===2NaHCO3。
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
物理现象
二、焰色试验
知识梳理
钡 铜 锶 铯
钠 钾 钙 铷
4.应用:
1.鉴别一些金属元素;
2.用相应的金属化合物制作烟火。
思 考: 1.在洗涤时能否把盐酸改为硝酸或硫酸?
2.所有的金属元素都能发生颜色反应吗?
不能,盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。硫酸不易挥发,在灼烧时不易挥发除去。而硝酸在加热时发生分解,产生较多的污染性气体。
不是,如铂丝,铁,铝等都不能发生。
焰色试验的注意要点
1.焰色试验是物理变化而不是化学变化。
2.焰色试验是金属元素的性质,不是物质的性质。
3.并不是所有的金属元素都能发生焰色反应,如Fe。
4.在中学化学实验中要求掌握钠、钾的焰色反应,对于K+的火焰颜色必须透过蓝色钴玻璃进行观察,以防止Na+对其造成干扰。
归纳总结
1.小明同学用洁净的铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子的判断正确的是( )
D
跟踪训练
2.下列说法正确的是( )
A.焰色为黄色,说明该物质中肯定含有钠元素
B.利用焰色试验可以鉴别所有的金属元素
C.焰色试验可用于鉴别碳酸钾和氢氧化钾
D.焰色试验是化学变化
A
第一节 钠及其化合物
第3课时 碳酸钠和碳酸氢钠 焰色试验
第二章 海水中的重要元素
——钠和氯
通过探究实验,比较碳酸钠、碳酸氢钠的性质,了解它们在生产和生活中的应用,掌握鉴别它们的方法。
碳酸钠和碳酸氢钠的性质及其鉴别方法。
学习目标
重点难点
在烹制面包时常常用到小苏打,你知道小苏打的成分是什么吗?
碳酸钠(Na2CO3)俗名叫纯碱,也叫苏打;
碳酸氢钠(NaHCO3)俗名叫小苏打。
情境引入
1.Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
步骤 Na2CO3 NaHCO3
观察外观;加 1 mL 水;触摸试管底部
加10mL水
加2滴酚酞溶液
结论 细小白色晶体;加水部分溶解;反应吸热
白色粉末;加水结块成晶体;放热明显
振荡时间长时可溶解
部分溶解
溶液呈红色
溶液呈浅红色
Na2CO3>NaHCO3
Na2CO3>NaHCO3
溶解性
碱性
一、碳酸钠和碳酸氢钠的性质
知识梳理
Na2CO3
﹙粉末﹚
失H2O
Na2CO3 xH2O
﹙水合碳酸钠晶体﹚
得H2O
风化
2.Na2CO3和NaHCO3的热稳定性
现象 发生反应的化学方程式 结论
Na2CO3
NaHCO3
无现象
有大量气体生成,澄清的石灰水变浑浊
△
2NaHCO3===Na2CO3+H2O+CO2↑
受热不 分解
碳酸氢钠不稳定受热易分解
结论:热稳定性:Na2CO3 > NaHCO3
记录现象
无
热 稳 定 性 规 律
Na、K的碳酸盐:正盐 > 酸式盐
Na2CO3 > NaHCO3
3.Na2CO3和NaHCO3与酸反应
实验现象:
两支试管内都有气体产生;
A气球膨胀的速度比B气球快。
NaHCO3与酸的反应比Na2CO3剧烈
结论:
A
B
B
A
NaHCO3
Na2CO3
Na2CO3+2HCl=2NaCl+ H2O+CO2 ↑
2H+= H2O + CO2↑
NaHCO3+HCl=NaCl+ H2O + CO2 ↑
+H+=H2O+CO2↑
分步反应:Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+ H2O + CO2↑
快
慢
化学方程式:
离子方程式:
离子方程式:
化学方程式:
思 考:向饱和Na2CO3溶液中通入过量的CO2,有何现象?为什么?
原因:Na2CO3 + CO2 + H2O == 2NaHCO3
溶解度: Na2CO3 > NaHCO3
CaCO3 < Ca(HCO3)2
现象:溶液变浑浊。
由于同温下,NaHCO3的溶解度比Na2CO3的溶解度小,所以有固体析出。
CO2↑ + H2O
H+
H+
2H+
OH-
2OH-
OH-
+ OH - = H2O +
CO2 + OH - =
CO2 + 2OH - = H2O +
CO2与 NaOH:
4.碳酸钠与碳酸氢钠的相互转化
(1)Na2CO3与CO2反应:
(2)NaHCO3:与碱反应生成碳酸钠和水。
NaHCO3+NaOH===Na2CO3+H2O
Na2CO3+ CO2+H2O ===2NaHCO3
2NaHCO3 === Na2CO3+H2O+CO2↑
5.Na2CO3和NaHCO3 用途
制玻璃
制肥皂
造纸
纺织等
发酵剂
灭火剂等
Na2CO3
NaHCO3
制药
交流与讨论1:
有两瓶无色溶液HCl和Na2CO3,不使用任何其它的试剂,如何利用化学性质区分出二者?
盐酸逐滴加入碳酸钠溶液中
+ 2H+ = H2O + CO2↑
+ H+ = HCO3 -
+ H+ = H2O + CO2↑
碳酸钠溶液逐滴加入盐酸中
现象:开始无明显现象,逐渐出现气泡。
现象:立刻出现气泡。
化学式 Na2CO3 NaHCO3
俗名
色、态
水中溶解度大 水溶液碱性 与酸反应快慢、化学方程式 比 快 热稳定性、方程式 碳酸钠与碳酸氢钠
纯碱 、苏打
小苏打
白色粉末
细小白色晶体
Na2CO3>NaHCO3
Na2CO3
Na2CO3>NaHCO3
NaHCO3
NaHCO3+HCl===NaCl+ H2O + CO2↑
Na2CO3+2HCl===2NaCl+ H2O+CO2↑
△
2NaHCO3===Na2CO3+H2O+CO2↑
归纳总结
Na2CO3>NaHCO3
如何鉴别碳酸钠和碳酸氢钠?
溶液
固体
沉淀法:
气体法:
酚酞法:
测pH法:
加热法:
加酸法:
加少量水:
加入BaCl2(CaCl2)溶液,产生沉淀的是Na2CO3
逐滴加入盐酸,立即产生气泡的是NaHCO3
向等浓度的Na2CO3和NaHCO3溶液中滴入几滴酚酞,溶液明显变红的是Na2CO3溶液。
用pH试纸测溶液的pH,pH大的是Na2CO3溶液
加热产生使澄清石灰水变浑浊的气体的是NaHCO3
加少量水Na2CO3结块,且有明显的放热现象,加大量水Na2CO3完全溶解,NaHCO3部分溶解。
加入少量的酸,NaHCO3比Na2CO3反应更剧烈。
交流与讨论2:
1.为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的是( )
A.加热,观察是否有气体放出
B.溶于水后加BaCl2溶液,看有无沉淀
C.溶于水后加石灰水,看有无沉淀
D.取固体试样加盐酸,看是否有气泡产生
解析 对上述物质加热,只能证明有NaHCO3,而不能证明含有Na2CO3;NaHCO3与Na2CO3都能与石灰水反应产生沉淀,都能与盐酸反应产生气泡而无法鉴别。
B
跟踪训练
C
2.除去小苏打溶液中少量苏打的方法是( )
A.加热 B.加NaOH
C.通CO2气体 D.加盐酸
解析 Na2CO3+CO2+H2O===2NaHCO3。
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
物理现象
二、焰色试验
知识梳理
钡 铜 锶 铯
钠 钾 钙 铷
4.应用:
1.鉴别一些金属元素;
2.用相应的金属化合物制作烟火。
思 考: 1.在洗涤时能否把盐酸改为硝酸或硫酸?
2.所有的金属元素都能发生颜色反应吗?
不能,盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。硫酸不易挥发,在灼烧时不易挥发除去。而硝酸在加热时发生分解,产生较多的污染性气体。
不是,如铂丝,铁,铝等都不能发生。
焰色试验的注意要点
1.焰色试验是物理变化而不是化学变化。
2.焰色试验是金属元素的性质,不是物质的性质。
3.并不是所有的金属元素都能发生焰色反应,如Fe。
4.在中学化学实验中要求掌握钠、钾的焰色反应,对于K+的火焰颜色必须透过蓝色钴玻璃进行观察,以防止Na+对其造成干扰。
归纳总结
1.小明同学用洁净的铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子的判断正确的是( )
D
跟踪训练
2.下列说法正确的是( )
A.焰色为黄色,说明该物质中肯定含有钠元素
B.利用焰色试验可以鉴别所有的金属元素
C.焰色试验可用于鉴别碳酸钾和氢氧化钾
D.焰色试验是化学变化
A
