山东省淄博市2022-2023学年高一上学期期末考试化学试题(含答案)
文档属性
| 名称 | 山东省淄博市2022-2023学年高一上学期期末考试化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 745.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 00:00:00 | ||
图片预览


文档简介
淄博市2022-2023学年高一上学期期末考试
化学
可能用到的相对原子质量:H1 C12 O16 Na23 Mg24 Al 27 Cl 35.5 Ag 108
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1. 化学与生产、生活联系密切。下列说法错误的是
A. 还原铁粉可用作食品干燥剂
B. 硬铝是制造飞机和宇宙飞船的理想材料
C. 侯氏制碱法的工艺过程中应用了物质溶解度的差异
D. “天问一号”火星车的热控保温材料——纳米气凝胶,可产生丁达尔效应
2. 下列物质存储或使用方法正确的是
A. 新制氯水保存于带玻璃塞的棕色广口瓶中
B. 铁与氯气不反应,所以液氯可用钢瓶储存
C. 金属钠着火用二氧化碳灭火器扑灭
D. 铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物
3. 科学家用氦核撞击非金属原子,反应如下:+→+。已知:X核内的质子数和中子数相等,下列叙述错误的是
A. z=7 B. Y的中子数10
C. 与互为同位素 D. 该反应中共涉及4种核素
4. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 强酸性溶液中:、Na+、、Cl-
B. 强碱性溶液中:K+、Fe2+、Ca2+、Cl-
C. 澄清透明溶液中:Cu2+、K+、、Cl-
D. 小苏打溶液中:K+、I-、、OH-
5. 设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 1.9g18OH-中含有的电子数为NA
B. 1mol/LNa2SO4溶液中含有的Na+的数目为2NA
C. 11.2LO2、CO2混合气体含有的氧原子数为NA
D. 0.1molCl2通入足量水中,生成的Cl-的数目为0.1NA
6. 下列指定反应的离子方程式正确的是
A. 用盐酸溶解氧化铝O2-+2H+=H2O
B. 用氯化铁溶液蚀刻铜电路板:Cu+2Fe3+=Cu2++2Fe2+
C. Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑
D. CaCl2溶液中通入少量CO2:Ca2++CO2+H2O=CaCO3↓+2H+
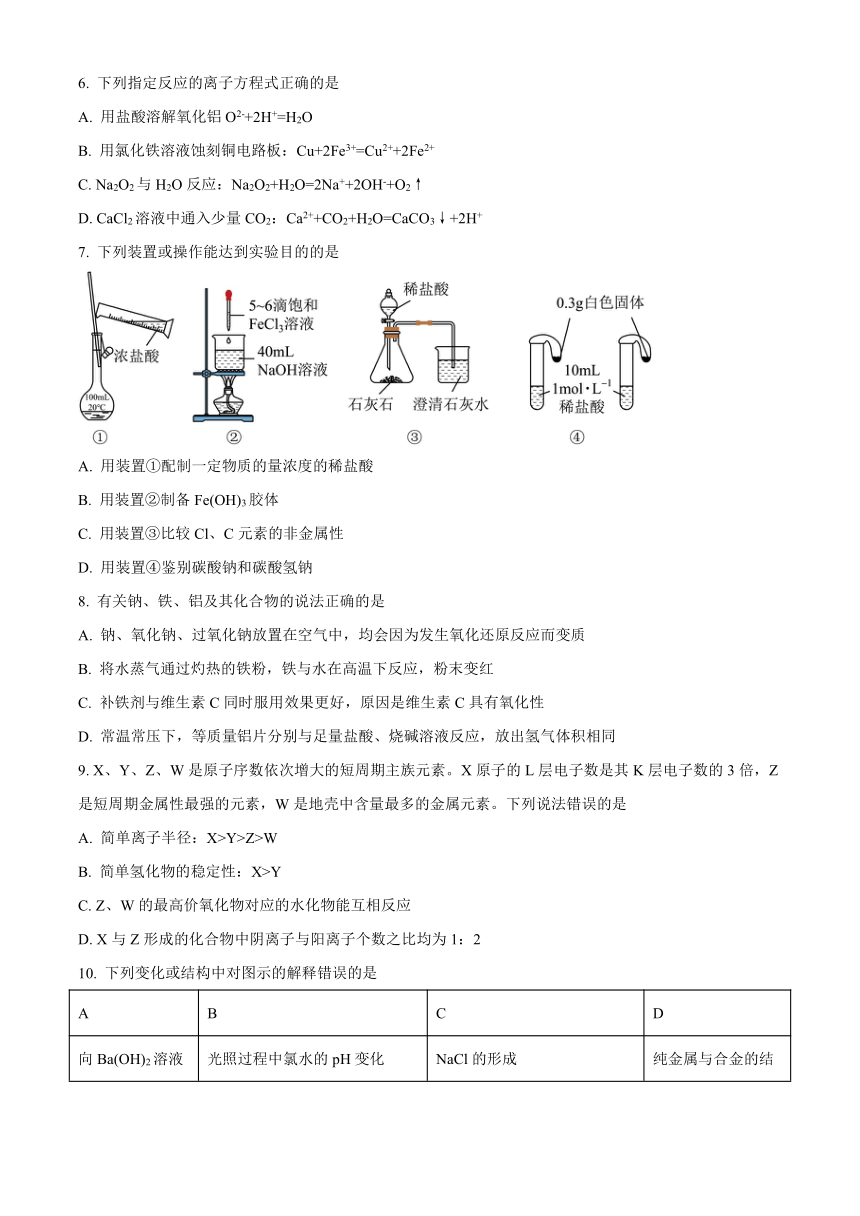
7. 下列装置或操作能达到实验目的的是
A. 用装置①配制一定物质的量浓度的稀盐酸
B. 用装置②制备Fe(OH)3胶体
C. 用装置③比较Cl、C元素的非金属性
D. 用装置④鉴别碳酸钠和碳酸氢钠
8. 有关钠、铁、铝及其化合物的说法正确的是
A. 钠、氧化钠、过氧化钠放置在空气中,均会因为发生氧化还原反应而变质
B. 将水蒸气通过灼热的铁粉,铁与水在高温下反应,粉末变红
C. 补铁剂与维生素C同时服用效果更好,原因是维生素C具有氧化性
D. 常温常压下,等质量铝片分别与足量盐酸、烧碱溶液反应,放出氢气体积相同
9. X、Y、Z、W是原子序数依次增大的短周期主族元素。X原子的L层电子数是其K层电子数的3倍,Z是短周期金属性最强的元素,W是地壳中含量最多的金属元素。下列说法错误的是
A. 简单离子半径:X>Y>Z>W
B. 简单氢化物的稳定性:X>Y
C. Z、W的最高价氧化物对应的水化物能互相反应
D. X与Z形成的化合物中阴离子与阳离子个数之比均为1:2
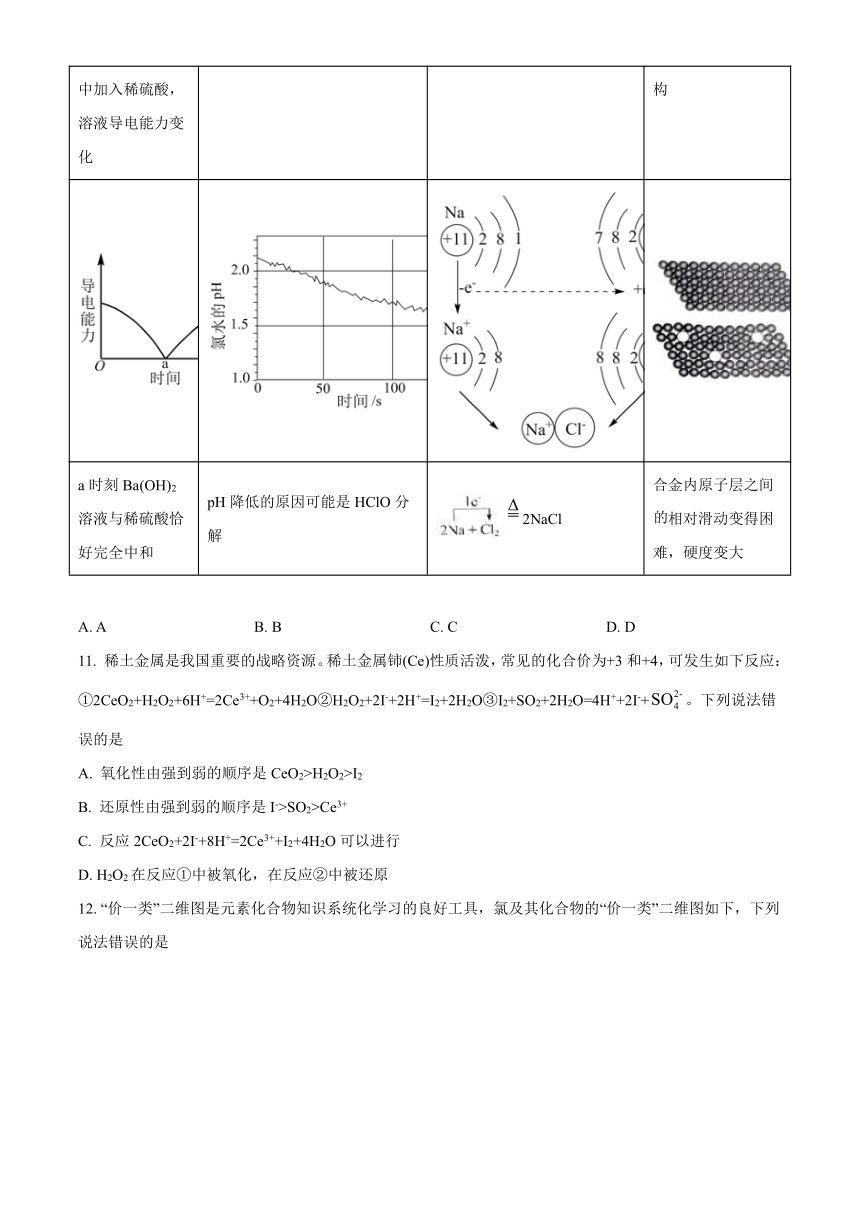
10. 下列变化或结构中对图示的解释错误的是
A B C D
向Ba(OH)2溶液中加入稀硫酸,溶液导电能力变化 光照过程中氯水的pH变化 NaCl的形成 纯金属与合金的结构
a时刻Ba(OH)2溶液与稀硫酸恰好完全中和 pH降低的原因可能是HClO分解 2NaCl 合金内原子层之间相对滑动变得困难,硬度变大
A. A B. B C. C D. D
11. 稀土金属是我国重要的战略资源。稀土金属铈(Ce)性质活泼,常见的化合价为+3和+4,可发生如下反应:①2CeO2+H2O2+6H+=2Ce3++O2+4H2O②H2O2+2I-+2H+=I2+2H2O③I2+SO2+2H2O=4H++2I-+。下列说法错误的是
A. 氧化性由强到弱的顺序是CeO2>H2O2>I2
B. 还原性由强到弱的顺序是I->SO2>Ce3+
C. 反应2CeO2+2I-+8H+=2Ce3++I2+4H2O可以进行
D. H2O2在反应①中被氧化,在反应②中被还原
12. “价一类”二维图是元素化合物知识系统化学习的良好工具,氯及其化合物的“价一类”二维图如下,下列说法错误的是
A. 酸性:戊>已 B. 若将乙转化为甲,可以不加还原剂
C. 丙为ClO2,可用作自来水消毒剂 D. 推测庚既有氧化性又有还原性
13. 某化学小组用如图所示装置检验氯气是否具有漂白性及卤素单质氧化性的相对强弱。下列说法错误的是
A. a中U型管可盛放无水氯化钙
B. b处棉花球变成黄色,说明Cl2的氧化性比Br2强
C. c处棉花球变成蓝色,说明Br2的氧化性比I2强
D. d装置中可发生反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O
14. 某水溶液可能含有以下离子中某几种:Na+、Fe2+、Mg2+、Al3+、Cl-、,现取三份50mL溶液分别进行如下实验,忽略混合前后溶液体积的变化。根据实验结果,以下推测正确的是
实验1:50.0mL溶液无现象14.35g白色沉淀
实验2:
A. 原溶液中一定含有Cl-,且c(Cl-)=0.1mol/L
B. 原溶液中可能含有Na+,可通过焰色试验检验
C. 0.8g白色固体为MgO和Al2O3混合物
D. 原溶液中c(Na+)=0.6mol/L
二、非选择题:本题共5小题,共58分。
15. 化学在生产、生活中应用广泛,贯穿古今。
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为S+2KNO3+3C=K2S+N2↑+3CO2↑。上述反应物和生成物中,属于电解质的是___(填化学式);在该反应中,被还原的元素为___(填元素符号)。
(2)碳酸氢钠可用于治疗胃酸过多,原因是(用离子方程式表示)___;除去Na2CO3粉末中少量的NaHCO3的方法是__________。
(3)某品牌84消毒液中NaClO的物质的量浓度为0.96mol/L,现需配制0.010mol/L的NaClO稀溶液450mL,需要用量筒量取84消毒液_____mL,在配制过程中,除需要烧杯、量筒、玻璃棒外还必需的玻璃仪器有___,若量取84消毒液时俯视读数,所配制溶液浓度将______(填“偏高”、“偏低”或“无影响”)。84消毒液不能与洁厕灵(主要成分为盐酸)混用,发生反应的离子方程式为___________;
16. 已知A、B、C为金属单质,A的焰色为黄色,C是当前用量最大的金属,D、E、F、G、H是中学常见化合物,常温下甲、乙、丙为气体,乙呈黄绿色。它们之间的相互转化关系如图所示(部分反应条件及产物未标出,每步反应均完全)。回答下列问题:
请根据以上信息回答下列问题:
(1)丙的电子式为_________;甲在乙中燃烧生成丙时的现象为____________。
(2)反应①~⑦中,不属于氧化还原反应的是___(填序号);反应①中每消耗6.9gA时转移的电子数为___(设NA表示阿伏加德罗常数的值)。
(3)反应③的离子方程式为____________。
(4)反应⑥的化学方程式为__________;检验G溶液中阳离子的试剂是___(填化学式)。
(5)反应⑧中发生氧化还原反应的化学方程式为___________。
17. 已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素,其原子径和最外层电子数之间的关系如图所示。回答下列问题:
(1)元素Y在周期表中的位置是________。X与Q形成的是___化合物(填“离子或“共价”)。
(2)Z元素的一种淡黄色固体化合物中所含有的化学键类型为_______。用电子式表示出化合物Z2Q的形成过程__________(用元素符号表示,下同)。
(3)Q和W非金属性较强的是___,请用原子结构知识解释产生上述差异的原因为___。设计简单实验证明两者的非金属性强弱______(用离子方程式表示)。
(4)探究同主族元素性质的递变规律是学习化学的重要方法之一,已知R是第六周期与X、Z同主族的元素,有关R的推测,正确的个数为__(填字母)。
①在自然界中以单质形态存在,少量R可以保存在煤油中
②对应氢氧化物碱性的强弱是:R>Z
③易与氧气发生反应,加热时生成的氧化物形式为R2O
④对应离子的氧化性是:R⑤R可以从CuSO4的溶液中将金属铜置换出来
⑥碳酸盐不易发生分解反应
A. 2 B. 3 C. 4 D. 5
18. 无水四氯化锡(SnCl4)可用于制作FTO导电玻璃。实验室可用氯气与锡反应制备SnCl4,装置如图。
已知:Sn的熔点为232℃;SnCl4为无色液体,沸点114℃,SnCl4遇水剧烈反应;Cl2易溶于SnCl4。
回答下列问题:
(1)盛放浓盐酸的仪器名称是________;D中饱和食盐水的作用是_______。
(2)仪器接口连接顺序为a→______________。
(3)实验开始时,先点燃装置___(填A或B)酒精灯。装置A中发生反应的离子方程式为_________。
(4)B装置中,冷水的作用是___,收集器收集到的液体略显黄色,可能的原因是__________。
(5)E中试剂为碱石灰,其作用是____________。
19. 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂。某兴趣小组根拟用铁屑制备高铁酸钾的工艺流程如图所示。
回答下列问题:
(1)“氧化”过程中,反应的离子方程式为____________。
(2)“氧化”过程中,某同学想检验反应后溶液中是否还有二价铁,他选择的试剂为酸性高锰酸钾,你认为该同学的选择是否合理___,理由是___________。
(3)“制备Na2FeO4过程中,NaClO被还原为NaCl,该反应的离子方程式为____________。
(4)该工艺流程中,可循环利用的物质是___(填化学式),可将该物质导入到___操作中(填操作单元的名称)。
(5)“转化”过程中,加入饱和KOH溶液能析出K2FeO4晶体,说明该条件下的溶解度Na2FeO4___(填“大于”“等于”或“小于”)K2FeO4。小组同学准确称取了mg铁屑,经过以上流程(假设过程中铁元素损失忽略不计)得到ng K2FeO4晶体(M=198g/mol),则铁屑中铁元素的质量分数为___(用含m,n的代数式表示)。
淄博市2022-2023学年高一上学期期末考试
化学 答案
可能用到的相对原子质量:H1 C12 O16 Na23 Mg24 Al 27 Cl 35.5 Ag 108
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
【1题答案】
【答案】A
【2题答案】
【答案】D
【3题答案】
【答案】B
【4题答案】
【答案】C
【5题答案】
【答案】A
【6题答案】
【答案】B
【7题答案】
【答案】D
【8题答案】
【答案】D
【9题答案】
【答案】B
【10题答案】
【答案】C
【11题答案】
【答案】B
【12题答案】
【答案】A
【13题答案】
【答案】C
【14题答案】
【答案】D
二、非选择题:本题共5小题,共58分。
【15题答案】
【答案】(1) ①. KNO3、K2S ②. N和S
(2) ①. +H+= H2O+CO2↑ ②. 加热至恒重
(3) ① 5.2 ②. 500mL容量瓶和胶头滴管 ③. 偏小 ④. ClO-+2H++Cl-= Cl2↑+H2O
【16题答案】
【答案】(1) ①. ②. 安静地燃烧,发出苍白色火焰,瓶口有白雾
(2) ①. ⑦ ②. 0.3NA
(3)2Al+2OH-+2H2O=2+3H2↑
(4) ①. Fe+2FeCl3=3FeCl2 ②. KSCN
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【17题答案】
【答案】(1) ①. 第2周期第ⅥA族 ②. 共价
(2) ①. 离子键和共价键 ②.
(3) ①. Cl ②. S和Cl位于同一周期,电子层数相同,核电荷数Cl的更大,原子半径Cl的更小,则Cl的原子核对最外层电子的束缚能力更强,则非金属更强 ③. S2-+Cl2=S+2Cl- (4)B
【18题答案】
【答案】(1) ①. 分液漏斗 ②. 除去HCl气体
(2)a→f→g→d→e→b→c→h→i
(3) ①. A ②.
(4) ①. 冷凝回流SnCl4至收集器中 ②. 溶解了少量氯气
(5)吸收氯气和防止空气中的水蒸气进去装置
【19题答案】
【答案】(1)2Fe2++H2O2+2H+=2Fe3++2H2O
(2) ①. 不合理 ②. 酸性高锰酸钾能将Cl-氧化为有毒有害的Cl2,污染环境
(3)3ClO-+2Fe3++10OH-=2+3Cl-+5H2O
(4) ①. NaOH ②. 制备Na2FeO4
(5) ①. 大于 ②.
化学
可能用到的相对原子质量:H1 C12 O16 Na23 Mg24 Al 27 Cl 35.5 Ag 108
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1. 化学与生产、生活联系密切。下列说法错误的是
A. 还原铁粉可用作食品干燥剂
B. 硬铝是制造飞机和宇宙飞船的理想材料
C. 侯氏制碱法的工艺过程中应用了物质溶解度的差异
D. “天问一号”火星车的热控保温材料——纳米气凝胶,可产生丁达尔效应
2. 下列物质存储或使用方法正确的是
A. 新制氯水保存于带玻璃塞的棕色广口瓶中
B. 铁与氯气不反应,所以液氯可用钢瓶储存
C. 金属钠着火用二氧化碳灭火器扑灭
D. 铝制餐具不宜用来蒸煮或长时间存放酸性或碱性食物
3. 科学家用氦核撞击非金属原子,反应如下:+→+。已知:X核内的质子数和中子数相等,下列叙述错误的是
A. z=7 B. Y的中子数10
C. 与互为同位素 D. 该反应中共涉及4种核素
4. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 强酸性溶液中:、Na+、、Cl-
B. 强碱性溶液中:K+、Fe2+、Ca2+、Cl-
C. 澄清透明溶液中:Cu2+、K+、、Cl-
D. 小苏打溶液中:K+、I-、、OH-
5. 设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 1.9g18OH-中含有的电子数为NA
B. 1mol/LNa2SO4溶液中含有的Na+的数目为2NA
C. 11.2LO2、CO2混合气体含有的氧原子数为NA
D. 0.1molCl2通入足量水中,生成的Cl-的数目为0.1NA
6. 下列指定反应的离子方程式正确的是
A. 用盐酸溶解氧化铝O2-+2H+=H2O
B. 用氯化铁溶液蚀刻铜电路板:Cu+2Fe3+=Cu2++2Fe2+
C. Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑
D. CaCl2溶液中通入少量CO2:Ca2++CO2+H2O=CaCO3↓+2H+
7. 下列装置或操作能达到实验目的的是
A. 用装置①配制一定物质的量浓度的稀盐酸
B. 用装置②制备Fe(OH)3胶体
C. 用装置③比较Cl、C元素的非金属性
D. 用装置④鉴别碳酸钠和碳酸氢钠
8. 有关钠、铁、铝及其化合物的说法正确的是
A. 钠、氧化钠、过氧化钠放置在空气中,均会因为发生氧化还原反应而变质
B. 将水蒸气通过灼热的铁粉,铁与水在高温下反应,粉末变红
C. 补铁剂与维生素C同时服用效果更好,原因是维生素C具有氧化性
D. 常温常压下,等质量铝片分别与足量盐酸、烧碱溶液反应,放出氢气体积相同
9. X、Y、Z、W是原子序数依次增大的短周期主族元素。X原子的L层电子数是其K层电子数的3倍,Z是短周期金属性最强的元素,W是地壳中含量最多的金属元素。下列说法错误的是
A. 简单离子半径:X>Y>Z>W
B. 简单氢化物的稳定性:X>Y
C. Z、W的最高价氧化物对应的水化物能互相反应
D. X与Z形成的化合物中阴离子与阳离子个数之比均为1:2
10. 下列变化或结构中对图示的解释错误的是
A B C D
向Ba(OH)2溶液中加入稀硫酸,溶液导电能力变化 光照过程中氯水的pH变化 NaCl的形成 纯金属与合金的结构
a时刻Ba(OH)2溶液与稀硫酸恰好完全中和 pH降低的原因可能是HClO分解 2NaCl 合金内原子层之间相对滑动变得困难,硬度变大
A. A B. B C. C D. D
11. 稀土金属是我国重要的战略资源。稀土金属铈(Ce)性质活泼,常见的化合价为+3和+4,可发生如下反应:①2CeO2+H2O2+6H+=2Ce3++O2+4H2O②H2O2+2I-+2H+=I2+2H2O③I2+SO2+2H2O=4H++2I-+。下列说法错误的是
A. 氧化性由强到弱的顺序是CeO2>H2O2>I2
B. 还原性由强到弱的顺序是I->SO2>Ce3+
C. 反应2CeO2+2I-+8H+=2Ce3++I2+4H2O可以进行
D. H2O2在反应①中被氧化,在反应②中被还原
12. “价一类”二维图是元素化合物知识系统化学习的良好工具,氯及其化合物的“价一类”二维图如下,下列说法错误的是
A. 酸性:戊>已 B. 若将乙转化为甲,可以不加还原剂
C. 丙为ClO2,可用作自来水消毒剂 D. 推测庚既有氧化性又有还原性
13. 某化学小组用如图所示装置检验氯气是否具有漂白性及卤素单质氧化性的相对强弱。下列说法错误的是
A. a中U型管可盛放无水氯化钙
B. b处棉花球变成黄色,说明Cl2的氧化性比Br2强
C. c处棉花球变成蓝色,说明Br2的氧化性比I2强
D. d装置中可发生反应的离子方程式为Cl2+2OH-=ClO-+Cl-+H2O
14. 某水溶液可能含有以下离子中某几种:Na+、Fe2+、Mg2+、Al3+、Cl-、,现取三份50mL溶液分别进行如下实验,忽略混合前后溶液体积的变化。根据实验结果,以下推测正确的是
实验1:50.0mL溶液无现象14.35g白色沉淀
实验2:
A. 原溶液中一定含有Cl-,且c(Cl-)=0.1mol/L
B. 原溶液中可能含有Na+,可通过焰色试验检验
C. 0.8g白色固体为MgO和Al2O3混合物
D. 原溶液中c(Na+)=0.6mol/L
二、非选择题:本题共5小题,共58分。
15. 化学在生产、生活中应用广泛,贯穿古今。
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为S+2KNO3+3C=K2S+N2↑+3CO2↑。上述反应物和生成物中,属于电解质的是___(填化学式);在该反应中,被还原的元素为___(填元素符号)。
(2)碳酸氢钠可用于治疗胃酸过多,原因是(用离子方程式表示)___;除去Na2CO3粉末中少量的NaHCO3的方法是__________。
(3)某品牌84消毒液中NaClO的物质的量浓度为0.96mol/L,现需配制0.010mol/L的NaClO稀溶液450mL,需要用量筒量取84消毒液_____mL,在配制过程中,除需要烧杯、量筒、玻璃棒外还必需的玻璃仪器有___,若量取84消毒液时俯视读数,所配制溶液浓度将______(填“偏高”、“偏低”或“无影响”)。84消毒液不能与洁厕灵(主要成分为盐酸)混用,发生反应的离子方程式为___________;
16. 已知A、B、C为金属单质,A的焰色为黄色,C是当前用量最大的金属,D、E、F、G、H是中学常见化合物,常温下甲、乙、丙为气体,乙呈黄绿色。它们之间的相互转化关系如图所示(部分反应条件及产物未标出,每步反应均完全)。回答下列问题:
请根据以上信息回答下列问题:
(1)丙的电子式为_________;甲在乙中燃烧生成丙时的现象为____________。
(2)反应①~⑦中,不属于氧化还原反应的是___(填序号);反应①中每消耗6.9gA时转移的电子数为___(设NA表示阿伏加德罗常数的值)。
(3)反应③的离子方程式为____________。
(4)反应⑥的化学方程式为__________;检验G溶液中阳离子的试剂是___(填化学式)。
(5)反应⑧中发生氧化还原反应的化学方程式为___________。
17. 已知X、Y、Z、Q、W为原子序数依次增大的短周期主族元素,其原子径和最外层电子数之间的关系如图所示。回答下列问题:
(1)元素Y在周期表中的位置是________。X与Q形成的是___化合物(填“离子或“共价”)。
(2)Z元素的一种淡黄色固体化合物中所含有的化学键类型为_______。用电子式表示出化合物Z2Q的形成过程__________(用元素符号表示,下同)。
(3)Q和W非金属性较强的是___,请用原子结构知识解释产生上述差异的原因为___。设计简单实验证明两者的非金属性强弱______(用离子方程式表示)。
(4)探究同主族元素性质的递变规律是学习化学的重要方法之一,已知R是第六周期与X、Z同主族的元素,有关R的推测,正确的个数为__(填字母)。
①在自然界中以单质形态存在,少量R可以保存在煤油中
②对应氢氧化物碱性的强弱是:R>Z
③易与氧气发生反应,加热时生成的氧化物形式为R2O
④对应离子的氧化性是:R
⑥碳酸盐不易发生分解反应
A. 2 B. 3 C. 4 D. 5
18. 无水四氯化锡(SnCl4)可用于制作FTO导电玻璃。实验室可用氯气与锡反应制备SnCl4,装置如图。
已知:Sn的熔点为232℃;SnCl4为无色液体,沸点114℃,SnCl4遇水剧烈反应;Cl2易溶于SnCl4。
回答下列问题:
(1)盛放浓盐酸的仪器名称是________;D中饱和食盐水的作用是_______。
(2)仪器接口连接顺序为a→______________。
(3)实验开始时,先点燃装置___(填A或B)酒精灯。装置A中发生反应的离子方程式为_________。
(4)B装置中,冷水的作用是___,收集器收集到的液体略显黄色,可能的原因是__________。
(5)E中试剂为碱石灰,其作用是____________。
19. 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂。某兴趣小组根拟用铁屑制备高铁酸钾的工艺流程如图所示。
回答下列问题:
(1)“氧化”过程中,反应的离子方程式为____________。
(2)“氧化”过程中,某同学想检验反应后溶液中是否还有二价铁,他选择的试剂为酸性高锰酸钾,你认为该同学的选择是否合理___,理由是___________。
(3)“制备Na2FeO4过程中,NaClO被还原为NaCl,该反应的离子方程式为____________。
(4)该工艺流程中,可循环利用的物质是___(填化学式),可将该物质导入到___操作中(填操作单元的名称)。
(5)“转化”过程中,加入饱和KOH溶液能析出K2FeO4晶体,说明该条件下的溶解度Na2FeO4___(填“大于”“等于”或“小于”)K2FeO4。小组同学准确称取了mg铁屑,经过以上流程(假设过程中铁元素损失忽略不计)得到ng K2FeO4晶体(M=198g/mol),则铁屑中铁元素的质量分数为___(用含m,n的代数式表示)。
淄博市2022-2023学年高一上学期期末考试
化学 答案
可能用到的相对原子质量:H1 C12 O16 Na23 Mg24 Al 27 Cl 35.5 Ag 108
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
【1题答案】
【答案】A
【2题答案】
【答案】D
【3题答案】
【答案】B
【4题答案】
【答案】C
【5题答案】
【答案】A
【6题答案】
【答案】B
【7题答案】
【答案】D
【8题答案】
【答案】D
【9题答案】
【答案】B
【10题答案】
【答案】C
【11题答案】
【答案】B
【12题答案】
【答案】A
【13题答案】
【答案】C
【14题答案】
【答案】D
二、非选择题:本题共5小题,共58分。
【15题答案】
【答案】(1) ①. KNO3、K2S ②. N和S
(2) ①. +H+= H2O+CO2↑ ②. 加热至恒重
(3) ① 5.2 ②. 500mL容量瓶和胶头滴管 ③. 偏小 ④. ClO-+2H++Cl-= Cl2↑+H2O
【16题答案】
【答案】(1) ①. ②. 安静地燃烧,发出苍白色火焰,瓶口有白雾
(2) ①. ⑦ ②. 0.3NA
(3)2Al+2OH-+2H2O=2+3H2↑
(4) ①. Fe+2FeCl3=3FeCl2 ②. KSCN
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3
【17题答案】
【答案】(1) ①. 第2周期第ⅥA族 ②. 共价
(2) ①. 离子键和共价键 ②.
(3) ①. Cl ②. S和Cl位于同一周期,电子层数相同,核电荷数Cl的更大,原子半径Cl的更小,则Cl的原子核对最外层电子的束缚能力更强,则非金属更强 ③. S2-+Cl2=S+2Cl- (4)B
【18题答案】
【答案】(1) ①. 分液漏斗 ②. 除去HCl气体
(2)a→f→g→d→e→b→c→h→i
(3) ①. A ②.
(4) ①. 冷凝回流SnCl4至收集器中 ②. 溶解了少量氯气
(5)吸收氯气和防止空气中的水蒸气进去装置
【19题答案】
【答案】(1)2Fe2++H2O2+2H+=2Fe3++2H2O
(2) ①. 不合理 ②. 酸性高锰酸钾能将Cl-氧化为有毒有害的Cl2,污染环境
(3)3ClO-+2Fe3++10OH-=2+3Cl-+5H2O
(4) ①. NaOH ②. 制备Na2FeO4
(5) ①. 大于 ②.
同课章节目录
