化学人教版(2019)选择性必修1 3.2.3 滴定图像(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2.3 滴定图像(共16张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1008.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-19 16:43:42 | ||
图片预览





文档简介
(共16张PPT)
中和滴定曲线
中和滴定曲线的分析与应用
常 考 图 形
感受高考 明确考向
pH-体积图 微粒分布曲线交叉图 对数直线图 复合图像
2016全国卷Ⅰ 2017全国卷Ⅱ 2020全国卷Ⅰ
2021海南卷 2021山东卷 2017全国卷Ⅰ 2021辽宁卷
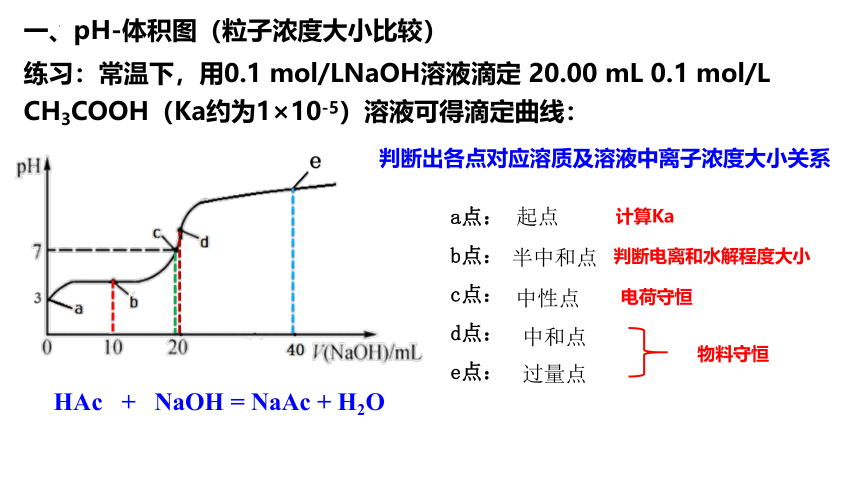
练习:常温下,用0.1 mol/LNaOH溶液滴定 20.00 mL 0.1 mol/L CH3COOH(Ka约为1×10-5)溶液可得滴定曲线:
判断出各点对应溶质及溶液中离子浓度大小关系
a点:
b点:
c点:
d点:
e点:
计算Ka
判断电离和水解程度大小
电荷守恒
物料守恒
一、pH-体积图(粒子浓度大小比较)
起点
半中和点
中性点
中和点
过量点
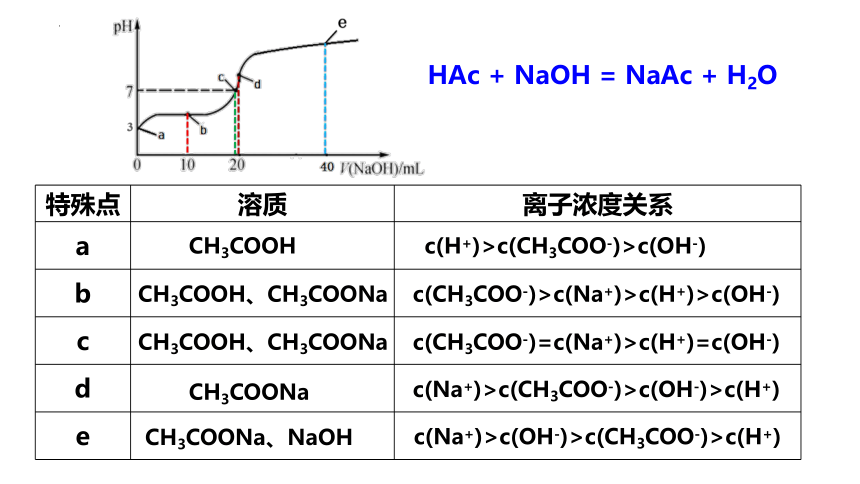
HAc + NaOH = NaAc + H2O
特殊点 溶质 离子浓度关系
a
b
c
d
e
HAc + NaOH = NaAc + H2O
c(H+)>c(CH3COO-)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
CH3COOH
CH3COOH、CH3COONa
CH3COOH、CH3COONa
CH3COONa
CH3COONa、NaOH
【2016·浙江高考真题】常温下,向20.00mL0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000 mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是
A.在反应过程中,
c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
B.pH=5时,
c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
C.pH=6时,c(Na+)+ c(H+)-c(OH-)+ c(CH3COOH)=0.1000 mol·Lˉ1
D.pH=7时,消耗NaOH溶液的体积小于20.00mL
C
【2021·湖南真题】常温下,用0.1000mol/L的盐酸分别滴定20.00mL浓度均为0.1000mol/L三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。回答相应问题:
当pH=7时,三种溶液中c(X-)、c(Y-)、c(Z-)的大小关系:
c(X-)>c(Y-)>c(Z-)
【2018·浙江高考】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol/L,0.1000mol/L和0.01000mol/L的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
A.3种HCl溶液的c(HCl):最大的是最小的100倍
B.曲线a、b、c对应的c(NaOH):a>b>c
C.当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
D
归纳小结:
过量点
抓
五
点
起始点
半 点
中性点
恰好点
定
溶
质
电离理论、
水解理论、
三大守恒
必备知识
浓度关系
pH-体积图
例题:常温下,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数(δ)与pH的关系如图所示,已知:
二、微粒分布多曲线交叉图(平衡常数的计算与应用)
思考交流:
1、用A、B 点求Ka1、Ka2、Kh1、Kh2,并找出它们之间的关系。
2、A点和草酸的半中和点是什么关系?
【2021·新高考辽宁卷】用0.1000 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是[如A2-分布分数: ]
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作为指示剂
D.c(Na2A)=0.2000 mol·L-1
√
练习:25℃时,用0.1000 mol·L-1NaOH溶液滴定某二元弱酸H2A。溶液中,pH、物种分布分数δ随H2A被滴定分数[n(NaOH):n(H2A)]的变化关系如图所示。
A、曲线①代表δ(H2A)
B、H2A的Ka1=1×10-7
C、n(NaOH):n(H2A)=0.5的溶液中:2c(H+)+c(H2A)=c(HA-)+3c(A2-)+2c(OH-)
D、n(NaOH):n(H2A)=1的溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
AC
必备知识
平衡常数表达式
归纳小结:
找交点
算K值
定曲线
微粒分布多曲线交叉图
【2017·高考全国卷Ⅰ,13】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。回答相应问题:
1、指出横坐标与曲线M、N的对应关系;
2、判断NaHX溶液的酸碱性;
3、当混合溶液呈中性时离子浓度大小顺序。
三、浓度对数-pH图像
找0点
算K值
归纳小结:
c(Na+)>c(X2-)>c(HX-)>c(OH-)=c(H+)
概括归理 课堂总结
中和滴定曲线 模型构建
pH-体积图
多曲线交叉图
对数直线图
抓五点,定溶质
定曲线,找交点,算K值
找0点,算K值,定直线
微粒种类
及其
发生的行为
【2020·山东高考真题】
25℃时,某混合溶液中c(CH3COO-)+c(CH3COOH)=0.1mol/L,lgc( CH3COOH)、lgc(CH3COO-)、lgc(H+)和lgc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=-lgKa
C.该体系中,
D.pH由7到14的变化过程中,
CH3COO-的水解程度始终增大
B C
【实战训练】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。
用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示,
下列说法正确的是( )
A. a点所得溶液中:2c(H2SO3) +c(SO32-) =0.1 mol L-1
B. b点所得溶液中:c(H2SO3) + c(OH-) =c(SO32-) + c(H+)
C. c点所得溶液中:c(Na+) >3c(HSO3-)
D. d点所得溶液中:c(Na+) >c(SO32-) > c(H+)> c(OH-)
“一元强碱滴定二元弱酸”pH-体积图
a点:
b 半点为 NaHSO3溶液的质子守恒
c点:
d恰好点:Na2SO3单一溶液离子浓度大小比较
解
题
思
路
c(HSO3-) = c(H2SO3)
c(SO32-) = c(HSO3-)
C
c(Na+) + c(H+) = c(HSO3-) + 2c(SO32-) + c(OH-)
中和滴定曲线
中和滴定曲线的分析与应用
常 考 图 形
感受高考 明确考向
pH-体积图 微粒分布曲线交叉图 对数直线图 复合图像
2016全国卷Ⅰ 2017全国卷Ⅱ 2020全国卷Ⅰ
2021海南卷 2021山东卷 2017全国卷Ⅰ 2021辽宁卷
练习:常温下,用0.1 mol/LNaOH溶液滴定 20.00 mL 0.1 mol/L CH3COOH(Ka约为1×10-5)溶液可得滴定曲线:
判断出各点对应溶质及溶液中离子浓度大小关系
a点:
b点:
c点:
d点:
e点:
计算Ka
判断电离和水解程度大小
电荷守恒
物料守恒
一、pH-体积图(粒子浓度大小比较)
起点
半中和点
中性点
中和点
过量点
HAc + NaOH = NaAc + H2O
特殊点 溶质 离子浓度关系
a
b
c
d
e
HAc + NaOH = NaAc + H2O
c(H+)>c(CH3COO-)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
CH3COOH
CH3COOH、CH3COONa
CH3COOH、CH3COONa
CH3COONa
CH3COONa、NaOH
【2016·浙江高考真题】常温下,向20.00mL0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000 mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是
A.在反应过程中,
c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
B.pH=5时,
c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
C.pH=6时,c(Na+)+ c(H+)-c(OH-)+ c(CH3COOH)=0.1000 mol·Lˉ1
D.pH=7时,消耗NaOH溶液的体积小于20.00mL
C
【2021·湖南真题】常温下,用0.1000mol/L的盐酸分别滴定20.00mL浓度均为0.1000mol/L三种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图所示。回答相应问题:
当pH=7时,三种溶液中c(X-)、c(Y-)、c(Z-)的大小关系:
c(X-)>c(Y-)>c(Z-)
【2018·浙江高考】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol/L,0.1000mol/L和0.01000mol/L的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
A.3种HCl溶液的c(HCl):最大的是最小的100倍
B.曲线a、b、c对应的c(NaOH):a>b>c
C.当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
D
归纳小结:
过量点
抓
五
点
起始点
半 点
中性点
恰好点
定
溶
质
电离理论、
水解理论、
三大守恒
必备知识
浓度关系
pH-体积图
例题:常温下,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42-的物质的量分数(δ)与pH的关系如图所示,已知:
二、微粒分布多曲线交叉图(平衡常数的计算与应用)
思考交流:
1、用A、B 点求Ka1、Ka2、Kh1、Kh2,并找出它们之间的关系。
2、A点和草酸的半中和点是什么关系?
【2021·新高考辽宁卷】用0.1000 mol·L-1盐酸滴定20.00 mL Na2A溶液,溶液中H2A、HA-、A2-的分布分数δ随pH变化曲线及滴定曲线如图。下列说法正确的是[如A2-分布分数: ]
A.H2A的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作为指示剂
D.c(Na2A)=0.2000 mol·L-1
√
练习:25℃时,用0.1000 mol·L-1NaOH溶液滴定某二元弱酸H2A。溶液中,pH、物种分布分数δ随H2A被滴定分数[n(NaOH):n(H2A)]的变化关系如图所示。
A、曲线①代表δ(H2A)
B、H2A的Ka1=1×10-7
C、n(NaOH):n(H2A)=0.5的溶液中:2c(H+)+c(H2A)=c(HA-)+3c(A2-)+2c(OH-)
D、n(NaOH):n(H2A)=1的溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
AC
必备知识
平衡常数表达式
归纳小结:
找交点
算K值
定曲线
微粒分布多曲线交叉图
【2017·高考全国卷Ⅰ,13】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。回答相应问题:
1、指出横坐标与曲线M、N的对应关系;
2、判断NaHX溶液的酸碱性;
3、当混合溶液呈中性时离子浓度大小顺序。
三、浓度对数-pH图像
找0点
算K值
归纳小结:
c(Na+)>c(X2-)>c(HX-)>c(OH-)=c(H+)
概括归理 课堂总结
中和滴定曲线 模型构建
pH-体积图
多曲线交叉图
对数直线图
抓五点,定溶质
定曲线,找交点,算K值
找0点,算K值,定直线
微粒种类
及其
发生的行为
【2020·山东高考真题】
25℃时,某混合溶液中c(CH3COO-)+c(CH3COOH)=0.1mol/L,lgc( CH3COOH)、lgc(CH3COO-)、lgc(H+)和lgc(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=-lgKa
C.该体系中,
D.pH由7到14的变化过程中,
CH3COO-的水解程度始终增大
B C
【实战训练】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。
用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示,
下列说法正确的是( )
A. a点所得溶液中:2c(H2SO3) +c(SO32-) =0.1 mol L-1
B. b点所得溶液中:c(H2SO3) + c(OH-) =c(SO32-) + c(H+)
C. c点所得溶液中:c(Na+) >3c(HSO3-)
D. d点所得溶液中:c(Na+) >c(SO32-) > c(H+)> c(OH-)
“一元强碱滴定二元弱酸”pH-体积图
a点:
b 半点为 NaHSO3溶液的质子守恒
c点:
d恰好点:Na2SO3单一溶液离子浓度大小比较
解
题
思
路
c(HSO3-) = c(H2SO3)
c(SO32-) = c(HSO3-)
C
c(Na+) + c(H+) = c(HSO3-) + 2c(SO32-) + c(OH-)
