10.1常见的酸第2课时(课件22页)
图片预览





文档简介
(共22张PPT)
课题1 常见的酸和碱
常见的酸(2)
1.浓硫酸的腐蚀性
实验10-3
实验时要注意安全,不要将浓硫酸沾到皮肤和衣服上,
实验物品应在玻璃片上进行实验。
P53
黑色
黑
黑
洞
腐蚀
氢
氧
脱水
化学
P53
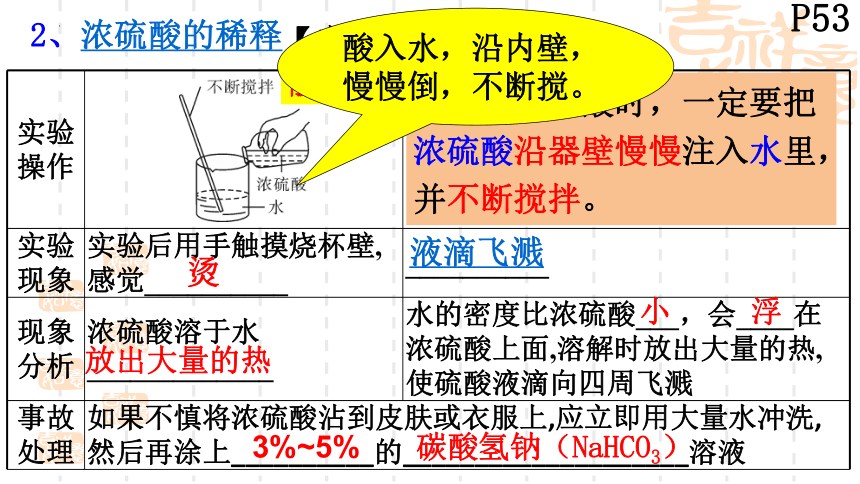
2、浓硫酸的稀释
【实验10-4】
实验 操作
实验 现象 实验后用手触摸烧杯壁,感觉__________ __________
现象 分析 浓硫酸溶于水_____________ 水的密度比浓硫酸___,会____在浓硫酸上面,溶解时放出大量的热,使硫酸液滴向四周飞溅
事故 处理 如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上__________的____________________溶液
烫
液滴飞溅
放出大量的热
小
浮
3%~5%
碳酸氢钠(NaHCO3)
散热
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
P53
酸入水,沿内壁,
慢慢倒,不断搅。
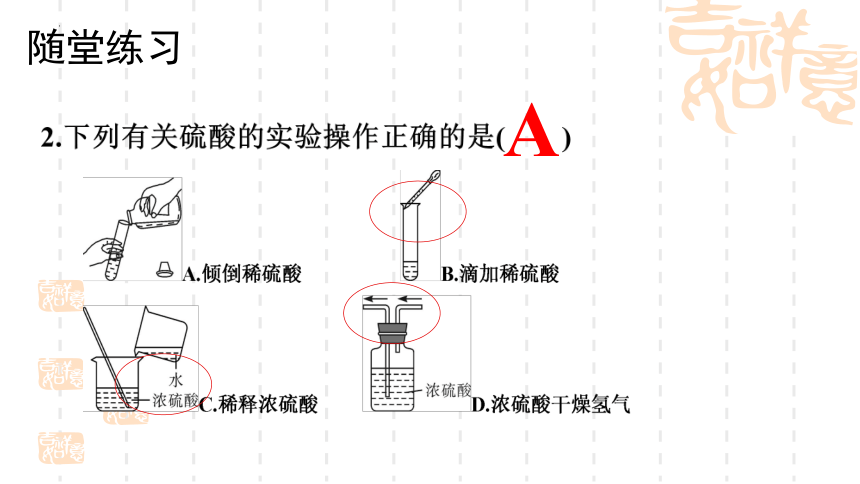
1.(教材母题:粤教版九下)下列实验操作或装置不正确的是( )
A.用装浓硫酸的洗气瓶干燥制备的氢气
B.用蘸浓硫酸的玻璃棒在纸上写字,观察其脱水性
C.往浓硫酸里慢慢地小心地滴蒸馏水,配制稀硫酸
D.实验时不慎沾浓硫酸在皮肤上,立即用干布抹去,再用大量水
冲洗
C
随堂练习
酸入水,沿内壁,
慢慢倒,不断搅。
A
随堂练习
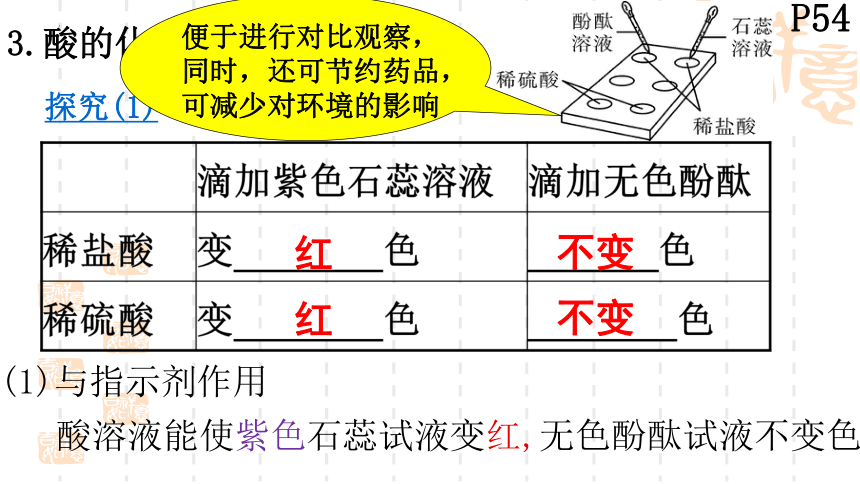
(1)与指示剂作用
3.酸的化学性质
酸溶液能使紫色石蕊试液变红,无色酚酞试液不变色
探究(1)
红
不变
红
不变
P54
便于进行对比观察,
同时,还可节约药品,
可减少对环境的影响
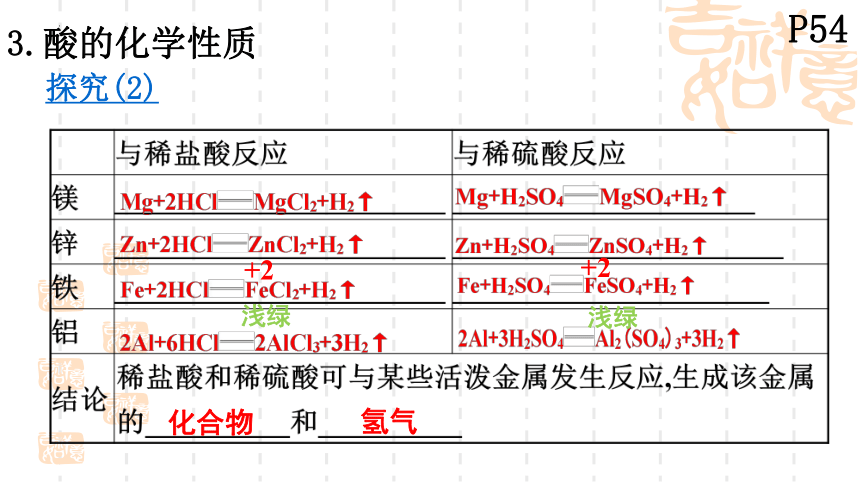
3.酸的化学性质
探究(2)
化合物
氢气
P54
+2
+2
浅绿
浅绿
镁、铝、锌、铁等活动性较强的氢前金属
都能与稀硫酸、盐酸发生置换反应,放出氢气,
同时生成一种称为盐的化合物。
(2)金属与酸反应
补充:
盐:
组成里含有金属离子和酸根离子的化合物。
结论:
如:NaCl、CuSO4、CaCO3、KClO3、KMnO4
金属 + 酸→盐 + 氢气
如:Zn + H2SO4 == ZnSO4 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
P54
B
随堂练习
+2
通过前面的学习我们已经知道,酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?请将你所知道的与同学们交流、讨论。
P54
消失
无
黄
消失
无
黄
金属
化合物
水
探究(3)
问题:
铁锈的主要成分是什么?请分别写出稀硫酸和稀盐酸与铁锈的主要成分反应的化学方程式。
+3
+3
黄色
黄色
P54
(3)金属氧化物与酸的反应
金属氧化物 + 酸→盐 + 水
CuO+ H2SO4 == CuSO4+ H2O
CuO + 2HCl ==CuCl2+ H2O
(蓝色)
(黑色)
(黑色)
(蓝色)
讨论:
利用上面的反应可以清除金属制品表面的锈,
除锈时能否将金属制品长时间浸在酸中?为什么?
P54
D
随堂练习
常见的酸
硫酸 H2SO4
酸的相似化学性质
与金属氧化物
常见的酸
盐酸 HCl
与指示剂
与活泼的氢前金属
紫色石蕊试液
变红
无色酚酞试液
不变色
→盐 + 水
→盐 + 氢气
P54
课堂小结
D
C
A
D
除去表面的铁锈
溶解除去残留的铁锈
在铁架台表面涂油漆;保持干燥放置(或其他合理答案)
6.如图表示化学反应中溶液的颜色变化,请回答下列问题。
(1)若X是稀硫酸,a可能是____________指示剂。
(2)若X是稀硫酸,写出②涉及的化学方程式:
____________________________________。
紫色石蕊溶液
H+
不可能
课题1 常见的酸和碱
常见的酸(2)
1.浓硫酸的腐蚀性
实验10-3
实验时要注意安全,不要将浓硫酸沾到皮肤和衣服上,
实验物品应在玻璃片上进行实验。
P53
黑色
黑
黑
洞
腐蚀
氢
氧
脱水
化学
P53
2、浓硫酸的稀释
【实验10-4】
实验 操作
实验 现象 实验后用手触摸烧杯壁,感觉__________ __________
现象 分析 浓硫酸溶于水_____________ 水的密度比浓硫酸___,会____在浓硫酸上面,溶解时放出大量的热,使硫酸液滴向四周飞溅
事故 处理 如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上__________的____________________溶液
烫
液滴飞溅
放出大量的热
小
浮
3%~5%
碳酸氢钠(NaHCO3)
散热
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
P53
酸入水,沿内壁,
慢慢倒,不断搅。
1.(教材母题:粤教版九下)下列实验操作或装置不正确的是( )
A.用装浓硫酸的洗气瓶干燥制备的氢气
B.用蘸浓硫酸的玻璃棒在纸上写字,观察其脱水性
C.往浓硫酸里慢慢地小心地滴蒸馏水,配制稀硫酸
D.实验时不慎沾浓硫酸在皮肤上,立即用干布抹去,再用大量水
冲洗
C
随堂练习
酸入水,沿内壁,
慢慢倒,不断搅。
A
随堂练习
(1)与指示剂作用
3.酸的化学性质
酸溶液能使紫色石蕊试液变红,无色酚酞试液不变色
探究(1)
红
不变
红
不变
P54
便于进行对比观察,
同时,还可节约药品,
可减少对环境的影响
3.酸的化学性质
探究(2)
化合物
氢气
P54
+2
+2
浅绿
浅绿
镁、铝、锌、铁等活动性较强的氢前金属
都能与稀硫酸、盐酸发生置换反应,放出氢气,
同时生成一种称为盐的化合物。
(2)金属与酸反应
补充:
盐:
组成里含有金属离子和酸根离子的化合物。
结论:
如:NaCl、CuSO4、CaCO3、KClO3、KMnO4
金属 + 酸→盐 + 氢气
如:Zn + H2SO4 == ZnSO4 + H2↑
Fe + 2HCl == FeCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑
P54
B
随堂练习
+2
通过前面的学习我们已经知道,酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?请将你所知道的与同学们交流、讨论。
P54
消失
无
黄
消失
无
黄
金属
化合物
水
探究(3)
问题:
铁锈的主要成分是什么?请分别写出稀硫酸和稀盐酸与铁锈的主要成分反应的化学方程式。
+3
+3
黄色
黄色
P54
(3)金属氧化物与酸的反应
金属氧化物 + 酸→盐 + 水
CuO+ H2SO4 == CuSO4+ H2O
CuO + 2HCl ==CuCl2+ H2O
(蓝色)
(黑色)
(黑色)
(蓝色)
讨论:
利用上面的反应可以清除金属制品表面的锈,
除锈时能否将金属制品长时间浸在酸中?为什么?
P54
D
随堂练习
常见的酸
硫酸 H2SO4
酸的相似化学性质
与金属氧化物
常见的酸
盐酸 HCl
与指示剂
与活泼的氢前金属
紫色石蕊试液
变红
无色酚酞试液
不变色
→盐 + 水
→盐 + 氢气
P54
课堂小结
D
C
A
D
除去表面的铁锈
溶解除去残留的铁锈
在铁架台表面涂油漆;保持干燥放置(或其他合理答案)
6.如图表示化学反应中溶液的颜色变化,请回答下列问题。
(1)若X是稀硫酸,a可能是____________指示剂。
(2)若X是稀硫酸,写出②涉及的化学方程式:
____________________________________。
紫色石蕊溶液
H+
不可能
同课章节目录
