第十单元实验活动6 酸、碱的化学性质课件(16页)
文档属性
| 名称 | 第十单元实验活动6 酸、碱的化学性质课件(16页) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 16:47:34 | ||
图片预览






文档简介
(共16张PPT)
第十单元 酸和碱
实验活动6 酸、碱的化学性质
金属氧化物
非金属氧化物
盐和水
盐和氢气
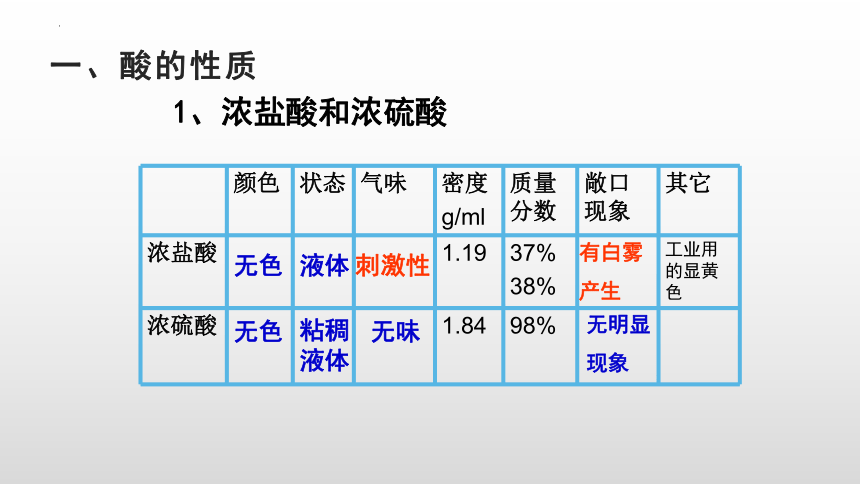
一、酸的性质
1、浓盐酸和浓硫酸
颜色 状态 气味 密度 g/ml 质量分数 敞口现象 其它
浓盐酸 1.19 37% 38% 工业用的显黄色
浓硫酸 1.84 98%
无色
液体
无味
刺激性
无色
粘稠液体
有白雾
产生
无明显
现象
二、酸的化学性质
1、酸与酸碱指示剂反应
盐酸
使紫色石蕊试液变红,
使无色酚酞不变色,
使蓝色石蕊试纸变红
硫酸呢?
三、小结:不同的酸都能电离出共同的H+,酸性即H+的性质,故酸的通性有以下五条:
1、酸跟酸碱指示剂的反应
2、酸 + 活泼金属--- 盐 + 氢气
3、酸 + 金属氧化物--- 盐+ 水
4、酸 + 碱 --- 盐 + 水
5、酸 + 盐--- 新酸 + 新盐
【置换反应】
【复分解反应】
C
D
D
黄色
4、5
D
答案 D
微溶
52.2%
7.归纳总结是学习的重要方法。小明同学结合常见酸(HCl、H2SO4)的性质与变化绘制出下图。图中“——”两端的物质都能够反应,其中酸碱中和反应生成盐和水,其他连线的产物也是盐和水的是( C )
8.将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处。
(1)浓盐酸的质量和放置天数关系的曲线,正确的是______
(2)随着放置天数的增加,浓盐酸的质量发生变化的主要原因是 。
(3)把浓盐酸稀释后可用于去除铁制品表面的铁锈(主要成分为Fe2O3),反应的化学方程式_________________________ 。
乙
浓盐酸有挥发性
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
第十单元 酸和碱
实验活动6 酸、碱的化学性质
金属氧化物
非金属氧化物
盐和水
盐和氢气
一、酸的性质
1、浓盐酸和浓硫酸
颜色 状态 气味 密度 g/ml 质量分数 敞口现象 其它
浓盐酸 1.19 37% 38% 工业用的显黄色
浓硫酸 1.84 98%
无色
液体
无味
刺激性
无色
粘稠液体
有白雾
产生
无明显
现象
二、酸的化学性质
1、酸与酸碱指示剂反应
盐酸
使紫色石蕊试液变红,
使无色酚酞不变色,
使蓝色石蕊试纸变红
硫酸呢?
三、小结:不同的酸都能电离出共同的H+,酸性即H+的性质,故酸的通性有以下五条:
1、酸跟酸碱指示剂的反应
2、酸 + 活泼金属--- 盐 + 氢气
3、酸 + 金属氧化物--- 盐+ 水
4、酸 + 碱 --- 盐 + 水
5、酸 + 盐--- 新酸 + 新盐
【置换反应】
【复分解反应】
C
D
D
黄色
4、5
D
答案 D
微溶
52.2%
7.归纳总结是学习的重要方法。小明同学结合常见酸(HCl、H2SO4)的性质与变化绘制出下图。图中“——”两端的物质都能够反应,其中酸碱中和反应生成盐和水,其他连线的产物也是盐和水的是( C )
8.将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处。
(1)浓盐酸的质量和放置天数关系的曲线,正确的是______
(2)随着放置天数的增加,浓盐酸的质量发生变化的主要原因是 。
(3)把浓盐酸稀释后可用于去除铁制品表面的铁锈(主要成分为Fe2O3),反应的化学方程式_________________________ 。
乙
浓盐酸有挥发性
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
同课章节目录
