第十一单元实验活动8粗盐提纯课件(54页)
文档属性
| 名称 | 第十一单元实验活动8粗盐提纯课件(54页) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 00:00:00 | ||
图片预览






文档简介
(共54张PPT)
粗盐
精盐
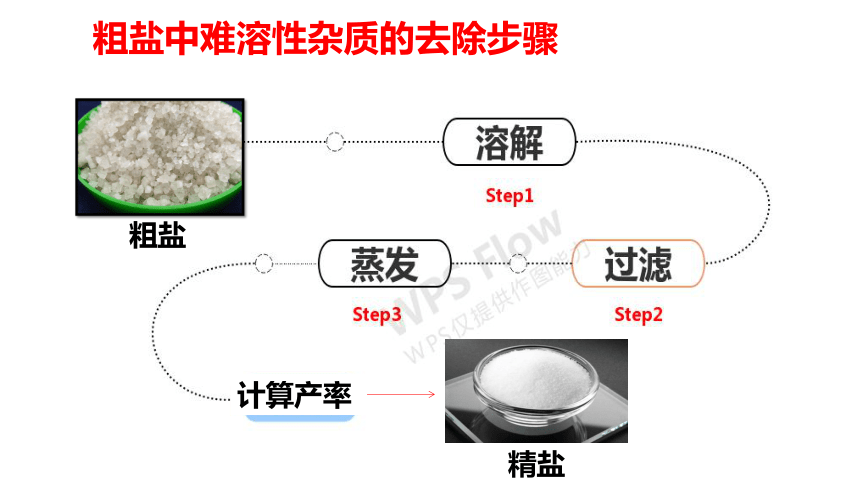
粗盐中难溶性杂质的去除
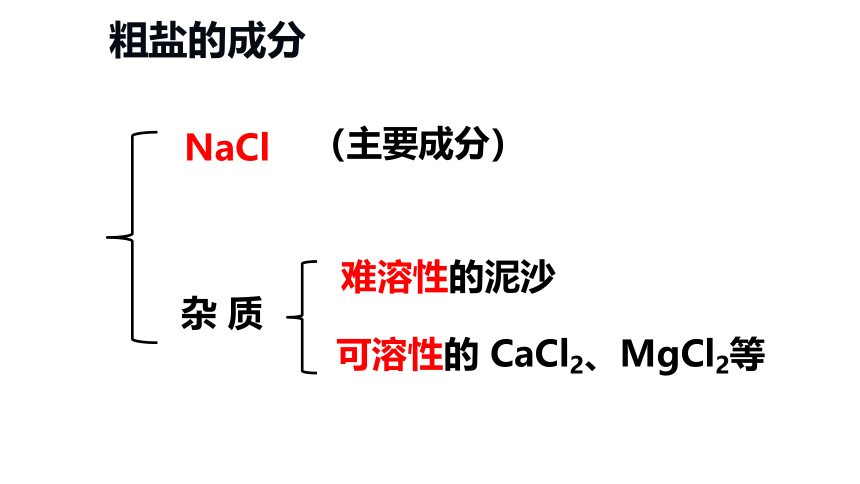
粗盐的成分
杂 质
NaCl
(主要成分)
难溶性的泥沙
可溶性的 CaCl2、MgCl2等
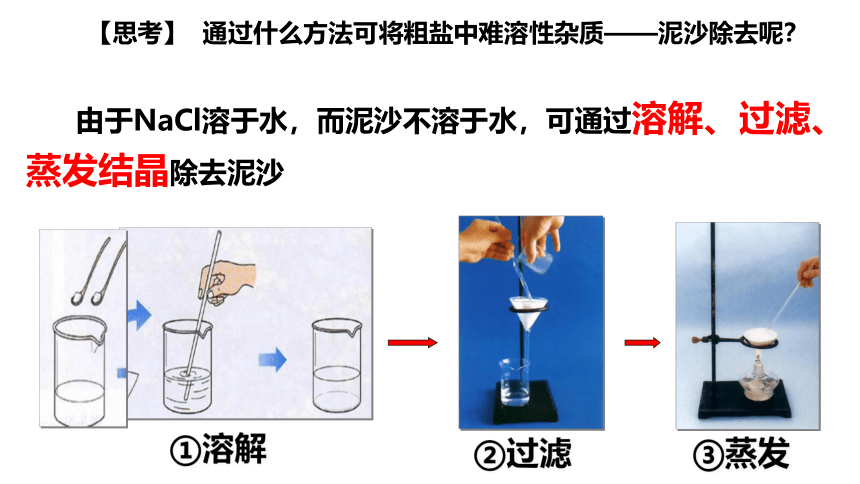
【思考】 通过什么方法可将粗盐中难溶性杂质——泥沙除去呢?
由于NaCl溶于水,而泥沙不溶于水,可通过溶解、过滤、蒸发结晶除去泥沙
①溶解
②过滤
③蒸发
粗盐
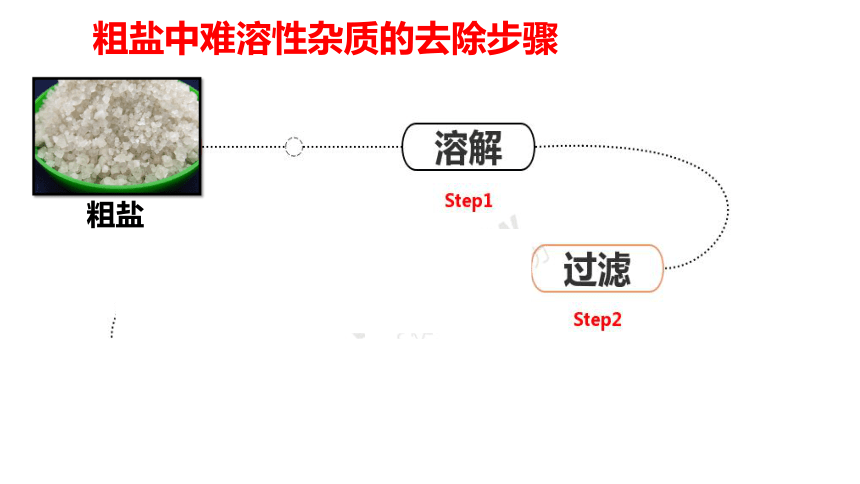
粗盐中难溶性杂质的去除
粗盐中难溶性杂质的去除步骤
步骤一:溶解
用托盘天平称取10.0g粗盐,用药匙将粗盐逐渐加入盛有10ml水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称量剩下的粗盐.
称取粗盐/g 剩余粗盐/g 溶解粗盐/g
一、实验步骤和注意事项
溶解时玻璃棒的作用
搅拌,加速溶解
粗盐
粗盐中难溶性杂质的去除步骤
探究多思:过滤时我们需要注意什么?
1、一贴
2、二低
3、三靠
滤纸紧贴漏斗内壁。
滤纸边缘要低于漏斗边;
液体液面要低于滤纸边缘;
烧杯嘴要紧靠玻璃棒;
玻璃棒下端要靠在三层滤纸一边;
漏斗管末端要紧靠烧杯内壁。
精盐
粗盐
计算产率
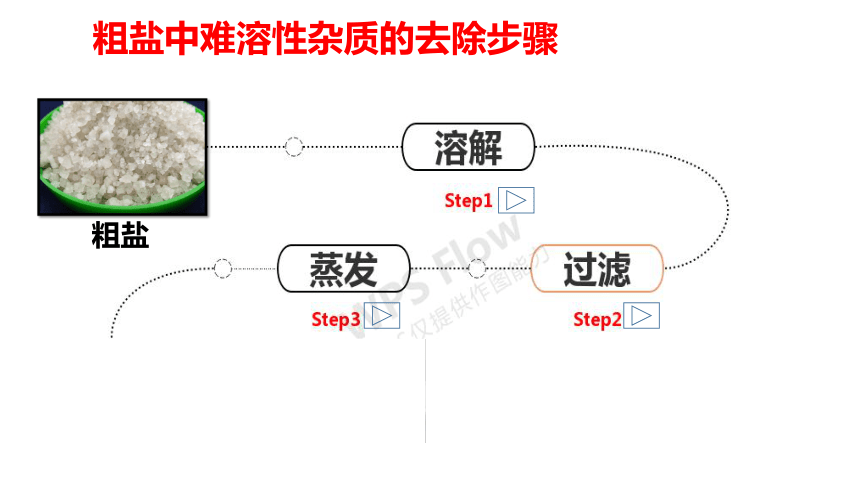
粗盐中难溶性杂质的去除步骤
思考:蒸发时我们需要注意什么?
1、加热过程中,用玻璃棒不断搅动,防止由于局部温度过高, 。
2、当蒸发皿中 ,即停止加热,利用余热使滤液蒸干。
3、停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
造成液滴飞溅
出现较多量固体时
精盐
粗盐
计算产率
粗盐中难溶性杂质的去除步骤
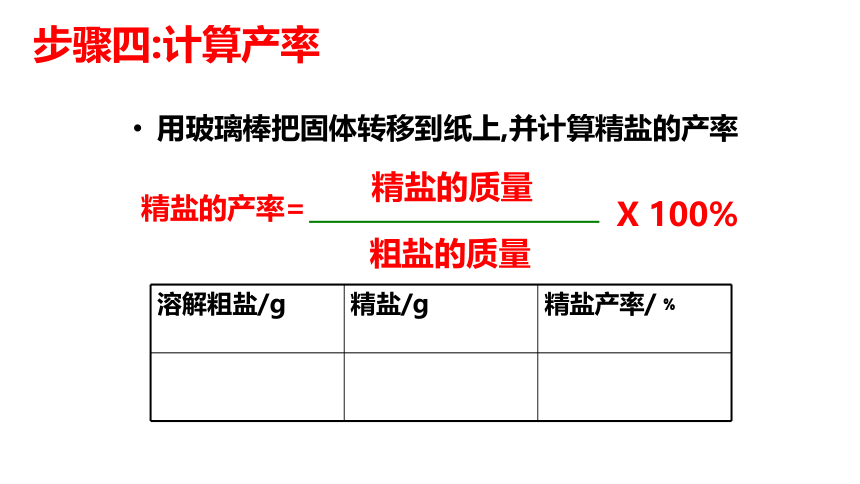
步骤四:计算产率
用玻璃棒把固体转移到纸上,并计算精盐的产率
精盐的产率=
溶解粗盐/g 精盐/g 精盐产率/﹪
精盐的质量
粗盐的质量
X 100%
精盐
粗盐
计算产率
粗盐中难溶性杂质的去除步骤
烧杯、玻璃棒、漏斗、铁架台、滤纸、蒸发皿、
坩埚钳、酒精灯、药匙、量筒、托盘天平、火柴。
实验反思1:根据实验操作,我们需要哪些实验用品?
反思2
1、在实验流程中几次用到的玻璃棒,作用分别是什么?
2、在过滤、蒸发过程中有哪些注意事项?
搅拌,加速溶解
引流
搅拌,防止液滴飞溅
反思3:小明实验最后的产率低于老师给出的理论产率,请问可能是哪些原因?
溶解时未将食盐充分溶解;
蒸发时未用玻璃棒搅拌有液滴飞溅
转移液体或晶体时未完全转移
过滤时液滴溅出;
1、下列各组物质中,可依次通过溶解、过滤、蒸发等操作进行分离的是( )
A.水和植物油
B.氯化镁和氯化银
C.二氧化锰粉末和铁粉
D.氯化钡和硝酸镁
B
堂堂清
2、下列是关于“粗盐提纯”实验的几种说法,其中正确的是( )
A.为加快过滤速率,应用玻璃棒不断搅拌过滤器内的液体
B.粗盐经过溶解、过滤、蒸发、结晶后得到纯净的氯化钠
C.蒸发滤液时要用玻璃棒不断搅拌,用酒精灯持续加热直到蒸干为止
D.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因
D
3、某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g5%的氯化钠溶液
实验一:如图是同学们做粗盐提纯实验的操作示意图.
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 .
(3)粗盐提纯实验的操作顺序为 ( 填操作序号)、称量精盐并计算产率.
(4)操作④中,当观察到 时,停止加热.
加速溶解
未用玻璃棒引流
①⑤②③⑥④
出现较多固体
(5)、用提纯得到的精盐配制了50g 5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有 (填序号)
①氯化钠固体仍然不纯
②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
①②③
(2017年衡阳)实验小组的同学欲对一粗盐样品进行初步提纯。
(1)提纯的步骤是:①溶解 ②过滤 ③ ④计算产率;
(2)过滤操作的要点可概括为“一贴、二低、三靠”,写出“三靠”中的任“一靠”操作 ,
(3)在第③步骤中使用了玻璃棒,玻璃棒的作用: .
(4)实验小组通过计算发现,实验测得的结果比实际偏低。请分析可能的原因: .
中考链接
蒸发
玻璃棒紧靠三层滤纸处等
防止液体飞溅
过滤时有液体洒出等
实验中几次用到玻璃棒,其作用是什么?
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
搅拌,加速溶解
引流
搅拌,防止液滴飞溅
【实验步骤】
用托盘天平称取5.0g粗盐,用药匙将粗盐逐渐加入盛有10ml水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称量剩下的粗盐.
称取粗盐/g 剩余粗盐/g 溶解粗盐/g
5.0
1、溶解
2、过滤
2、过滤
【思考1】:过滤操作时应注意什么?
“一贴、二低、三靠"
“一贴”滤纸紧贴漏斗内壁。
“二低” 滤纸边缘要低于漏斗边
液体液面要低于滤纸边缘
“三靠”烧杯嘴要紧靠玻璃棒
玻璃棒下端要靠在三层滤纸一边
漏斗管末端要紧靠烧杯内壁。
【思考2】如滤液仍浑浊,有哪些原因
1.液面高于滤纸边缘
2.滤纸破损
3.仪器不干净
1、要想从食盐水中得到食盐晶体,接下来要进行什么操作?
蒸发溶剂结晶
2、为什么用蒸发溶剂结晶,而不用降温的方法结晶?
氯化钠溶解度受温度影响小
3、蒸发
把所得澄清滤液倒入蒸发皿中, 用酒精灯外焰加热.
【思考3】蒸发操作时应该注意什么?
蒸发操作时的注意事项:
3、停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
1.加热过程中,用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。
2.当蒸发皿中出现较多量固体时,即停止加热,利用余热使滤液蒸干。
4、计算产率
用玻璃棒把固体转移到纸上,并计算精盐的产率
溶解粗盐/g 精盐/g 精盐产率/﹪
精盐的质量
粗盐的质量
X 100%
精盐的产率=
思考:小明实验最后的产率低于老师给出的理论产率,请问可能是哪些原因?
溶解时未将食盐充分溶解;
过滤时液滴溅出;
蒸发时未用玻璃棒搅拌有液滴飞溅
转移液体或晶体时未完全转移
交流与讨论:
实验中几次用到玻璃棒,其作用是什么?
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
搅拌,加速溶解
引流
搅拌,防止液滴飞溅
1、下列是关于“粗盐提纯”实验的几种说法,其中正确的是( )
A.为加快过滤速率,应用玻璃棒不断搅拌过滤器内的液体
B.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因
C.蒸发滤液时要用玻璃棒不断搅拌,用酒精灯持续加热直到蒸干为止
D.粗盐经过溶解、过滤、蒸发、结晶后得到纯净的氯化钠
B
堂堂清
2.下列各组物质中,可依次通过溶解、
过滤、蒸发等操作进行分离的是( )
A.水和植物油
B.氯化镁和氯化银
C.二氧化锰粉末和铁粉
D.氯化钡和硝酸镁
B
3、某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g5%的氯化钠溶液
实验一:如图是同学们做粗盐提纯实验的操作示意图.
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 .
(3)粗盐提纯实验的操作顺序为 ( 填操作序号)、称量精盐并计算产率.
(4)操作④中,当观察到 时,停止加热.
加速溶解
未用玻璃棒引流
①⑤②③⑥④
出现较多固体
实验二:用提纯得到的精盐配制了50g 5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有 (填序号)
①氯化钠固体仍然不纯
②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
①②③
一、请根据物质的名称写出化学式和俗名
(1)氢氧化钠 ; 。
(2)氢氧化钙 ; 。
(3)氧化钙: ; 。
(4)碳酸钙: ; 的主要成分
(5)碳酸钠: ; 。
(6)碳酸氢钠: ; 。
(7)氯化钠: ; 的主要成分
(8)乙醇: ; 。
(9)甲烷: ; 的主要成分
NaOH
烧碱 火碱 苛性钠
Ca(OH)2
熟石灰 消石灰
石灰水,石灰浆,石灰乳
CaO
生石灰
CaCO3
大理石 石灰石
Na2CO3
纯碱 苏打
NaHCO3
小苏打
NaCl
食盐
C2H5OH
酒精
CH4
天然气
练 习(上节课习题)
1、下列属于复分解反应的是 ( )
A. 2NaOH+CO2=Na2CO3+H2O
B. Zn+H2SO4=ZnSO4+H2↑
C. Na2CO3+2HCl=2NaCl+CO2↑+H2O
D. CaCO3 CaO+CO2↑
C
2、下列物质反应,不是复分解的是()
A. Na2CO3溶液加入Ca(OH)2中 B. Fe2O3加入HCl溶液中
C. CO2通入澄清石灰水中 D. 稀HCl滴入NaOH溶液中
C
3、下列各组物质在溶液中能发生反应且无明显现象的是( )
A、BaCl2与Na2SO4
B、HCl与NaHCO3
C、KNO3与NaOH
D、NaOH与HCl
D
4、下列不能发生复分解反应的是( )
A、稀盐酸,氢氧化钙
B、碳酸钠,稀硫酸
C、硝酸银,氯化钡
D、氯化钾,硫酸铜
D
5、下列物质中既能与稀盐酸反应又可以和石灰水反应的是( )
A. 硫酸铜 B. 稀硝酸
C. 碳酸钠 D. 氧化铁
C
6、X可以发生如下反应:
①X+酸→盐+水;
②X+非金属氧化物→盐+水.
X可能是( )
A、氧化铜 B、盐酸
C、氢氧化钠 D、碳酸钠
C
4、粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。
⑴仪器B和E的名称是 和 。
⑵称量食盐应放在仪器A的 盘。
⑶蒸发时要用到F,其作用是 ,
目的是 。
(4)等到蒸发皿中出现较多固体时,停止加热利用蒸发皿的余热使滤液蒸干,移去蒸发皿时应使用的仪器是 。
漏斗
左
搅拌,使液体受热均匀
蒸发皿
防止液滴飞溅
坩埚钳
二、粗盐中可溶性杂质的去除
粗盐
加水溶解
过滤
泥沙
精盐(主要含有NaCl)
还含有MgCl2、CaCl2、Na2SO4等可溶性杂质
如何除去这些可溶性杂质呢?
试剂:NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
粗盐
加水溶解
过滤
泥沙
溶液A
NaCl、MgCl2、CaCl2、Na2SO4
过量NaOH溶液
溶液B+Mg(OH)2↓
NaCl、CaCl2、Na2SO4、NaOH
过量的BaCl2溶液
溶液C +Mg(OH)2↓+BaSO4↓
NaCl、CaCl2、NaOH、BaCl2
过量的Na2CO3
溶液D +Mg(OH)2↓+BaSO4↓+CaCO3↓+BaCO3↓
NaCl、NaOH、Na2CO3
过滤
沉淀
溶液D
过量HCl
溶液E
NaCl、NaOH、Na2CO3
NaCl+HCl
蒸发结晶
氯化钠晶体
提问:
1、BaCl2溶液和Na2CO3溶液的加入顺序能否调换?
不能,调换的话会有BaCl2杂质难以除去
加入顺序注意:BaCl2在Na2CO3前,盐酸在最后.
2、最后精盐中NaCl的质量比粗盐中NaCl的质量 ,为什么?
大
实验过程中有NaCl生成
1.下列各组物质,能够用溶解、过滤、蒸发结晶的步骤分离的是( )
A.硝酸钾和食盐
B.氯化钠和砂糖
C.碳酸钙和氯化钙
D.碳酸钠和硝酸钠
C
堂堂清:
2、下列是关于“粗盐提纯”实验的几种说法,其中正确的是( )
A.为加快过滤速率,应用玻璃棒不断搅拌过滤器内的液体
B.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因
C.蒸发滤液时要用玻璃棒不断搅拌,用酒精灯持续加热直到蒸干为止
D.粗盐经过溶解、过滤、蒸发、结晶后得到纯净的氯化钠
B
3、为了除去粗盐中的Ca2+、Mg2+、S042-等离子,可将粗盐溶于水后进行如下操作:
①加入适量盐酸;②加过量NaOH察液;③加过量Na2CO3溶液④加过量BaCl2溶液;⑤过滤。下列操作顺序合理的是( )
A②③④⑤①、 B.②④③⑤①
C.④②③①⑤ D.④③②①⑤
B
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是_______。
(2)操作⑥中的错误是_______________。
(3)粗盐提纯实验的操作顺序为____________
(填操作序号)、 称量精盐并计算产率。
(4)操作④中,当观察到_____________时,停止加热。
加速溶解
未用玻璃棒引流
出现较多固体
①⑤②③⑥④
4、如图是同学们做粗盐提纯实验的操作示意图。
(5)粗盐提纯的步骤是______、过滤、______、计算产率。
(6)蒸发过程中使用玻璃棒的作用和目的是____________________________________
______。
(7)如果图⑥中的滤液仍然浑浊,就应该____________。
溶解
搅拌,防止液体因局部温度过高引起液滴飞溅
再过滤一次
蒸发
粗盐
精盐
粗盐中难溶性杂质的去除
粗盐的成分
杂 质
NaCl
(主要成分)
难溶性的泥沙
可溶性的 CaCl2、MgCl2等
【思考】 通过什么方法可将粗盐中难溶性杂质——泥沙除去呢?
由于NaCl溶于水,而泥沙不溶于水,可通过溶解、过滤、蒸发结晶除去泥沙
①溶解
②过滤
③蒸发
粗盐
粗盐中难溶性杂质的去除
粗盐中难溶性杂质的去除步骤
步骤一:溶解
用托盘天平称取10.0g粗盐,用药匙将粗盐逐渐加入盛有10ml水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称量剩下的粗盐.
称取粗盐/g 剩余粗盐/g 溶解粗盐/g
一、实验步骤和注意事项
溶解时玻璃棒的作用
搅拌,加速溶解
粗盐
粗盐中难溶性杂质的去除步骤
探究多思:过滤时我们需要注意什么?
1、一贴
2、二低
3、三靠
滤纸紧贴漏斗内壁。
滤纸边缘要低于漏斗边;
液体液面要低于滤纸边缘;
烧杯嘴要紧靠玻璃棒;
玻璃棒下端要靠在三层滤纸一边;
漏斗管末端要紧靠烧杯内壁。
精盐
粗盐
计算产率
粗盐中难溶性杂质的去除步骤
思考:蒸发时我们需要注意什么?
1、加热过程中,用玻璃棒不断搅动,防止由于局部温度过高, 。
2、当蒸发皿中 ,即停止加热,利用余热使滤液蒸干。
3、停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
造成液滴飞溅
出现较多量固体时
精盐
粗盐
计算产率
粗盐中难溶性杂质的去除步骤
步骤四:计算产率
用玻璃棒把固体转移到纸上,并计算精盐的产率
精盐的产率=
溶解粗盐/g 精盐/g 精盐产率/﹪
精盐的质量
粗盐的质量
X 100%
精盐
粗盐
计算产率
粗盐中难溶性杂质的去除步骤
烧杯、玻璃棒、漏斗、铁架台、滤纸、蒸发皿、
坩埚钳、酒精灯、药匙、量筒、托盘天平、火柴。
实验反思1:根据实验操作,我们需要哪些实验用品?
反思2
1、在实验流程中几次用到的玻璃棒,作用分别是什么?
2、在过滤、蒸发过程中有哪些注意事项?
搅拌,加速溶解
引流
搅拌,防止液滴飞溅
反思3:小明实验最后的产率低于老师给出的理论产率,请问可能是哪些原因?
溶解时未将食盐充分溶解;
蒸发时未用玻璃棒搅拌有液滴飞溅
转移液体或晶体时未完全转移
过滤时液滴溅出;
1、下列各组物质中,可依次通过溶解、过滤、蒸发等操作进行分离的是( )
A.水和植物油
B.氯化镁和氯化银
C.二氧化锰粉末和铁粉
D.氯化钡和硝酸镁
B
堂堂清
2、下列是关于“粗盐提纯”实验的几种说法,其中正确的是( )
A.为加快过滤速率,应用玻璃棒不断搅拌过滤器内的液体
B.粗盐经过溶解、过滤、蒸发、结晶后得到纯净的氯化钠
C.蒸发滤液时要用玻璃棒不断搅拌,用酒精灯持续加热直到蒸干为止
D.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因
D
3、某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g5%的氯化钠溶液
实验一:如图是同学们做粗盐提纯实验的操作示意图.
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 .
(3)粗盐提纯实验的操作顺序为 ( 填操作序号)、称量精盐并计算产率.
(4)操作④中,当观察到 时,停止加热.
加速溶解
未用玻璃棒引流
①⑤②③⑥④
出现较多固体
(5)、用提纯得到的精盐配制了50g 5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有 (填序号)
①氯化钠固体仍然不纯
②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
①②③
(2017年衡阳)实验小组的同学欲对一粗盐样品进行初步提纯。
(1)提纯的步骤是:①溶解 ②过滤 ③ ④计算产率;
(2)过滤操作的要点可概括为“一贴、二低、三靠”,写出“三靠”中的任“一靠”操作 ,
(3)在第③步骤中使用了玻璃棒,玻璃棒的作用: .
(4)实验小组通过计算发现,实验测得的结果比实际偏低。请分析可能的原因: .
中考链接
蒸发
玻璃棒紧靠三层滤纸处等
防止液体飞溅
过滤时有液体洒出等
实验中几次用到玻璃棒,其作用是什么?
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
搅拌,加速溶解
引流
搅拌,防止液滴飞溅
【实验步骤】
用托盘天平称取5.0g粗盐,用药匙将粗盐逐渐加入盛有10ml水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解为止,称量剩下的粗盐.
称取粗盐/g 剩余粗盐/g 溶解粗盐/g
5.0
1、溶解
2、过滤
2、过滤
【思考1】:过滤操作时应注意什么?
“一贴、二低、三靠"
“一贴”滤纸紧贴漏斗内壁。
“二低” 滤纸边缘要低于漏斗边
液体液面要低于滤纸边缘
“三靠”烧杯嘴要紧靠玻璃棒
玻璃棒下端要靠在三层滤纸一边
漏斗管末端要紧靠烧杯内壁。
【思考2】如滤液仍浑浊,有哪些原因
1.液面高于滤纸边缘
2.滤纸破损
3.仪器不干净
1、要想从食盐水中得到食盐晶体,接下来要进行什么操作?
蒸发溶剂结晶
2、为什么用蒸发溶剂结晶,而不用降温的方法结晶?
氯化钠溶解度受温度影响小
3、蒸发
把所得澄清滤液倒入蒸发皿中, 用酒精灯外焰加热.
【思考3】蒸发操作时应该注意什么?
蒸发操作时的注意事项:
3、停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
1.加热过程中,用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。
2.当蒸发皿中出现较多量固体时,即停止加热,利用余热使滤液蒸干。
4、计算产率
用玻璃棒把固体转移到纸上,并计算精盐的产率
溶解粗盐/g 精盐/g 精盐产率/﹪
精盐的质量
粗盐的质量
X 100%
精盐的产率=
思考:小明实验最后的产率低于老师给出的理论产率,请问可能是哪些原因?
溶解时未将食盐充分溶解;
过滤时液滴溅出;
蒸发时未用玻璃棒搅拌有液滴飞溅
转移液体或晶体时未完全转移
交流与讨论:
实验中几次用到玻璃棒,其作用是什么?
溶解时玻璃棒的作用是
过滤时玻璃棒的作用是
蒸发时玻璃棒的作用是
搅拌,加速溶解
引流
搅拌,防止液滴飞溅
1、下列是关于“粗盐提纯”实验的几种说法,其中正确的是( )
A.为加快过滤速率,应用玻璃棒不断搅拌过滤器内的液体
B.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因
C.蒸发滤液时要用玻璃棒不断搅拌,用酒精灯持续加热直到蒸干为止
D.粗盐经过溶解、过滤、蒸发、结晶后得到纯净的氯化钠
B
堂堂清
2.下列各组物质中,可依次通过溶解、
过滤、蒸发等操作进行分离的是( )
A.水和植物油
B.氯化镁和氯化银
C.二氧化锰粉末和铁粉
D.氯化钡和硝酸镁
B
3、某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g5%的氯化钠溶液
实验一:如图是同学们做粗盐提纯实验的操作示意图.
(1)操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的错误是 .
(3)粗盐提纯实验的操作顺序为 ( 填操作序号)、称量精盐并计算产率.
(4)操作④中,当观察到 时,停止加热.
加速溶解
未用玻璃棒引流
①⑤②③⑥④
出现较多固体
实验二:用提纯得到的精盐配制了50g 5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有 (填序号)
①氯化钠固体仍然不纯
②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
①②③
一、请根据物质的名称写出化学式和俗名
(1)氢氧化钠 ; 。
(2)氢氧化钙 ; 。
(3)氧化钙: ; 。
(4)碳酸钙: ; 的主要成分
(5)碳酸钠: ; 。
(6)碳酸氢钠: ; 。
(7)氯化钠: ; 的主要成分
(8)乙醇: ; 。
(9)甲烷: ; 的主要成分
NaOH
烧碱 火碱 苛性钠
Ca(OH)2
熟石灰 消石灰
石灰水,石灰浆,石灰乳
CaO
生石灰
CaCO3
大理石 石灰石
Na2CO3
纯碱 苏打
NaHCO3
小苏打
NaCl
食盐
C2H5OH
酒精
CH4
天然气
练 习(上节课习题)
1、下列属于复分解反应的是 ( )
A. 2NaOH+CO2=Na2CO3+H2O
B. Zn+H2SO4=ZnSO4+H2↑
C. Na2CO3+2HCl=2NaCl+CO2↑+H2O
D. CaCO3 CaO+CO2↑
C
2、下列物质反应,不是复分解的是()
A. Na2CO3溶液加入Ca(OH)2中 B. Fe2O3加入HCl溶液中
C. CO2通入澄清石灰水中 D. 稀HCl滴入NaOH溶液中
C
3、下列各组物质在溶液中能发生反应且无明显现象的是( )
A、BaCl2与Na2SO4
B、HCl与NaHCO3
C、KNO3与NaOH
D、NaOH与HCl
D
4、下列不能发生复分解反应的是( )
A、稀盐酸,氢氧化钙
B、碳酸钠,稀硫酸
C、硝酸银,氯化钡
D、氯化钾,硫酸铜
D
5、下列物质中既能与稀盐酸反应又可以和石灰水反应的是( )
A. 硫酸铜 B. 稀硝酸
C. 碳酸钠 D. 氧化铁
C
6、X可以发生如下反应:
①X+酸→盐+水;
②X+非金属氧化物→盐+水.
X可能是( )
A、氧化铜 B、盐酸
C、氢氧化钠 D、碳酸钠
C
4、粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。
⑴仪器B和E的名称是 和 。
⑵称量食盐应放在仪器A的 盘。
⑶蒸发时要用到F,其作用是 ,
目的是 。
(4)等到蒸发皿中出现较多固体时,停止加热利用蒸发皿的余热使滤液蒸干,移去蒸发皿时应使用的仪器是 。
漏斗
左
搅拌,使液体受热均匀
蒸发皿
防止液滴飞溅
坩埚钳
二、粗盐中可溶性杂质的去除
粗盐
加水溶解
过滤
泥沙
精盐(主要含有NaCl)
还含有MgCl2、CaCl2、Na2SO4等可溶性杂质
如何除去这些可溶性杂质呢?
试剂:NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
粗盐
加水溶解
过滤
泥沙
溶液A
NaCl、MgCl2、CaCl2、Na2SO4
过量NaOH溶液
溶液B+Mg(OH)2↓
NaCl、CaCl2、Na2SO4、NaOH
过量的BaCl2溶液
溶液C +Mg(OH)2↓+BaSO4↓
NaCl、CaCl2、NaOH、BaCl2
过量的Na2CO3
溶液D +Mg(OH)2↓+BaSO4↓+CaCO3↓+BaCO3↓
NaCl、NaOH、Na2CO3
过滤
沉淀
溶液D
过量HCl
溶液E
NaCl、NaOH、Na2CO3
NaCl+HCl
蒸发结晶
氯化钠晶体
提问:
1、BaCl2溶液和Na2CO3溶液的加入顺序能否调换?
不能,调换的话会有BaCl2杂质难以除去
加入顺序注意:BaCl2在Na2CO3前,盐酸在最后.
2、最后精盐中NaCl的质量比粗盐中NaCl的质量 ,为什么?
大
实验过程中有NaCl生成
1.下列各组物质,能够用溶解、过滤、蒸发结晶的步骤分离的是( )
A.硝酸钾和食盐
B.氯化钠和砂糖
C.碳酸钙和氯化钙
D.碳酸钠和硝酸钠
C
堂堂清:
2、下列是关于“粗盐提纯”实验的几种说法,其中正确的是( )
A.为加快过滤速率,应用玻璃棒不断搅拌过滤器内的液体
B.如果经两次过滤滤液仍浑浊,则应检查实验装置并分析原因
C.蒸发滤液时要用玻璃棒不断搅拌,用酒精灯持续加热直到蒸干为止
D.粗盐经过溶解、过滤、蒸发、结晶后得到纯净的氯化钠
B
3、为了除去粗盐中的Ca2+、Mg2+、S042-等离子,可将粗盐溶于水后进行如下操作:
①加入适量盐酸;②加过量NaOH察液;③加过量Na2CO3溶液④加过量BaCl2溶液;⑤过滤。下列操作顺序合理的是( )
A②③④⑤①、 B.②④③⑤①
C.④②③①⑤ D.④③②①⑤
B
请回答下列问题:
(1)操作③中用玻璃棒搅拌的作用是_______。
(2)操作⑥中的错误是_______________。
(3)粗盐提纯实验的操作顺序为____________
(填操作序号)、 称量精盐并计算产率。
(4)操作④中,当观察到_____________时,停止加热。
加速溶解
未用玻璃棒引流
出现较多固体
①⑤②③⑥④
4、如图是同学们做粗盐提纯实验的操作示意图。
(5)粗盐提纯的步骤是______、过滤、______、计算产率。
(6)蒸发过程中使用玻璃棒的作用和目的是____________________________________
______。
(7)如果图⑥中的滤液仍然浑浊,就应该____________。
溶解
搅拌,防止液体因局部温度过高引起液滴飞溅
再过滤一次
蒸发
同课章节目录
