人教版(2019)选择性必修二 1.2 原子结构与元素的性质 课件(共21张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修二 1.2 原子结构与元素的性质 课件(共21张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
第二节 原子结构与元素的性质
(第二课时)
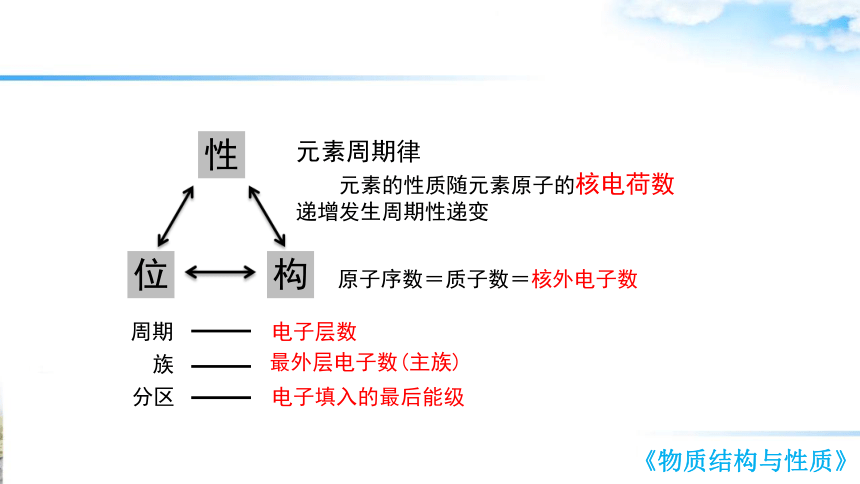
性
位
构
周期
族
分区
电子层数
最外层电子数(主族)
电子填入的最后能级
元素周期律
元素的性质随元素原子的核电荷数
递增发生周期性递变
原子序数=质子数=核外电子数
《物质结构与性质》
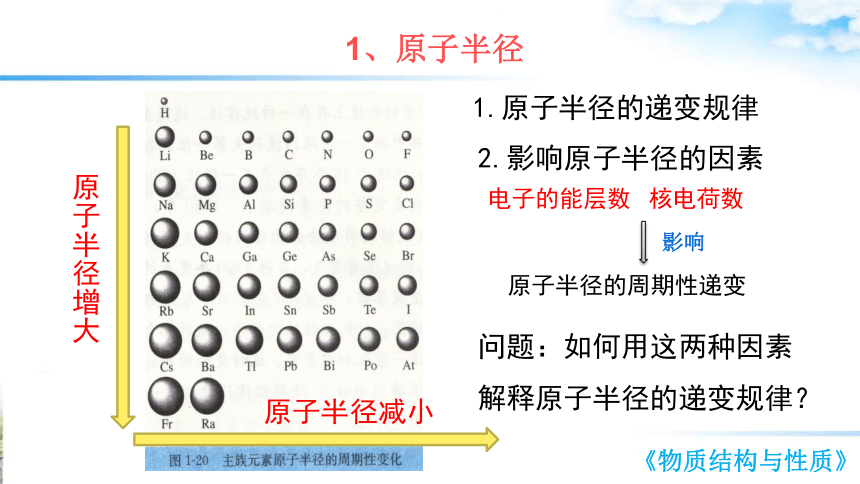
1、原子半径
1.原子半径的递变规律
2.影响原子半径的因素
原子半径增大
原子半径减小
电子的能层数
核电荷数
影响
原子半径的周期性递变
问题:如何用这两种因素
解释原子半径的递变规律?
《物质结构与性质》
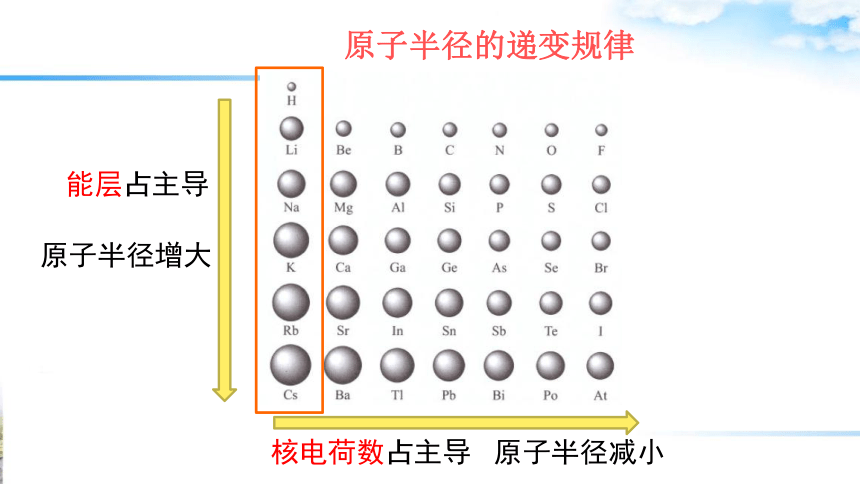
原子半径的递变规律
能层占主导
原子半径增大
核电荷数占主导
原子半径减小
回忆碱金属元素的化学性质
相似性:
4Li + O2 2Li2O
△
4Na + O2 2Na2O
2K + 2H2O 2KOH + H2↑
2Na + 2H2O 2NaOH + H2↑
递变性:
加热Na
加热K
Na与水反应
K与水反应
问题:从原子的核外电子排布解释碱金属元素的化学性质的
相似性与递变性。
《物质结构与性质》
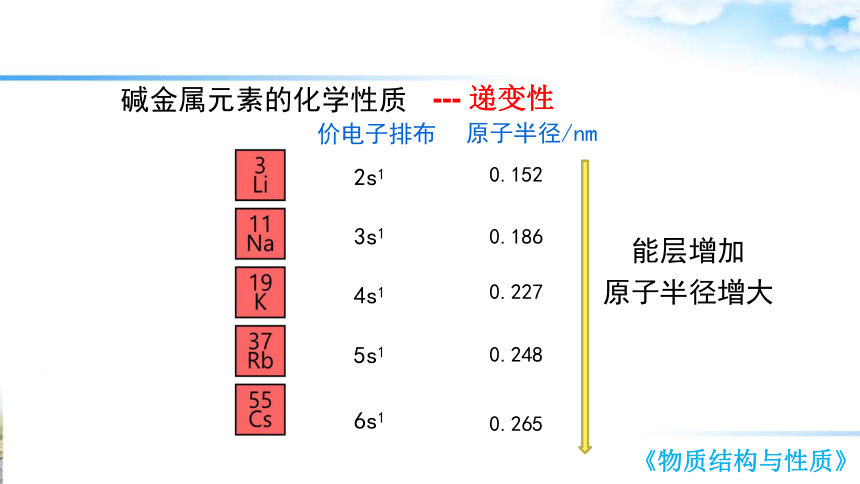
碱金属元素的化学性质
2s1
3s1
4s1
5s1
6s1
价电子排布
Li - 1e- = Li+
Na - 1e- = Na+
K - 1e- = K+
Cs - 1e- = Cs+
Rb - 1e- = Rb+
--- 相似性
《物质结构与性质》
碱金属元素的化学性质
2s1
3s1
4s1
5s1
6s1
价电子排布
--- 递变性
原子半径/nm
0.152
0.186
0.227
0.248
0.265
能层增加
原子半径增大
《物质结构与性质》
元素的性质
(宏观)
反映
决定
原子结构
(微观)
相似性
递变性
ns1
原子半径
强金属性
碱金属元素的化学性质
思考:如何寻求定量衡量原子得失电子能力的方法?
2、电离能
气态电中性基态原子失去一个电子转化为气态基态
正离子所需要的最低能量叫做第一电离能。
M(g)= M+(g) + e-
M+(g)= M2+(g) + e-
第一电离能
第二电离能
……
……
电离能越小
气态原子(离子)越易失电子
原子序数
第一电离能(kJ·mol-1)
问题: 随原子序数递增,同族元素的第一电离能有什么变化规律?
分析碱金属的第一电离能与它们的活泼性有何联系?
电离能的递变规律
原子序数
第一电离能(kJ·mol-1)
同主族元素从上到下,第一电离能逐渐变小。
电离能的递变规律
原子序数
第一电离能(kJ·mol-1)
同周期元素从左到右第一电离能表现为由低到高的趋势。
电离能的递变规律
原子序数
第一电离能(kJ·mol-1)
电离能的递变规律
Be、Mg、N、P比同周期相邻元素的第一电离能都要高
2s2
3s2
2s22p3
3s23p3
S轨道全充满,较稳定。
P轨道半充满,较稳定。
电离能的递变规律小结
原子半径/电离能呈现周期性的递变
电离能
能层数
原子半径
核电荷数
影响第一电离能的因素
元素的性质
(宏观)
反映
决定
原子结构
(微观)
第一电离能
的递变性
?
如何用原子结构解释主族元素第一电离能周期性变化的原因?
金属性增强
第一电离能
降低
半径增大
影响第一电离能的因素
《物质结构与性质》
原子半径减小
第一电离能升高(总趋势)
影响第一电离能的因素
元素的第一电离能的周期性递变规律与原子半径和核外电子排布的周期性变化密切相关。
《物质结构与性质》
电离能与化合价的联系
逐级电离能和元素常见化合价的关系
4066
713
6282
Na(g) Na+(g) + e-
1s22s22p63s1
1s22s22p6
Na+(g) Na2+(g) + e-
1s22s22p6
1s22s22p5
难
《物质结构与性质》
电离能与化合价的联系
元素的性质(宏观)
反映
决定
原子结构(微观)
化合价
核外电子排布
实验数据
逐级电离能的差值
《物质结构与性质》
原子半径/电离能呈现周期性的递变
电离能
能层数
原子
半径
核电荷数
总 结
电离能
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能
应用
化合价判断
……
《物质结构与性质》
本课学习已结束, 请完成相应作业!
《物质结构与性质》
第二节 原子结构与元素的性质
(第二课时)
性
位
构
周期
族
分区
电子层数
最外层电子数(主族)
电子填入的最后能级
元素周期律
元素的性质随元素原子的核电荷数
递增发生周期性递变
原子序数=质子数=核外电子数
《物质结构与性质》
1、原子半径
1.原子半径的递变规律
2.影响原子半径的因素
原子半径增大
原子半径减小
电子的能层数
核电荷数
影响
原子半径的周期性递变
问题:如何用这两种因素
解释原子半径的递变规律?
《物质结构与性质》
原子半径的递变规律
能层占主导
原子半径增大
核电荷数占主导
原子半径减小
回忆碱金属元素的化学性质
相似性:
4Li + O2 2Li2O
△
4Na + O2 2Na2O
2K + 2H2O 2KOH + H2↑
2Na + 2H2O 2NaOH + H2↑
递变性:
加热Na
加热K
Na与水反应
K与水反应
问题:从原子的核外电子排布解释碱金属元素的化学性质的
相似性与递变性。
《物质结构与性质》
碱金属元素的化学性质
2s1
3s1
4s1
5s1
6s1
价电子排布
Li - 1e- = Li+
Na - 1e- = Na+
K - 1e- = K+
Cs - 1e- = Cs+
Rb - 1e- = Rb+
--- 相似性
《物质结构与性质》
碱金属元素的化学性质
2s1
3s1
4s1
5s1
6s1
价电子排布
--- 递变性
原子半径/nm
0.152
0.186
0.227
0.248
0.265
能层增加
原子半径增大
《物质结构与性质》
元素的性质
(宏观)
反映
决定
原子结构
(微观)
相似性
递变性
ns1
原子半径
强金属性
碱金属元素的化学性质
思考:如何寻求定量衡量原子得失电子能力的方法?
2、电离能
气态电中性基态原子失去一个电子转化为气态基态
正离子所需要的最低能量叫做第一电离能。
M(g)= M+(g) + e-
M+(g)= M2+(g) + e-
第一电离能
第二电离能
……
……
电离能越小
气态原子(离子)越易失电子
原子序数
第一电离能(kJ·mol-1)
问题: 随原子序数递增,同族元素的第一电离能有什么变化规律?
分析碱金属的第一电离能与它们的活泼性有何联系?
电离能的递变规律
原子序数
第一电离能(kJ·mol-1)
同主族元素从上到下,第一电离能逐渐变小。
电离能的递变规律
原子序数
第一电离能(kJ·mol-1)
同周期元素从左到右第一电离能表现为由低到高的趋势。
电离能的递变规律
原子序数
第一电离能(kJ·mol-1)
电离能的递变规律
Be、Mg、N、P比同周期相邻元素的第一电离能都要高
2s2
3s2
2s22p3
3s23p3
S轨道全充满,较稳定。
P轨道半充满,较稳定。
电离能的递变规律小结
原子半径/电离能呈现周期性的递变
电离能
能层数
原子半径
核电荷数
影响第一电离能的因素
元素的性质
(宏观)
反映
决定
原子结构
(微观)
第一电离能
的递变性
?
如何用原子结构解释主族元素第一电离能周期性变化的原因?
金属性增强
第一电离能
降低
半径增大
影响第一电离能的因素
《物质结构与性质》
原子半径减小
第一电离能升高(总趋势)
影响第一电离能的因素
元素的第一电离能的周期性递变规律与原子半径和核外电子排布的周期性变化密切相关。
《物质结构与性质》
电离能与化合价的联系
逐级电离能和元素常见化合价的关系
4066
713
6282
Na(g) Na+(g) + e-
1s22s22p63s1
1s22s22p6
Na+(g) Na2+(g) + e-
1s22s22p6
1s22s22p5
难
《物质结构与性质》
电离能与化合价的联系
元素的性质(宏观)
反映
决定
原子结构(微观)
化合价
核外电子排布
实验数据
逐级电离能的差值
《物质结构与性质》
原子半径/电离能呈现周期性的递变
电离能
能层数
原子
半径
核电荷数
总 结
电离能
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能
应用
化合价判断
……
《物质结构与性质》
本课学习已结束, 请完成相应作业!
《物质结构与性质》
