人教版(2019)选择性必修一 2.2 化学平衡状态 课件(共21张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 2.2 化学平衡状态 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 09:58:43 | ||
图片预览








文档简介
(共21张PPT)
工业生产中,只考虑化学反应速率是不够的。
2NH3
N2 + 3H2
催化剂
高温、高压
1.可逆反应
反应物的转化率多
化学反应速率快
生产效率
合成氨反应是一个可逆反应,反应有限度,即反应不能进行彻底。
第二章 化学反应速率与化学平衡
第二节 化学平衡
第1课时:化学平衡状态
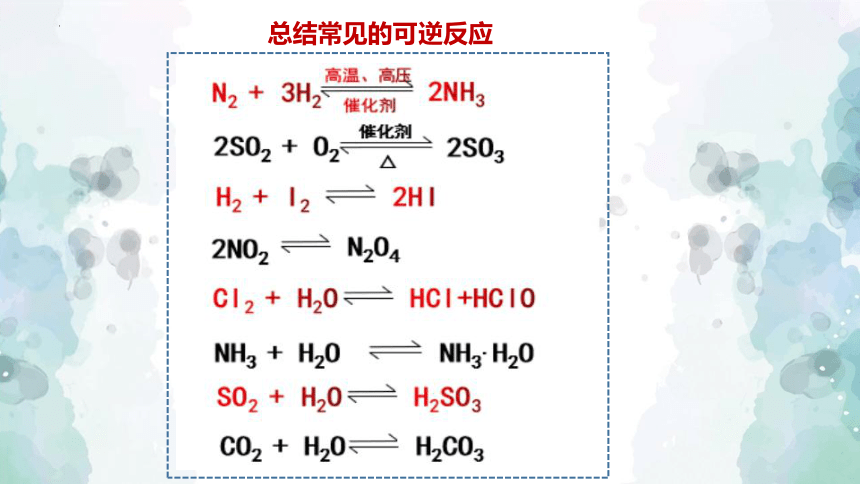
总结常见的可逆反应
t1
V逆
V正
=
V正
V逆
时间
速率
N2+3H2 2NH3
高温高压
催化剂
2NH3 N2+3H2
高温高压
催化剂
以浓度为纵坐标,反应时间为横坐标,画出有关物质的浓度随时间变化示意图。
以速率为纵坐标,反应时间为横坐标,画出反应速率随时间变化示意图。
化学平衡的本质
v(正)=v(逆)
化学平衡的标志
反应混合物中各组分的浓度保持不变。
2.化学平衡状态的建立
同一物质:v正 = v逆 ;
不同物质:正逆反应速率
与系数成正比。
变量不变( )
定量不变( )
√
×
反应速率
反应速率
压强
7
总压强P,看反应前气体总系数是否等于反应后气体总系数
混合气体密度
8
ρ=
m气总
v容
混合气体平均相对分子质量
8
M=
m气总
n气总
8
体积分数/比例
其他
温度?
浓度比?
浓度相等?
9
固体质量/浓度?
动态标志
静态标志
ν (正) = ν (逆)
≠0
变量不变
同一物质: ν生成(A) = ν消耗(A)
不同物质: v正(A) : v逆(B) = 化学计量数之比
① 各物质的 m 、n 或 c 不变
② 各物质的百分含量不变
(物质的量分数、质量分数、转化率、产率等)
③ 颜色、温度(绝热体系)不再改变
“正逆相等,变量不变”
化学平衡状态判定的小结
三段式法?
7
在水溶液中进行的反应FeCl3+3KSCN Fe(SCN)3+3KCl进行一段时间后,加入少量FeCl3固体,对反应速率有何影响 加入少量KCl固体呢 加入少量KCl溶液呢?
11
升高温度更有利于加快活化能比较大的反应
定量研究化学反应速率的应用价值
(二)选择可观测、易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
(一)实验原理
找与化学反应物质的浓度相关的物理量
找与该物理量化学变化对应的时间
浊度仪
高锰酸钾溶液与草酸反应,
记录溶液褪色的时间
离子浓度检测仪
环节三、化学反应速率的定量测定——实验
【实验操作】
(1)按下图所示安装装置,检查装置气密性。在锥形瓶内放入2g锌粒,通过分液漏斗加入40 mL 1 mol/L的稀硫酸,测量收集10 mL H2所用的时间。
(2)用4 mol/L的稀硫酸代替1 mol/L的稀硫酸重复上述实验。
环节三、 定量研究影响化学反应速率的因素
加入试剂 收集10mLH2
的时间/s
1mol/LH2SO4
4mol/LH2SO4
97
171
【实验数据】
关闭分液漏斗的活塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
(1)锌粒颗粒大小(表面积)基本相同(控制变量,避免表面积的干扰)。
(2)40 mL的稀硫酸溶液要迅速加入。
(3)装置气密性要好,且计时要迅速、准确。
实验通过测量收集10 mL H2所用的时间,来表征反应速率的快慢,除了这个方式,还可以测量哪些物理量来表征速率快慢?
①测量一定时间内H+的浓度变化;
②测量一定时间内产生的H2的体积;
③测量一定时间内锌粒的质量变化。
二、 定量研究影响化学反应速率的因素
【注意事项】
3、为探究催化剂对过氧化氢分解反应速率的影响,某兴趣小组设计如图装置。实验时,通过胶头滴管向容器中各滴入5滴溶液后,每隔10s观测注射器中气体体积
并进行比较。请回答:
(1)如何检验该装置气密性?
_______________________________。
(2)若甲装置在相同时间内收集到气体体积大于乙装置,能否推测Fe3+对H2O2分解的催化效果比Cu2+的好?_______(填“能”或“不能”),请说明理由______________________________________________________。
塞紧橡胶塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
因为所用盐溶液的酸根离子不同,对实验可能产生干扰
不能
随
堂
练
习
【问题与讨论】
1、有同学经认真分析发现本实验设计存在一处明显的不足之处,你能找到吗?
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大。
2、如何改进问题1中的不足之处?
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气
体体积,从而消除由于加入液体引起的氢气体积
误差。
用导管将分液漏斗上部与锥形瓶连通
锌粒
硫酸
工业生产中,只考虑化学反应速率是不够的。
2NH3
N2 + 3H2
催化剂
高温、高压
1.可逆反应
反应物的转化率多
化学反应速率快
生产效率
合成氨反应是一个可逆反应,反应有限度,即反应不能进行彻底。
第二章 化学反应速率与化学平衡
第二节 化学平衡
第1课时:化学平衡状态
总结常见的可逆反应
t1
V逆
V正
=
V正
V逆
时间
速率
N2+3H2 2NH3
高温高压
催化剂
2NH3 N2+3H2
高温高压
催化剂
以浓度为纵坐标,反应时间为横坐标,画出有关物质的浓度随时间变化示意图。
以速率为纵坐标,反应时间为横坐标,画出反应速率随时间变化示意图。
化学平衡的本质
v(正)=v(逆)
化学平衡的标志
反应混合物中各组分的浓度保持不变。
2.化学平衡状态的建立
同一物质:v正 = v逆 ;
不同物质:正逆反应速率
与系数成正比。
变量不变( )
定量不变( )
√
×
反应速率
反应速率
压强
7
总压强P,看反应前气体总系数是否等于反应后气体总系数
混合气体密度
8
ρ=
m气总
v容
混合气体平均相对分子质量
8
M=
m气总
n气总
8
体积分数/比例
其他
温度?
浓度比?
浓度相等?
9
固体质量/浓度?
动态标志
静态标志
ν (正) = ν (逆)
≠0
变量不变
同一物质: ν生成(A) = ν消耗(A)
不同物质: v正(A) : v逆(B) = 化学计量数之比
① 各物质的 m 、n 或 c 不变
② 各物质的百分含量不变
(物质的量分数、质量分数、转化率、产率等)
③ 颜色、温度(绝热体系)不再改变
“正逆相等,变量不变”
化学平衡状态判定的小结
三段式法?
7
在水溶液中进行的反应FeCl3+3KSCN Fe(SCN)3+3KCl进行一段时间后,加入少量FeCl3固体,对反应速率有何影响 加入少量KCl固体呢 加入少量KCl溶液呢?
11
升高温度更有利于加快活化能比较大的反应
定量研究化学反应速率的应用价值
(二)选择可观测、易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
(一)实验原理
找与化学反应物质的浓度相关的物理量
找与该物理量化学变化对应的时间
浊度仪
高锰酸钾溶液与草酸反应,
记录溶液褪色的时间
离子浓度检测仪
环节三、化学反应速率的定量测定——实验
【实验操作】
(1)按下图所示安装装置,检查装置气密性。在锥形瓶内放入2g锌粒,通过分液漏斗加入40 mL 1 mol/L的稀硫酸,测量收集10 mL H2所用的时间。
(2)用4 mol/L的稀硫酸代替1 mol/L的稀硫酸重复上述实验。
环节三、 定量研究影响化学反应速率的因素
加入试剂 收集10mLH2
的时间/s
1mol/LH2SO4
4mol/LH2SO4
97
171
【实验数据】
关闭分液漏斗的活塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
(1)锌粒颗粒大小(表面积)基本相同(控制变量,避免表面积的干扰)。
(2)40 mL的稀硫酸溶液要迅速加入。
(3)装置气密性要好,且计时要迅速、准确。
实验通过测量收集10 mL H2所用的时间,来表征反应速率的快慢,除了这个方式,还可以测量哪些物理量来表征速率快慢?
①测量一定时间内H+的浓度变化;
②测量一定时间内产生的H2的体积;
③测量一定时间内锌粒的质量变化。
二、 定量研究影响化学反应速率的因素
【注意事项】
3、为探究催化剂对过氧化氢分解反应速率的影响,某兴趣小组设计如图装置。实验时,通过胶头滴管向容器中各滴入5滴溶液后,每隔10s观测注射器中气体体积
并进行比较。请回答:
(1)如何检验该装置气密性?
_______________________________。
(2)若甲装置在相同时间内收集到气体体积大于乙装置,能否推测Fe3+对H2O2分解的催化效果比Cu2+的好?_______(填“能”或“不能”),请说明理由______________________________________________________。
塞紧橡胶塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
因为所用盐溶液的酸根离子不同,对实验可能产生干扰
不能
随
堂
练
习
【问题与讨论】
1、有同学经认真分析发现本实验设计存在一处明显的不足之处,你能找到吗?
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大。
2、如何改进问题1中的不足之处?
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气
体体积,从而消除由于加入液体引起的氢气体积
误差。
用导管将分液漏斗上部与锥形瓶连通
锌粒
硫酸
