人教版(2019)选择性必修一 化学反应速率与化学平衡 课件(共26张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 化学反应速率与化学平衡 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 10:01:11 | ||
图片预览






文档简介
(共26张PPT)
化学反应速率与化学平衡
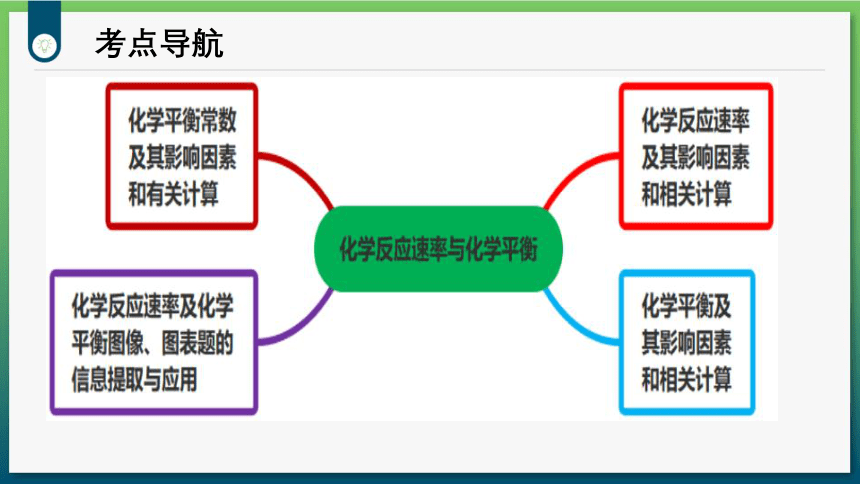
考点导航
考点1:化学反应速率及其影响因素
解读:
●瞬时速率---
●平均速率---
●正、逆反应速率---
●净反应速率---
平衡时同一种物质的正、逆反应速率(瞬时速率)相等且不等于0;
净反应速率等于0。
任何化学反应的快慢都表现为有关物质的量随着时间变化的多少。因此,化学反应速率可以用单位时间、单位体积中反应物或生成物的物质的量变化来表示。如果反应体系的体积时恒定的,则化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示:
------------------------------
严格地说,这里是指化学反应的平均速率。 ---人教版化学反应原理p22
化学反应速率的影响因素
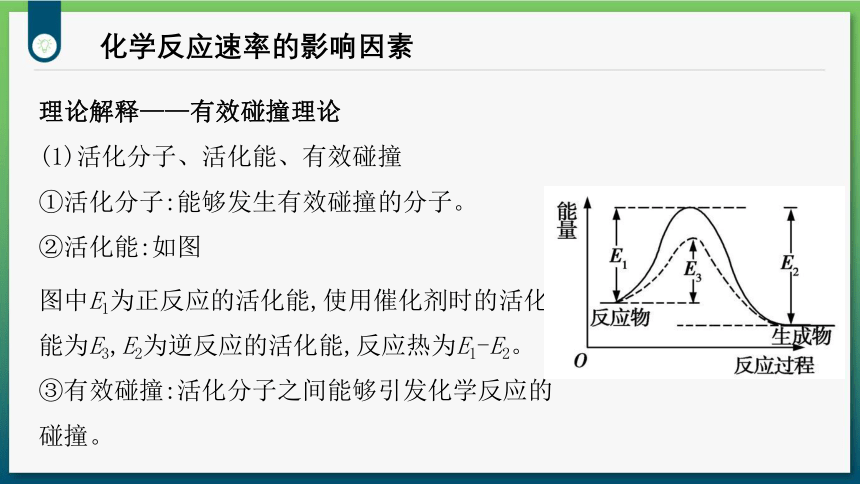
理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子。
②活化能:如图
图中E1为正反应的活化能,使用催化剂时的活化能为E3,E2为逆反应的活化能,反应热为E1-E2。
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
化学反应速率的影响因素
理论解释——有效碰撞理论
(2)活化分子、有效碰撞与反应速率的关系
真题体验
1.(2022.6浙江20)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时的变化,如下表所示,下列说法不正确的是( )
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
考查化学反应速率及其影响因素和相关计算
C
【2022.1浙江19】在恒温恒容条件下,发生反应A(s)+2B(g) 3X(g),c(B)随
时间的变化如图中曲线甲所示。下列说法不正确的是
A.从a、c两点坐标可求得从a到c时间间隔内该
化学反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应
开始时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,
c(B)随时间变化关系如图中曲线乙所示
C
真题体验
模拟训练
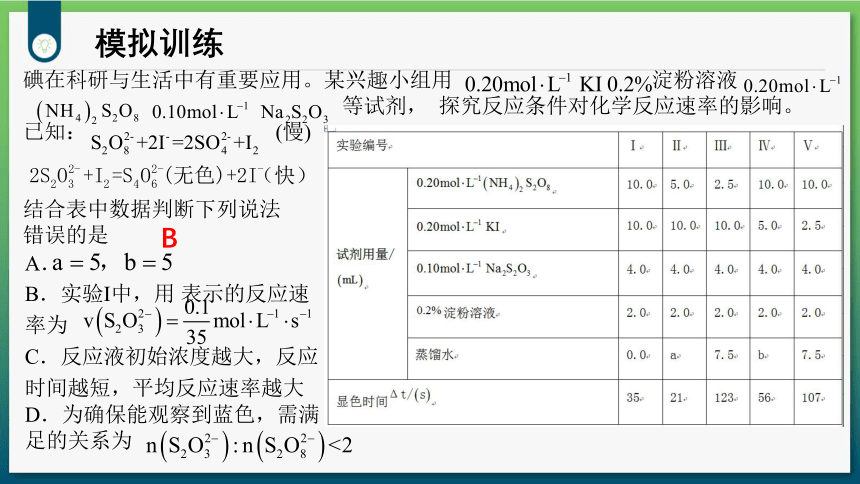
碘在科研与生活中有重要应用。某兴趣小组用 淀粉溶液
等试剂, 探究反应条件对化学反应速率的影响。
已知: (慢)
结合表中数据判断下列说法
错误的是
A.
B.实验Ⅰ中,用 表示的反应速率为
C.反应液初始浓度越大,反应时间越短,平均反应速率越大
D.为确保能观察到蓝色,需满足的关系为
B
考点2:化学平衡及其影响因素
(2022辽宁高考)某温度下,在 恒容密闭容器中发生反应2X (s) Y(g)+2Z(g) ,有关数据如下:
B
化学平衡状态的判断
1、等——“逆向相等”(两种表述)。
(1)同一物质(两种表述):v正=v逆、断键数=成键数。
(2)不同物质: (a:X的化学计量数;b:Y的化学计量数)
2、定——“变量不变”:如果一个量是随反应进行而改变的(即变量),当其“不变”时反应就达到平衡状态,即“变量”不变→平衡状态。
(1)平衡体系中各物质的质量、物质的量、浓度和物质的量分数等保持不变。
(2)一定条件下的气体密度、总压强、气体的平均相对分子质量不变等。
(3)有色体系的颜色保持不变。
3、依Qc与K关系判断:若Qc=K,反应处于平衡状态。
化学平衡移动
【小结】分析化学平衡移动试题的一般思路
模拟训练
1.温度为T1 时,在三个容积均为1L 的恒容密闭容器中仅发生反应2NO2(g) 2NO(g)+O2(g): 正反应吸热 。实验测得:
为速率常数,受温度影响。下列说法正确的是
A.①② B.①③
C.②③ D.③④
D
模拟训练
2.水溶液中存在电离平衡:H2S H++HS-,HS- H++S2-。下列说法正确的是
A.若向 溶液中加水,平衡向右移动,溶液中氢离子浓度增大
B.若向 溶液中滴加少量新制氯水,平衡向左移动,溶液pH减小
C.若向 溶液中通入过量 气体,平衡向左移动,溶液pH增大
D.若向 溶液中加入少量硫酸铜固体(忽略溶液体积变化),溶液中所有离子浓度都减小
B
模拟训练
3.甲酸(HCOOH)具有液氢储存材料和清洁制氢的巨大潜力,产生氢气的反应为:HCOOH (g) CO2(g)+H2(g) ,在T℃时,向体积不等的恒容密闭容器中分别加入一定量的 HCOOH (g) ,反应相同时间,测得各容器中甲酸的转化率与容器体积的关系如图所示,其中m、n点反应达平衡。下列说法正确的是
A.m、p两点中,甲酸的浓度:
B.
C.n点时再充入一定量 HCOOH (g) ,达平衡时甲酸的转化率升高
D.p点时 H2的体积分数约为
A
考点3:化学平衡常数及有关计算
(2022湖南高考,不定项)向体积均为1L的两恒容容器中分别充入2molX 和1molY 发生反应2X (g)+Y(g) Z(g) △H,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A.
B.气体的总物质的量:
C.a点平衡常数:
D.反应速率:
BC
化学平衡常数及有关计算
化学平衡常数
1、意义:化学平衡常数K表示反应进行的程度,K越大,反应进行的程度越大。
K>105时,可以认为该反应已经进行完全。K的大小只与温度有关。
2、化学平衡常数表达式:对于可逆化学反应mA(g)+nB(g) pC(g)+qD(g)在一定温度下达到化学平衡时,K= 。
另可用压强平衡常数表示:Kp= [p(C)为平衡时气体C的分压,分压=总压×物质的量分数]。
3、依据化学方程式计算平衡常数(盖斯定律的拓展应用)
①同一可逆反应中,K正·K逆=1。
②同一方程式中的化学计量数等倍扩大或缩小n倍,则新平衡常数K′与原平衡常数K间的关系是K′=Kn或K′= 。
③几个可逆反应方程式相加,得总方程式,则总反应的平衡常数等于各分步反应平衡常数之积。反之,若反应方程式相减得总方程式,则总反应的平衡常数等于各分步反应平衡常数之比。
化学平衡常数及有关计算
模拟训练
1.T℃时,向容积为 2L的刚性容器中充入1molCO2 和一定量的 H2发生反应:CO2(g)+2H2(g) HCHO(g)+H2O(g),达到平衡时,HCHO 的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入 2molH2时,容器内气体的总压强为 。下列说法正确的是
A.5min 时反应到达c点,
B.随 增大,HCHO 的百分含量不断增大
C.b点时反应的平衡常数
D.c点时,再加入CO2(g) 和 H2O(g) ,使二者分压均增大 ,平衡正向移动
C
模拟训练
2.某温度下,将2mol H2 和2mol I2 充入密闭的刚性容器中发生反应 H2 (g) +I2 (g) 2HI(g),该反应的v-t图象如图所示,t1 时刻测定容器内HI的物质的量为1mol, t2时刻保持等温等容,抽走0.5mol HI。下列有关叙述正确的是
A.该温度下2HI(g) H2 (g) +I2 (g)的平衡常数
B.反应过程中,可以利用气体的总压强保持不变来判断是否达到平衡
C. t2 时刻,抽取HI的瞬间,v′(逆)在图象上的变化应该是c点
D. t2时刻,抽取HI后达到平衡后 H2的百分含量减少
C
考点4:图像、图表题的信息提取与应用
(2022河北高考,不定项)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为① ;② 。反应①的速率 ,反应②的速率 ,式中 为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的 曲线。下列说法错误的是
A.随c(X) 的减小,反应①、②的速率均降低
B.体系中
C.欲提高Y的产率,需提高反应温度且控制反应时间
D.温度低于T1 时,总反应速率由反应②决定
AB
陌生图像的关键点分析
(1)
(2)
(4)
(3)对于反应A(g)+2B(g) C(g)
陌生图像的关键点分析
模拟训练
1.利用合成气(CO和 H2)在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)+Q(g) (Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是
A.升高温度,平衡常数减小
B.
C.在不同温度、压强下进行该反应,α(CO)不可能相等
D.若 ,则合成气中
C
模拟训练
2.半衰期为反应物消耗一半所需的时间,某温度下,降冰片烯在钛杂环丁烷催化剂作用下发生聚合反应生成聚降冰片烯,反应物浓度与催化剂浓度及时间关系如图所示,下列说法正确的是
A.其他条件相同时,降冰片烯浓度越大,反应速率越大
B.条件②,0~125min,降冰片烯反应的平均速率为
C.其他条件相同时,若将钛杂环丁烷催化剂制成蜂窝形状可提高该反应的平衡转化率
D.其他条件相同时,将条件①中降冰片烯起始浓度增加为 ,则半衰期为250min
D
模拟训练
3.减少碳排放、控制温室气体排放的增长已经成为可能。一种由二氧化碳和氢气合成乙醇的反应为 2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 。选择合适的催化剂,相同时间内可以得出温度对合成乙醇的影响情况如图所示(乙醇选择性 )。下列说法正确的是
A.该反应的
B.增大压强和升高温度都能提高 CO2的平衡转化率
C.温度为 T0时,乙醇的产率为57.4%
D. 温度下,随温度升高,乙醇的产率降低
C
谢谢!
化学反应速率与化学平衡
考点导航
考点1:化学反应速率及其影响因素
解读:
●瞬时速率---
●平均速率---
●正、逆反应速率---
●净反应速率---
平衡时同一种物质的正、逆反应速率(瞬时速率)相等且不等于0;
净反应速率等于0。
任何化学反应的快慢都表现为有关物质的量随着时间变化的多少。因此,化学反应速率可以用单位时间、单位体积中反应物或生成物的物质的量变化来表示。如果反应体系的体积时恒定的,则化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示:
------------------------------
严格地说,这里是指化学反应的平均速率。 ---人教版化学反应原理p22
化学反应速率的影响因素
理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子。
②活化能:如图
图中E1为正反应的活化能,使用催化剂时的活化能为E3,E2为逆反应的活化能,反应热为E1-E2。
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
化学反应速率的影响因素
理论解释——有效碰撞理论
(2)活化分子、有效碰撞与反应速率的关系
真题体验
1.(2022.6浙江20)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时的变化,如下表所示,下列说法不正确的是( )
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
考查化学反应速率及其影响因素和相关计算
C
【2022.1浙江19】在恒温恒容条件下,发生反应A(s)+2B(g) 3X(g),c(B)随
时间的变化如图中曲线甲所示。下列说法不正确的是
A.从a、c两点坐标可求得从a到c时间间隔内该
化学反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应
开始时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,
c(B)随时间变化关系如图中曲线乙所示
C
真题体验
模拟训练
碘在科研与生活中有重要应用。某兴趣小组用 淀粉溶液
等试剂, 探究反应条件对化学反应速率的影响。
已知: (慢)
结合表中数据判断下列说法
错误的是
A.
B.实验Ⅰ中,用 表示的反应速率为
C.反应液初始浓度越大,反应时间越短,平均反应速率越大
D.为确保能观察到蓝色,需满足的关系为
B
考点2:化学平衡及其影响因素
(2022辽宁高考)某温度下,在 恒容密闭容器中发生反应2X (s) Y(g)+2Z(g) ,有关数据如下:
B
化学平衡状态的判断
1、等——“逆向相等”(两种表述)。
(1)同一物质(两种表述):v正=v逆、断键数=成键数。
(2)不同物质: (a:X的化学计量数;b:Y的化学计量数)
2、定——“变量不变”:如果一个量是随反应进行而改变的(即变量),当其“不变”时反应就达到平衡状态,即“变量”不变→平衡状态。
(1)平衡体系中各物质的质量、物质的量、浓度和物质的量分数等保持不变。
(2)一定条件下的气体密度、总压强、气体的平均相对分子质量不变等。
(3)有色体系的颜色保持不变。
3、依Qc与K关系判断:若Qc=K,反应处于平衡状态。
化学平衡移动
【小结】分析化学平衡移动试题的一般思路
模拟训练
1.温度为T1 时,在三个容积均为1L 的恒容密闭容器中仅发生反应2NO2(g) 2NO(g)+O2(g): 正反应吸热 。实验测得:
为速率常数,受温度影响。下列说法正确的是
A.①② B.①③
C.②③ D.③④
D
模拟训练
2.水溶液中存在电离平衡:H2S H++HS-,HS- H++S2-。下列说法正确的是
A.若向 溶液中加水,平衡向右移动,溶液中氢离子浓度增大
B.若向 溶液中滴加少量新制氯水,平衡向左移动,溶液pH减小
C.若向 溶液中通入过量 气体,平衡向左移动,溶液pH增大
D.若向 溶液中加入少量硫酸铜固体(忽略溶液体积变化),溶液中所有离子浓度都减小
B
模拟训练
3.甲酸(HCOOH)具有液氢储存材料和清洁制氢的巨大潜力,产生氢气的反应为:HCOOH (g) CO2(g)+H2(g) ,在T℃时,向体积不等的恒容密闭容器中分别加入一定量的 HCOOH (g) ,反应相同时间,测得各容器中甲酸的转化率与容器体积的关系如图所示,其中m、n点反应达平衡。下列说法正确的是
A.m、p两点中,甲酸的浓度:
B.
C.n点时再充入一定量 HCOOH (g) ,达平衡时甲酸的转化率升高
D.p点时 H2的体积分数约为
A
考点3:化学平衡常数及有关计算
(2022湖南高考,不定项)向体积均为1L的两恒容容器中分别充入2molX 和1molY 发生反应2X (g)+Y(g) Z(g) △H,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A.
B.气体的总物质的量:
C.a点平衡常数:
D.反应速率:
BC
化学平衡常数及有关计算
化学平衡常数
1、意义:化学平衡常数K表示反应进行的程度,K越大,反应进行的程度越大。
K>105时,可以认为该反应已经进行完全。K的大小只与温度有关。
2、化学平衡常数表达式:对于可逆化学反应mA(g)+nB(g) pC(g)+qD(g)在一定温度下达到化学平衡时,K= 。
另可用压强平衡常数表示:Kp= [p(C)为平衡时气体C的分压,分压=总压×物质的量分数]。
3、依据化学方程式计算平衡常数(盖斯定律的拓展应用)
①同一可逆反应中,K正·K逆=1。
②同一方程式中的化学计量数等倍扩大或缩小n倍,则新平衡常数K′与原平衡常数K间的关系是K′=Kn或K′= 。
③几个可逆反应方程式相加,得总方程式,则总反应的平衡常数等于各分步反应平衡常数之积。反之,若反应方程式相减得总方程式,则总反应的平衡常数等于各分步反应平衡常数之比。
化学平衡常数及有关计算
模拟训练
1.T℃时,向容积为 2L的刚性容器中充入1molCO2 和一定量的 H2发生反应:CO2(g)+2H2(g) HCHO(g)+H2O(g),达到平衡时,HCHO 的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入 2molH2时,容器内气体的总压强为 。下列说法正确的是
A.5min 时反应到达c点,
B.随 增大,HCHO 的百分含量不断增大
C.b点时反应的平衡常数
D.c点时,再加入CO2(g) 和 H2O(g) ,使二者分压均增大 ,平衡正向移动
C
模拟训练
2.某温度下,将2mol H2 和2mol I2 充入密闭的刚性容器中发生反应 H2 (g) +I2 (g) 2HI(g),该反应的v-t图象如图所示,t1 时刻测定容器内HI的物质的量为1mol, t2时刻保持等温等容,抽走0.5mol HI。下列有关叙述正确的是
A.该温度下2HI(g) H2 (g) +I2 (g)的平衡常数
B.反应过程中,可以利用气体的总压强保持不变来判断是否达到平衡
C. t2 时刻,抽取HI的瞬间,v′(逆)在图象上的变化应该是c点
D. t2时刻,抽取HI后达到平衡后 H2的百分含量减少
C
考点4:图像、图表题的信息提取与应用
(2022河北高考,不定项)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为① ;② 。反应①的速率 ,反应②的速率 ,式中 为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的 曲线。下列说法错误的是
A.随c(X) 的减小,反应①、②的速率均降低
B.体系中
C.欲提高Y的产率,需提高反应温度且控制反应时间
D.温度低于T1 时,总反应速率由反应②决定
AB
陌生图像的关键点分析
(1)
(2)
(4)
(3)对于反应A(g)+2B(g) C(g)
陌生图像的关键点分析
模拟训练
1.利用合成气(CO和 H2)在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)+Q(g) (Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是
A.升高温度,平衡常数减小
B.
C.在不同温度、压强下进行该反应,α(CO)不可能相等
D.若 ,则合成气中
C
模拟训练
2.半衰期为反应物消耗一半所需的时间,某温度下,降冰片烯在钛杂环丁烷催化剂作用下发生聚合反应生成聚降冰片烯,反应物浓度与催化剂浓度及时间关系如图所示,下列说法正确的是
A.其他条件相同时,降冰片烯浓度越大,反应速率越大
B.条件②,0~125min,降冰片烯反应的平均速率为
C.其他条件相同时,若将钛杂环丁烷催化剂制成蜂窝形状可提高该反应的平衡转化率
D.其他条件相同时,将条件①中降冰片烯起始浓度增加为 ,则半衰期为250min
D
模拟训练
3.减少碳排放、控制温室气体排放的增长已经成为可能。一种由二氧化碳和氢气合成乙醇的反应为 2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 。选择合适的催化剂,相同时间内可以得出温度对合成乙醇的影响情况如图所示(乙醇选择性 )。下列说法正确的是
A.该反应的
B.增大压强和升高温度都能提高 CO2的平衡转化率
C.温度为 T0时,乙醇的产率为57.4%
D. 温度下,随温度升高,乙醇的产率降低
C
谢谢!
