人教版(2019)选择性必修一 影响化学反应速率的因素 课件(共25张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 影响化学反应速率的因素 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 10:26:20 | ||
图片预览








文档简介
(共25张PPT)
第二章 化学反应速率与化学平衡
化学反应速率
化学平衡
化学反应的方向
化学反应的调控
研究一个化学反应进,往往需要关注以下两方面的问题:一是反应的快慢和历程,涉及反应速率和反应机理;二是反应的趋势和限度,涉及反应方向和化学平衡。这两个方面既有区别,又有联系。这些问题的研究,对于揭示化学反应的规律,获得调控化学反应的理论依据,以及日常生活和工农业生产都具有重要的意义。
用来衡量化学反应过程进行的快慢的物理量。
如果反应的体积是恒定的,化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
环节一、回顾化学反应速率
4、常用单位:
mol·L-1·s-1或mol/(L·s),
mol·L-1·min-1或mol/(L·min)等。
3、数学表达式:
v(B) = =
2、表示方法:
1、概念:
N2 + 3H2 2NH3
高温高压
催化剂
课本P25:在密闭容器:开始时N2的浓度为0.8mol/L,5min后 N2的浓度为0.7mol/L 。求这5min内N2的平均速率是多少?
v (N2)
=
Δc (N2)
Δt
=
v (H2)
=
Δc (H2)
Δt
=
0.1mol/L
5min
=
0.02 mol/(L min)
0.3mol/L
5min
=
0.06 mol/(L min)
v (NH3)
=
Δc (NH3)
Δt
=
0.2mol/L
5min
=
0.04 mol/(L min)
5、计算:
【思考】这三个数字表达的意义是否是一样的?
【题型1:化学反应速率的计算】 在2L密闭容器中加入1molN2 和3molH2发生反应 N2 + 3H2 2NH3 ,2s末时测得容器中含有0.4 mol NH3, 求该反应的化学反应速率(分别用三个物质表示)。
催化剂
高温、高压
N2 + 3H2 2NH3
催化剂
高温、高压
C起始 0.5 1.5 0
ΔC
C2s末
0.2
0.2
0.1
0.3
0.4 1.2
等于计量数比
υ(N2)=
Δc(N2)
Δt
=
0.1 mol/L
2 s
= 0.05 mol/(L.s)
υ(NH3)=
Δc(NH3)
Δt
=
0.2 mol/L
2 s
= 0.10 mol/(L.s)
υ(H2)=
Δc(H2)
Δt
=
0.3 mol/L
2 s
= 0.15 mol/(L.s)
变化量之比等于方程式前的计量数比
速率之比等于方程式前的计量数之比
变化量之比=速率之比=计量数之比
同一个反应,对一个化学反应:mA+nB=pC+qD,可用任何一种物质的量浓度随时间的变化来表示该反应的速率。
v(A) =
v(B) =
v(C) =
v(D) =
且有 = = = = 定值
催化剂
N2 + 3H2 2NH3
1mol/L 3mol/L 0
1mol/L
1mol/L
1.5 mol/L
0.5 mol/L
0.5 mol/L
1.5 mol/L
最终量
变化量
起始量
三段式解题法
起始量、变化量、最终量
第一步:写出化学方程式
第二步:写出三段式的量
第三步:依据相关公式计算
规律:变化量之比=速率之比=计量数之比
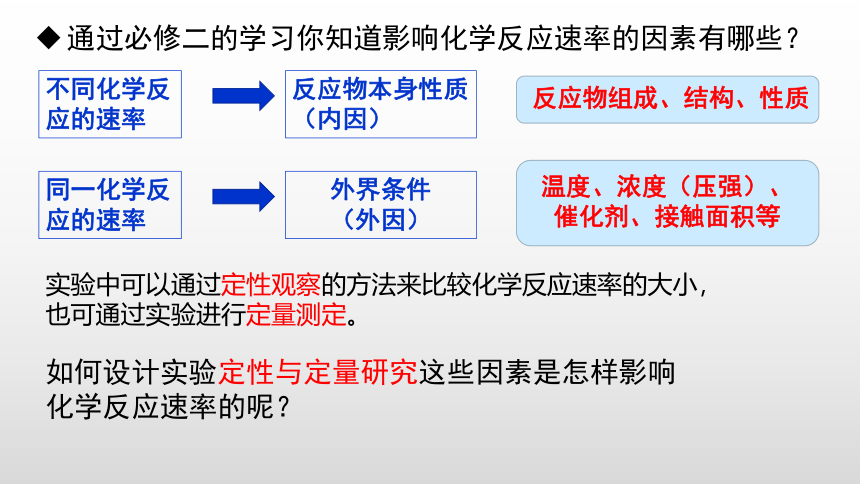
通过必修二的学习你知道影响化学反应速率的因素有哪些?
不同化学反应的速率
反应物本身性质(内因)
同一化学反应的速率
外界条件
(外因)
温度、浓度(压强)、催化剂、接触面积等
反应物组成、结构、性质
如何设计实验定性与定量研究这些因素是怎样影响
化学反应速率的呢?
实验中可以通过定性观察的方法来比较化学反应速率的大小,
也可通过实验进行定量测定。
环节二、 定性研究影响化学反应速率的因素
【提出问题】浓度、温度、催化剂等因素如何影响化学反应速率?如何测定化学反应速率?
【实验探究】
选择实验用品,设计实验探究影响化学反应速率的因素。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
控制变量法
Na2S2O3+H2SO4 = Na2SO4+SO2 +S +H2O
2H2O2 = 2H2O + O2
【实验原理】
选择实验现象明显的化学反应。通过观察冒气泡快慢;颜色变化;固体量减少;浑浊程度;温度变化等。
影响因素 反应原理 方案设计 实验现象 结论
浓度
温度
催化剂
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
Na2S2O3+H2SO4 = Na2SO4+SO2 +S +H2O
2H2O2 = 2H2O + O2
【实验探究】温度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,升高反应体系的温度,化学反应速率加快。
冷水
热水
环节二、定性研究影响化学反应速率的因素
【实验探究】浓度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,增大反应物浓度,化学反应速率加快。
【实验探究】催化剂对化学反应速率的影响
实验 操作 原理 现象
结论 2H2O2 = 2H2O + O2↑
几乎无气泡产生
产生较多气泡
其他条件相同时,催化剂可以改变化学反应速率。
定量研究化学反应速率的应用价值
(二)选择可观测、易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
(一)实验原理
找与化学反应物质的浓度相关的物理量
找与该物理量化学变化对应的时间
浊度仪
高锰酸钾溶液与草酸反应,
记录溶液褪色的时间
离子浓度检测仪
环节三、化学反应速率的定量测定——实验
【实验操作】
(1)按下图所示安装装置,检查装置气密性。在锥形瓶内放入2g锌粒,通过分液漏斗加入40 mL 1 mol/L的稀硫酸,测量收集10 mL H2所用的时间。
(2)用4 mol/L的稀硫酸代替1 mol/L的稀硫酸重复上述实验。
环节三、 定量研究影响化学反应速率的因素
加入试剂 收集10mLH2
的时间/s
1mol/LH2SO4
4mol/LH2SO4
97
171
【实验数据】
关闭分液漏斗的活塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
(1)锌粒颗粒大小(表面积)基本相同(控制变量,避免表面积的干扰)。
(2)40 mL的稀硫酸溶液要迅速加入。
(3)装置气密性要好,且计时要迅速、准确。
实验通过测量收集10 mL H2所用的时间,来表征反应速率的快慢,除了这个方式,还可以测量哪些物理量来表征速率快慢?
①测量一定时间内H+的浓度变化;
②测量一定时间内产生的H2的体积;
③测量一定时间内锌粒的质量变化。
二、 定量研究影响化学反应速率的因素
【注意事项】
【问题与讨论】
1、有同学经认真分析发现本实验设计存在一处明显的不足之处,你能找到吗?
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大。
2、如何改进问题1中的不足之处?
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气
体体积,从而消除由于加入液体引起的氢气体积
误差。
用导管将分液漏斗上部与锥形瓶连通
锌粒
硫酸
3、为探究催化剂对过氧化氢分解反应速率的影响,某兴趣小组设计如图装置。实验时,通过胶头滴管向容器中各滴入5滴溶液后,每隔10s观测注射器中气体体积
并进行比较。请回答:
(1)如何检验该装置气密性?
_______________________________。
(2)若甲装置在相同时间内收集到气体体积大于乙装置,能否推测Fe3+对H2O2分解的催化效果比Cu2+的好?_______(填“能”或“不能”),请说明理由______________________________________________________。
关闭分液漏斗的活塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
因为所用盐溶液的酸根离子不同,对实验可能产生干扰
不能
随
堂
练
习
2、反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol/(L·min) ②v(B)=0.6 mol/(L·s)
③v(C)=0.4 mol/(L·s) ④v(D)=0.45 mol/(L·s)下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
A
4、NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2, 4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是( )
A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.25 mol·L-1·min-1
提示:“三段式 设转化的NH3的物质的量为x mol,则
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
n(始)/mol 4 3 0 0
n(变)/mol x 0.75x 0.5x 1.5x
n(平)/mol 4-x 3-0.75x 0.5x 1.5x
C
6、某温度下按如图装置进行实验,锥形瓶内盛有6.5 g锌粒,通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为44.8 mL(标况),在该温度下下列说法不正确的是( )
A.用锌粒表示的10 s内该反应的速率为0.013 g·s-1
B.忽略锥形瓶内溶液体积的变化,用H+表示的10 s
内该反应的速率为0.01 mol·L-1·s-1
C.忽略锥形瓶内溶液体积的变化,用Zn2+表示的
10 s内该反应的速率为0.01 mol·L-1·s-1
D.用H2表示的10 s内该反应的速率为0.000 2 mol·s-1
C
①步骤:
1) 写化学方程式
2) 找出各物质的起始量、转化量、某时刻量
【注意】转化量之比 = 化学计量数之比
3) 根据已知条件列方程计算
2A(g)+ B(g) = 3 C(g) + 2 D(g)
起始浓度C初
4
3
0
0
转化浓度ΔC
2x
x
3x
2x
某刻浓度C某
4-2x
3-x
3x
2x
6.计算方法:三段式法
②常见求算量:
化学反应速率
化学反应速率 v
化学反应速率的测定
“三段式”计算
单位时间内,
反应物浓度的减少量或生成物浓度的增加量。
通过测量
一定时间内
找出各物质的起始量、转化量、某时刻量;
根据已知条件列方程计算
释放出气体的体积
气体的压强变化
颜色的深浅
光的吸收
导电能力
本节收获
100 mL 6 mol·L-1的H2SO4溶液与足量的锌粉反应,在一定温度下,加入下列物质,试将对v (H2)和n(H2)的影响填入下表中:
加入物质 对v(H2)的影响 对n(H2)的影响
Na2CO3固体
K2SO4溶液
NaNO3固体
通入一定量 HCl气体
减小
减小
减小
减小
减小
增大
增大
不变
课堂练习
反应原理Zn+H2SO4=ZnSO4+H2↑
有多少种方法测这个反应的速率?仪器和试剂、装置任选。发挥你的想象。
1.单位时间内收集氢气的体积;
2.收集相同体积氢气所需要的时间
3.有pH传感器测相同时间内溶液中pH变化,即△c(H+)。
4.用传感器测△c(Zn2+)变化。
5.测相同时间内△m(Zn)。
6.相同时间内恒容压强变化;
7.相同时间内绝热容器中温度变化。
二、化学反应速率的定量测定——实验
(三)应用探究
1.判断正误(正确的打“√”,错误的打“×”)。
对于反应CaCO3+2HCl===CaCl2+CO2↑+H2O,用下列方法来测定反应速率是否正确
(1)测定收集一定体积的CO2时所用的时间 ; ( )
(2)测定一段时间内溶液中c(H+)的变化; ( )
(3)测定一定质量的CaCO3完全溶解所需时间; ( )
(4)测定一定时间内产生CO2气体的体积; ( )
√
√
√
√
2.用大理石(杂质不与稀盐酸反应)与稀盐酸
反应制CO2,实验过程记录如右图所示,
下列有关说法正确的是 ( )
A.OE段表示的反应速率最快
B.EF段表示的反应速率最快,收集的CO2最多
C.FG段表示的收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增大
【课堂练习5】
√
第二章 化学反应速率与化学平衡
化学反应速率
化学平衡
化学反应的方向
化学反应的调控
研究一个化学反应进,往往需要关注以下两方面的问题:一是反应的快慢和历程,涉及反应速率和反应机理;二是反应的趋势和限度,涉及反应方向和化学平衡。这两个方面既有区别,又有联系。这些问题的研究,对于揭示化学反应的规律,获得调控化学反应的理论依据,以及日常生活和工农业生产都具有重要的意义。
用来衡量化学反应过程进行的快慢的物理量。
如果反应的体积是恒定的,化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
环节一、回顾化学反应速率
4、常用单位:
mol·L-1·s-1或mol/(L·s),
mol·L-1·min-1或mol/(L·min)等。
3、数学表达式:
v(B) = =
2、表示方法:
1、概念:
N2 + 3H2 2NH3
高温高压
催化剂
课本P25:在密闭容器:开始时N2的浓度为0.8mol/L,5min后 N2的浓度为0.7mol/L 。求这5min内N2的平均速率是多少?
v (N2)
=
Δc (N2)
Δt
=
v (H2)
=
Δc (H2)
Δt
=
0.1mol/L
5min
=
0.02 mol/(L min)
0.3mol/L
5min
=
0.06 mol/(L min)
v (NH3)
=
Δc (NH3)
Δt
=
0.2mol/L
5min
=
0.04 mol/(L min)
5、计算:
【思考】这三个数字表达的意义是否是一样的?
【题型1:化学反应速率的计算】 在2L密闭容器中加入1molN2 和3molH2发生反应 N2 + 3H2 2NH3 ,2s末时测得容器中含有0.4 mol NH3, 求该反应的化学反应速率(分别用三个物质表示)。
催化剂
高温、高压
N2 + 3H2 2NH3
催化剂
高温、高压
C起始 0.5 1.5 0
ΔC
C2s末
0.2
0.2
0.1
0.3
0.4 1.2
等于计量数比
υ(N2)=
Δc(N2)
Δt
=
0.1 mol/L
2 s
= 0.05 mol/(L.s)
υ(NH3)=
Δc(NH3)
Δt
=
0.2 mol/L
2 s
= 0.10 mol/(L.s)
υ(H2)=
Δc(H2)
Δt
=
0.3 mol/L
2 s
= 0.15 mol/(L.s)
变化量之比等于方程式前的计量数比
速率之比等于方程式前的计量数之比
变化量之比=速率之比=计量数之比
同一个反应,对一个化学反应:mA+nB=pC+qD,可用任何一种物质的量浓度随时间的变化来表示该反应的速率。
v(A) =
v(B) =
v(C) =
v(D) =
且有 = = = = 定值
催化剂
N2 + 3H2 2NH3
1mol/L 3mol/L 0
1mol/L
1mol/L
1.5 mol/L
0.5 mol/L
0.5 mol/L
1.5 mol/L
最终量
变化量
起始量
三段式解题法
起始量、变化量、最终量
第一步:写出化学方程式
第二步:写出三段式的量
第三步:依据相关公式计算
规律:变化量之比=速率之比=计量数之比
通过必修二的学习你知道影响化学反应速率的因素有哪些?
不同化学反应的速率
反应物本身性质(内因)
同一化学反应的速率
外界条件
(外因)
温度、浓度(压强)、催化剂、接触面积等
反应物组成、结构、性质
如何设计实验定性与定量研究这些因素是怎样影响
化学反应速率的呢?
实验中可以通过定性观察的方法来比较化学反应速率的大小,
也可通过实验进行定量测定。
环节二、 定性研究影响化学反应速率的因素
【提出问题】浓度、温度、催化剂等因素如何影响化学反应速率?如何测定化学反应速率?
【实验探究】
选择实验用品,设计实验探究影响化学反应速率的因素。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
控制变量法
Na2S2O3+H2SO4 = Na2SO4+SO2 +S +H2O
2H2O2 = 2H2O + O2
【实验原理】
选择实验现象明显的化学反应。通过观察冒气泡快慢;颜色变化;固体量减少;浑浊程度;温度变化等。
影响因素 反应原理 方案设计 实验现象 结论
浓度
温度
催化剂
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
Na2S2O3+H2SO4 = Na2SO4+SO2 +S +H2O
2H2O2 = 2H2O + O2
【实验探究】温度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,升高反应体系的温度,化学反应速率加快。
冷水
热水
环节二、定性研究影响化学反应速率的因素
【实验探究】浓度对化学反应速率的影响
实验 操作 原理 现象
结论 Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
溶液变浑浊,但速度慢
溶液变浑浊,但速度快
其他条件相同时,增大反应物浓度,化学反应速率加快。
【实验探究】催化剂对化学反应速率的影响
实验 操作 原理 现象
结论 2H2O2 = 2H2O + O2↑
几乎无气泡产生
产生较多气泡
其他条件相同时,催化剂可以改变化学反应速率。
定量研究化学反应速率的应用价值
(二)选择可观测、易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
(一)实验原理
找与化学反应物质的浓度相关的物理量
找与该物理量化学变化对应的时间
浊度仪
高锰酸钾溶液与草酸反应,
记录溶液褪色的时间
离子浓度检测仪
环节三、化学反应速率的定量测定——实验
【实验操作】
(1)按下图所示安装装置,检查装置气密性。在锥形瓶内放入2g锌粒,通过分液漏斗加入40 mL 1 mol/L的稀硫酸,测量收集10 mL H2所用的时间。
(2)用4 mol/L的稀硫酸代替1 mol/L的稀硫酸重复上述实验。
环节三、 定量研究影响化学反应速率的因素
加入试剂 收集10mLH2
的时间/s
1mol/LH2SO4
4mol/LH2SO4
97
171
【实验数据】
关闭分液漏斗的活塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
(1)锌粒颗粒大小(表面积)基本相同(控制变量,避免表面积的干扰)。
(2)40 mL的稀硫酸溶液要迅速加入。
(3)装置气密性要好,且计时要迅速、准确。
实验通过测量收集10 mL H2所用的时间,来表征反应速率的快慢,除了这个方式,还可以测量哪些物理量来表征速率快慢?
①测量一定时间内H+的浓度变化;
②测量一定时间内产生的H2的体积;
③测量一定时间内锌粒的质量变化。
二、 定量研究影响化学反应速率的因素
【注意事项】
【问题与讨论】
1、有同学经认真分析发现本实验设计存在一处明显的不足之处,你能找到吗?
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大。
2、如何改进问题1中的不足之处?
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气
体体积,从而消除由于加入液体引起的氢气体积
误差。
用导管将分液漏斗上部与锥形瓶连通
锌粒
硫酸
3、为探究催化剂对过氧化氢分解反应速率的影响,某兴趣小组设计如图装置。实验时,通过胶头滴管向容器中各滴入5滴溶液后,每隔10s观测注射器中气体体积
并进行比较。请回答:
(1)如何检验该装置气密性?
_______________________________。
(2)若甲装置在相同时间内收集到气体体积大于乙装置,能否推测Fe3+对H2O2分解的催化效果比Cu2+的好?_______(填“能”或“不能”),请说明理由______________________________________________________。
关闭分液漏斗的活塞后,将注射器活塞向外拉出一定距离,一段时间后松开活塞,若能回到原位,则气密性良好。
因为所用盐溶液的酸根离子不同,对实验可能产生干扰
不能
随
堂
练
习
2、反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 mol/(L·min) ②v(B)=0.6 mol/(L·s)
③v(C)=0.4 mol/(L·s) ④v(D)=0.45 mol/(L·s)下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
A
4、NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2, 4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是( )
A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.25 mol·L-1·min-1
提示:“三段式 设转化的NH3的物质的量为x mol,则
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
n(始)/mol 4 3 0 0
n(变)/mol x 0.75x 0.5x 1.5x
n(平)/mol 4-x 3-0.75x 0.5x 1.5x
C
6、某温度下按如图装置进行实验,锥形瓶内盛有6.5 g锌粒,通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为44.8 mL(标况),在该温度下下列说法不正确的是( )
A.用锌粒表示的10 s内该反应的速率为0.013 g·s-1
B.忽略锥形瓶内溶液体积的变化,用H+表示的10 s
内该反应的速率为0.01 mol·L-1·s-1
C.忽略锥形瓶内溶液体积的变化,用Zn2+表示的
10 s内该反应的速率为0.01 mol·L-1·s-1
D.用H2表示的10 s内该反应的速率为0.000 2 mol·s-1
C
①步骤:
1) 写化学方程式
2) 找出各物质的起始量、转化量、某时刻量
【注意】转化量之比 = 化学计量数之比
3) 根据已知条件列方程计算
2A(g)+ B(g) = 3 C(g) + 2 D(g)
起始浓度C初
4
3
0
0
转化浓度ΔC
2x
x
3x
2x
某刻浓度C某
4-2x
3-x
3x
2x
6.计算方法:三段式法
②常见求算量:
化学反应速率
化学反应速率 v
化学反应速率的测定
“三段式”计算
单位时间内,
反应物浓度的减少量或生成物浓度的增加量。
通过测量
一定时间内
找出各物质的起始量、转化量、某时刻量;
根据已知条件列方程计算
释放出气体的体积
气体的压强变化
颜色的深浅
光的吸收
导电能力
本节收获
100 mL 6 mol·L-1的H2SO4溶液与足量的锌粉反应,在一定温度下,加入下列物质,试将对v (H2)和n(H2)的影响填入下表中:
加入物质 对v(H2)的影响 对n(H2)的影响
Na2CO3固体
K2SO4溶液
NaNO3固体
通入一定量 HCl气体
减小
减小
减小
减小
减小
增大
增大
不变
课堂练习
反应原理Zn+H2SO4=ZnSO4+H2↑
有多少种方法测这个反应的速率?仪器和试剂、装置任选。发挥你的想象。
1.单位时间内收集氢气的体积;
2.收集相同体积氢气所需要的时间
3.有pH传感器测相同时间内溶液中pH变化,即△c(H+)。
4.用传感器测△c(Zn2+)变化。
5.测相同时间内△m(Zn)。
6.相同时间内恒容压强变化;
7.相同时间内绝热容器中温度变化。
二、化学反应速率的定量测定——实验
(三)应用探究
1.判断正误(正确的打“√”,错误的打“×”)。
对于反应CaCO3+2HCl===CaCl2+CO2↑+H2O,用下列方法来测定反应速率是否正确
(1)测定收集一定体积的CO2时所用的时间 ; ( )
(2)测定一段时间内溶液中c(H+)的变化; ( )
(3)测定一定质量的CaCO3完全溶解所需时间; ( )
(4)测定一定时间内产生CO2气体的体积; ( )
√
√
√
√
2.用大理石(杂质不与稀盐酸反应)与稀盐酸
反应制CO2,实验过程记录如右图所示,
下列有关说法正确的是 ( )
A.OE段表示的反应速率最快
B.EF段表示的反应速率最快,收集的CO2最多
C.FG段表示的收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增大
【课堂练习5】
√
