化学人教版(2019)必修第二册5.3 无机非金属材料(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.3 无机非金属材料(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 17.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 10:29:11 | ||
图片预览








文档简介
(共22张PPT)
高中化学 必修2 第五章 第三节 无机非金属材料
无机非金属材料
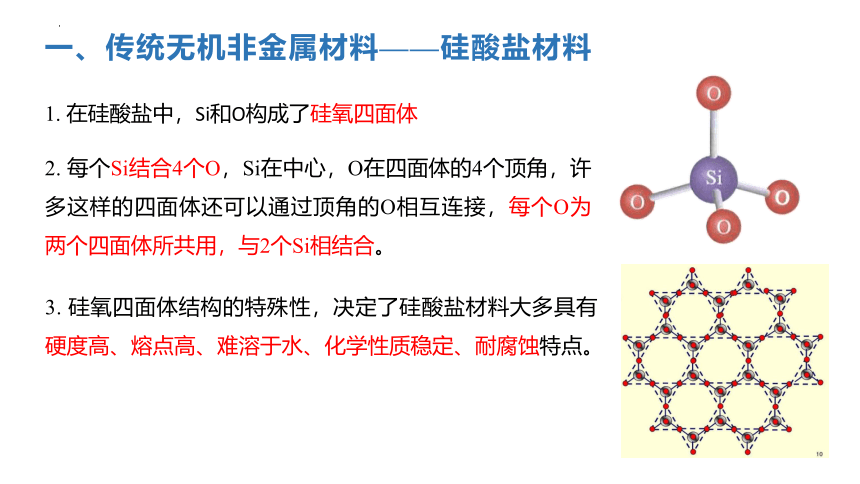
一、传统无机非金属材料——硅酸盐材料
1. 在硅酸盐中,Si和O构成了硅氧四面体
2. 每个Si结合4个O,Si在中心,O在四面体的4个顶角,许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共用,与2个Si相结合。
3. 硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀特点。
1. 陶 瓷
黏土 (主要成分为含水的铝硅酸盐)
高温烧结而成
抗氧化、抗酸碱腐蚀、耐高温、绝缘
生产建筑材料、绝缘材料、日用器皿、卫生洁具等
(人类最早使用的硅酸盐产品)
主要原料
反应原理
特 点
应 用
2. 玻璃
石英砂 (主要成分SiO2)、纯碱、石灰石
主要原料
反应原理
主要成分
高温下发生复杂的物理和化学变化制得
Na2SiO3
CaSiO3
SiO2
2. 玻璃
应 用
生产建筑材料、光学仪器和各种器皿、还可制造玻璃纤维用于高强度符合材料等。
加入一些金属氧化物或盐可以得到彩色玻璃,常用于建筑和装饰。
3. 水泥
黏土 、石灰石
主要原料
反应原理
特 点
应 用
水泥回转窑中煅烧,发生复杂的物理和化学变化
加适量石膏可调节水泥硬化速率
具有水硬性(与水掺和搅拌并静置后,很容易凝固变硬)
水泥、沙子和碎石等与水混合可以得到混凝土,大量用于建筑和水利工程
二、新型无机非金属材料
硅单质的导电性介于导体和绝缘体之间,是应用最广泛的半导体材料。
晶体硅中的杂质会影响其导电性能,因此必须制备高纯度的硅。
高纯硅的制备:
石英砂
粗硅
SiHCl3
高纯硅
1800 ~ 2000℃
焦炭
300℃
HCl
1100℃
H2
① SiO2 + 2C Si(粗) + 2CO↑
1800 0C ~ 2000 0C
② Si + 3HCl SiHCl3 + H2
300 0C
③ SiHCl3 + H2 Si + 3HCl
1100 0C
硅是一种亲氧元素,在自然界中没有游离态,一般以SiO2或硅酸盐的形式存在。
1. 晶体硅
硅单质的化学性质
1. 晶体硅
用途
高纯硅广泛应用于信息技术和新能源技术领域。
利用其半导体性能可以制成计算机、通讯设备和家用电器等的芯片,以及光伏电站、人造卫星和电动汽车等的硅太阳能电池。
2. 二氧化硅
沙子
石英砂
玛瑙
水晶
SiO2
硬度大、熔沸点高、常温下为固体、难溶于水、不导电、立体网状结构
物理性质
2. 二氧化硅
1、具有酸性氧化物的通性
①不溶于水,不与水反应(特殊)
(类比CO2)
SiO2 + CaO CaSiO3
高温
②与碱性氧化物反应
③与某些盐反应
④与强碱反应
SiO2 + 2NaOH Na2SiO3 + H2O
2. 二氧化硅
化学性质
3、特性:与氢氟酸(HF)反应
SiO2 + 4HF SiF4↑ + 2H2O
SiO2+2C ==== Si+2CO↑
高温
2、氧化性
化学性质
2. 二氧化硅
二氧化硅可用来生产光导纤维。
光导纤维
石英坩埚
玻璃仪器
精美瓷器
(通信)
用 途
光导纤维的通信容量大,抗干扰性能好,传输的信号不易衰减,能有效提高通讯效率高纯硅广泛应用于信息技术和新能源技术领域。
2. 二氧化硅
SiO2小结
SiO2
酸性氧化物
水
不反应
碱性
氧化物
碱
某些盐
氧化性
碳
活泼
金属
特性
应用
光导纤维
硅酸钠 Na2SiO3
物理性质
白色可溶于水的粉末状固体,水溶液俗称水玻璃,是一种矿物胶,有很强的黏合性。
化学性质
与酸反应:
Na2SiO3+H2O+CO2 Na2CO3+H2SiO3↓
①制硅酸;②黏合剂(矿物胶);③耐火阻燃剂;④防腐剂
用途
Na2SiO3+2HCl=2NaCl2+H2SiO3↓
是一种很弱的酸,酸性比碳酸还弱,溶解度很小,不稳定,受热易分解
H2SiO3 H2O+SiO2
如何制备硅酸?已知:酸性:盐酸>碳酸>硅酸
强酸制弱酸
Na2SiO3+H2O+CO2 Na2CO3+H2SiO3↓
Na2SiO3+2HCl=2NaCl2+H2SiO3↓
硅酸 H2SiO3
硅酸 H2SiO3
硅 酸
聚合
硅酸凝胶
干燥脱水
硅酸干凝胶
“硅胶”
硅胶的用途:
食品、药品的干燥剂
催化剂的载体
高中化学唯一难溶性酸
硅及其化合物转化图
Si
SiO2
H2SiO3
Na2SiO3
CaSiO3
SiC
SiF4
O2,加热
C,高温
加热
NaOH
HCl / CO2,H2O
CaO / CaCO3,高温
HF
C
CaCl2
SiH4
H2,加热
NaOH / Na2CO3
3. 新型陶瓷
碳原子
复合材料
4、
无机非金属材料
一、传统无机非金属材料
二、新型无机非金属材料
1、硅
2、二氧化硅
3、新型陶瓷
4、碳纳米材料
1、成分:硅酸盐
2、分类:陶瓷、玻璃、水泥
高中化学 必修2 第五章 第三节 无机非金属材料
无机非金属材料
一、传统无机非金属材料——硅酸盐材料
1. 在硅酸盐中,Si和O构成了硅氧四面体
2. 每个Si结合4个O,Si在中心,O在四面体的4个顶角,许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共用,与2个Si相结合。
3. 硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀特点。
1. 陶 瓷
黏土 (主要成分为含水的铝硅酸盐)
高温烧结而成
抗氧化、抗酸碱腐蚀、耐高温、绝缘
生产建筑材料、绝缘材料、日用器皿、卫生洁具等
(人类最早使用的硅酸盐产品)
主要原料
反应原理
特 点
应 用
2. 玻璃
石英砂 (主要成分SiO2)、纯碱、石灰石
主要原料
反应原理
主要成分
高温下发生复杂的物理和化学变化制得
Na2SiO3
CaSiO3
SiO2
2. 玻璃
应 用
生产建筑材料、光学仪器和各种器皿、还可制造玻璃纤维用于高强度符合材料等。
加入一些金属氧化物或盐可以得到彩色玻璃,常用于建筑和装饰。
3. 水泥
黏土 、石灰石
主要原料
反应原理
特 点
应 用
水泥回转窑中煅烧,发生复杂的物理和化学变化
加适量石膏可调节水泥硬化速率
具有水硬性(与水掺和搅拌并静置后,很容易凝固变硬)
水泥、沙子和碎石等与水混合可以得到混凝土,大量用于建筑和水利工程
二、新型无机非金属材料
硅单质的导电性介于导体和绝缘体之间,是应用最广泛的半导体材料。
晶体硅中的杂质会影响其导电性能,因此必须制备高纯度的硅。
高纯硅的制备:
石英砂
粗硅
SiHCl3
高纯硅
1800 ~ 2000℃
焦炭
300℃
HCl
1100℃
H2
① SiO2 + 2C Si(粗) + 2CO↑
1800 0C ~ 2000 0C
② Si + 3HCl SiHCl3 + H2
300 0C
③ SiHCl3 + H2 Si + 3HCl
1100 0C
硅是一种亲氧元素,在自然界中没有游离态,一般以SiO2或硅酸盐的形式存在。
1. 晶体硅
硅单质的化学性质
1. 晶体硅
用途
高纯硅广泛应用于信息技术和新能源技术领域。
利用其半导体性能可以制成计算机、通讯设备和家用电器等的芯片,以及光伏电站、人造卫星和电动汽车等的硅太阳能电池。
2. 二氧化硅
沙子
石英砂
玛瑙
水晶
SiO2
硬度大、熔沸点高、常温下为固体、难溶于水、不导电、立体网状结构
物理性质
2. 二氧化硅
1、具有酸性氧化物的通性
①不溶于水,不与水反应(特殊)
(类比CO2)
SiO2 + CaO CaSiO3
高温
②与碱性氧化物反应
③与某些盐反应
④与强碱反应
SiO2 + 2NaOH Na2SiO3 + H2O
2. 二氧化硅
化学性质
3、特性:与氢氟酸(HF)反应
SiO2 + 4HF SiF4↑ + 2H2O
SiO2+2C ==== Si+2CO↑
高温
2、氧化性
化学性质
2. 二氧化硅
二氧化硅可用来生产光导纤维。
光导纤维
石英坩埚
玻璃仪器
精美瓷器
(通信)
用 途
光导纤维的通信容量大,抗干扰性能好,传输的信号不易衰减,能有效提高通讯效率高纯硅广泛应用于信息技术和新能源技术领域。
2. 二氧化硅
SiO2小结
SiO2
酸性氧化物
水
不反应
碱性
氧化物
碱
某些盐
氧化性
碳
活泼
金属
特性
应用
光导纤维
硅酸钠 Na2SiO3
物理性质
白色可溶于水的粉末状固体,水溶液俗称水玻璃,是一种矿物胶,有很强的黏合性。
化学性质
与酸反应:
Na2SiO3+H2O+CO2 Na2CO3+H2SiO3↓
①制硅酸;②黏合剂(矿物胶);③耐火阻燃剂;④防腐剂
用途
Na2SiO3+2HCl=2NaCl2+H2SiO3↓
是一种很弱的酸,酸性比碳酸还弱,溶解度很小,不稳定,受热易分解
H2SiO3 H2O+SiO2
如何制备硅酸?已知:酸性:盐酸>碳酸>硅酸
强酸制弱酸
Na2SiO3+H2O+CO2 Na2CO3+H2SiO3↓
Na2SiO3+2HCl=2NaCl2+H2SiO3↓
硅酸 H2SiO3
硅酸 H2SiO3
硅 酸
聚合
硅酸凝胶
干燥脱水
硅酸干凝胶
“硅胶”
硅胶的用途:
食品、药品的干燥剂
催化剂的载体
高中化学唯一难溶性酸
硅及其化合物转化图
Si
SiO2
H2SiO3
Na2SiO3
CaSiO3
SiC
SiF4
O2,加热
C,高温
加热
NaOH
HCl / CO2,H2O
CaO / CaCO3,高温
HF
C
CaCl2
SiH4
H2,加热
NaOH / Na2CO3
3. 新型陶瓷
碳原子
复合材料
4、
无机非金属材料
一、传统无机非金属材料
二、新型无机非金属材料
1、硅
2、二氧化硅
3、新型陶瓷
4、碳纳米材料
1、成分:硅酸盐
2、分类:陶瓷、玻璃、水泥
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
