11.1.2盐的化学性质-课件(人教版)(共69张PPT)
文档属性
| 名称 | 11.1.2盐的化学性质-课件(人教版)(共69张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 00:00:00 | ||
图片预览








文档简介
(共69张PPT)
课题1 生活中常见的盐
第十一单元 盐 化肥
第2课时 盐的化学性质
【回顾】请书写出实验室制取 CO2的方程式。
CaCO3 + 2 HCl = CaCl2 + H2CO3
CO2↑+H2O
盐酸腐蚀含CaCO3的建材
盐的化学性质
三
盐
酸
+
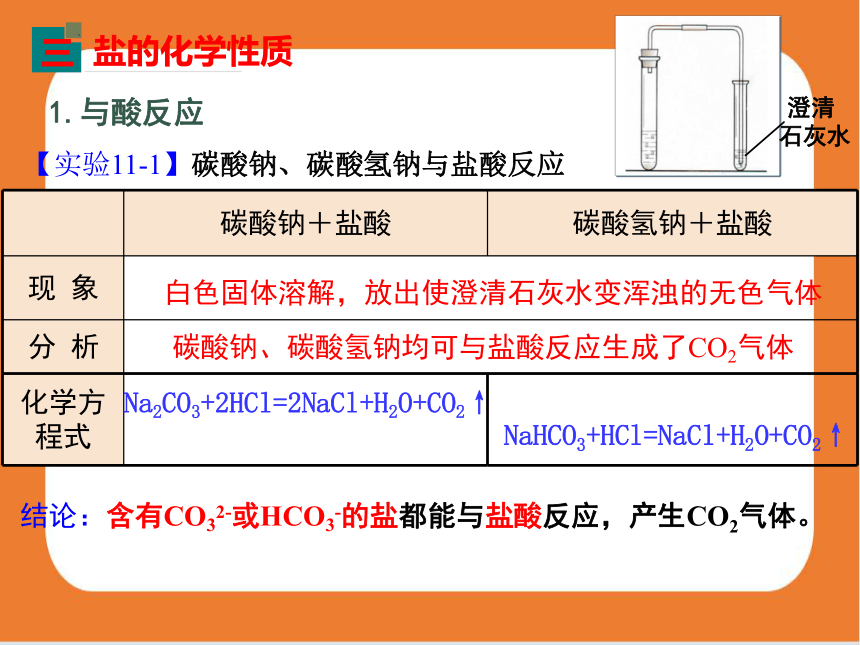
【实验11-1】碳酸钠、碳酸氢钠与盐酸反应
1.与酸反应
盐的化学性质
三
澄清
石灰水
碳酸钠+盐酸 碳酸氢钠+盐酸
现 象 分 析 化学方程式
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠、碳酸氢钠均可与盐酸反应生成了CO2气体
【实验11-1】碳酸钠、碳酸氢钠与盐酸反应
1.与酸反应
盐的化学性质
三
澄清
石灰水
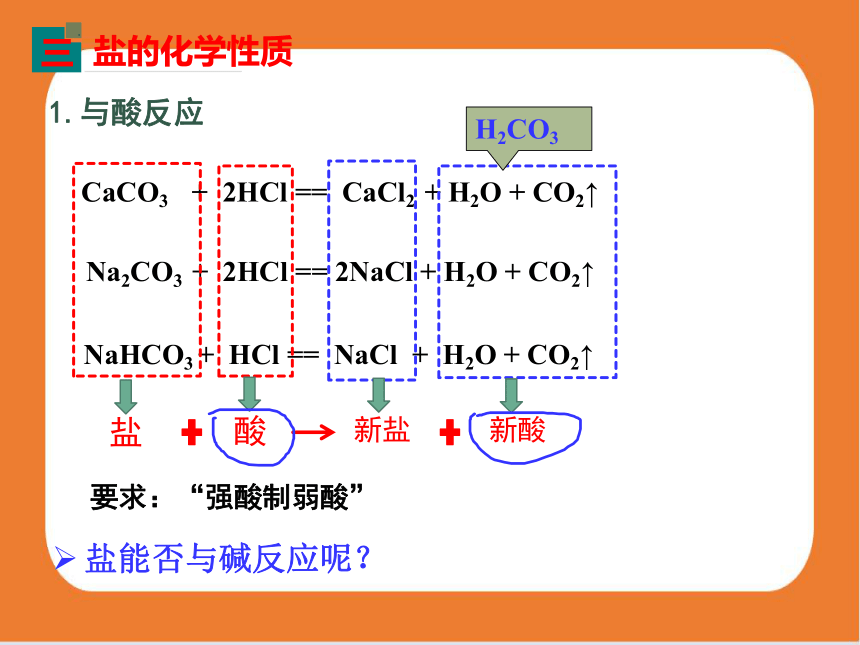
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
结论:含有CO32-或HCO3-的盐都能与盐酸反应,产生CO2气体。
怎样检验这 些物质中含有碳酸根呢?
方法总结
CO32-或HCO3-的检验
检验试剂:
稀盐酸和澄清石灰水
检验方法:
①取样品于试管中,加入适量的稀盐酸,有气体生成;②把生成的气体通入澄清的石灰水,石灰水变浑浊,
则证明此固体含有CO32-或HCO3- 。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
NaHCO3 + HCl == NaCl + H2O + CO2↑
H2CO3
盐
酸
新盐
新酸
1.与酸反应
盐的化学性质
三
盐能否与碱反应呢?
要求:“强酸制弱酸”
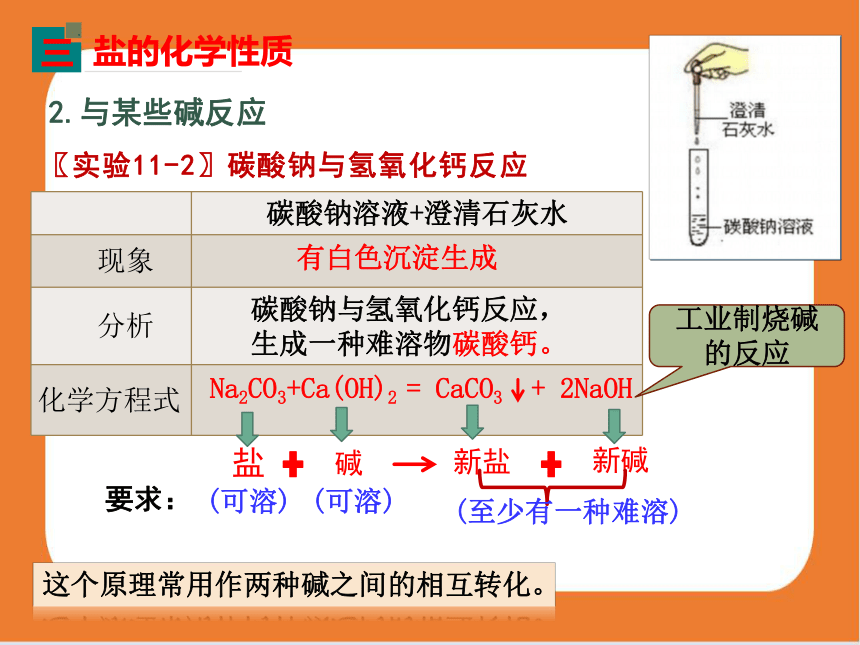
〖实验11-2〗碳酸钠与氢氧化钙反应
2.与某些碱反应
盐的化学性质
三
〖实验11-2〗碳酸钠与氢氧化钙反应
碳酸钠溶液+澄清石灰水
现象
分析
化学方程式
有白色沉淀生成
Na2CO3+Ca(OH)2 = CaCO3 + 2NaOH
工业制烧碱的反应
2.与某些碱反应
盐的化学性质
三
盐
新盐
新碱
碱
这个原理常用作两种碱之间的相互转化。
碳酸钠与氢氧化钙反应,
生成一种难溶物碳酸钙。
要求:
(可溶)
(可溶)
(至少有一种难溶)
点石成金
葛洪是我国古代著名的炼丹家。一次,葛洪之妻鲍姑用铁勺盛“曾青”(硫酸铜溶液),几天后,葛洪发现了一个奇妙的现象:铁勺变成了“铜勺”,葛洪的徒弟高兴地跳了起来:“点石成金啦!”
CuSO4 + Fe = FeSO4 + Cu
盐
较活泼金属
新盐
新金属
“曾青得铁则为铜”
3.与某些金属反应
盐的化学性质
三
【思考】是否所有金属都可以跟CuSO4发生反应?金属与盐反应应该注意哪些方面?
在金属活动性顺序表中,只有____的金属才能把____的金属从它的__ _中置换出来,与氢的位置 __关;盐必须是___盐。
金属+盐 → 新盐+新金属
位于前面
位于后面
盐溶液
无
可溶性
不要用K、Ca、Na置换盐溶液中的金属
铁参加的置换反应生成的都是亚铁盐
Fe + CuSO4 = FeSO4 + Cu
(可溶)
小结:
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
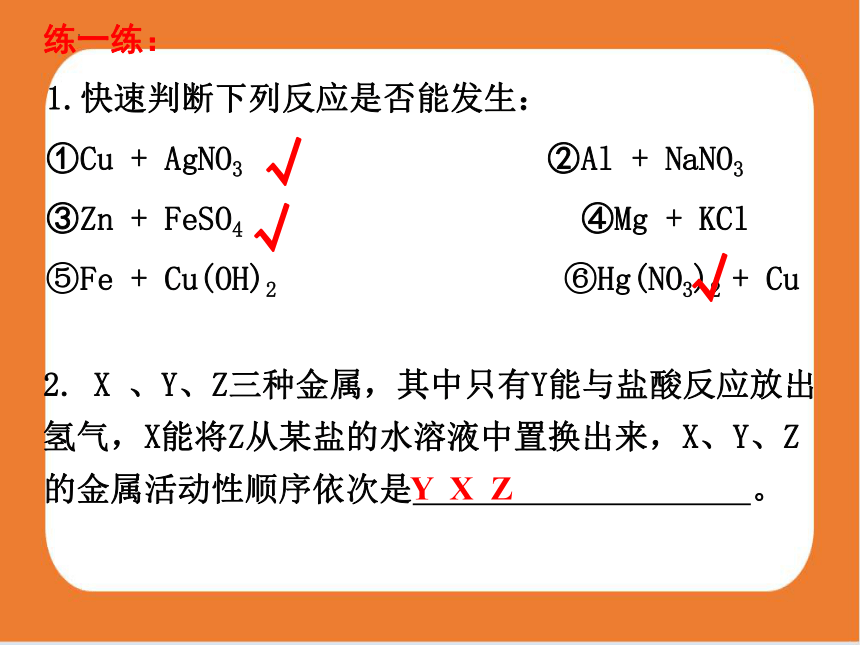
1.快速判断下列反应是否能发生:
①Cu + AgNO3 ②Al + NaNO3
③Zn + FeSO4 ④Mg + KCl
⑤Fe + Cu(OH)2 ⑥Hg(NO3)2 + Cu
2. X 、Y、Z三种金属,其中只有Y能与盐酸反应放出氢气,X能将Z从某盐的水溶液中置换出来,X、Y、Z的金属活动性顺序依次是 。
Y X Z
练一练:
√
√
√
在医院,某病人服用硫酸钡和糖浆的混合物来检查肠胃,但是误服了碳酸钡,在胃酸的作用下会转化为有毒的氯化钡,这时,医生让病人立即服用硫酸钠进行解毒。硫酸钠为什么可以解毒?
硫酸钡是不溶于酸的白色沉淀,氯化钡与硫酸钠反应生成了沉淀,对人体就不会造成危害。
Na2SO4 + BaCl2== BaSO4 + 2NaCl
盐1
盐2
新盐1
新盐2
4.与某些盐反应
盐的化学性质
三
要求:
(可溶)
(可溶)
(至少有一种难溶)
小结:盐的化学性质
课 堂 达 标
1.下面是一些常见物质的俗称,其中错误的是( )
A.碳酸氢钠——苏打 B.碳酸钠——纯碱
C.氯化钠——食盐 D.氢氧化钙——消石灰
2.将某种固体放入稀盐酸中,有气泡产生,则这种固体肯定不是下列哪种物质( )
A.锌粒 B.纯碱 C.熟石灰 D.小苏打
A
C
3.用序号填空:① Na2CO3 ② NaCl ③ CaCO3 ④ NaHCO3
(1)用作调味品的是______;
(2)用于生产玻璃和洗涤剂的是______;
(3)用作补钙剂的是______;
(4)发酵粉的主要成分之一是______。
4.草木灰是农家肥料,它的主要成分是一种含钾的盐。取一些草木灰加到盐酸中,生成的气体可使澄清的石灰水变浑浊。
(1)由此可推断草木灰的主要成分是________ (化学式)。
(2)写出反应的化学方程式 。
②
①
③
④
K2CO3
K2CO3+2HCl = 2KCl+H2O+CO2↑
5.用石灰石、水、纯碱怎样制取烧碱?
写出有关的化学方程式:
_______________________、______________________、_________________________________。
CaCO3 CaO +CO2
高温
CaO+H2O==Ca(OH)2
Na2CO3+Ca(OH)2==CaCO3 +2NaOH
写出下列物质反应的化学方程式。
复习巩固
(1)盐酸和氢氧化钠反应
(2)实验室制取二氧化碳的反应
(3)工业制烧碱的反应
(4)硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠
(5)用盐酸除铁锈
(1)HCl+NaOH==H2O+NaCl
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
归纳总结:
(1)HCl+NaOH==H2O+NaCl
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
观察这五个反应有什么共同特点?
由两种化合物互相交换成分,生成另外两种化合物
复分解反应
概念
问题:下列反应是否属于复分解反应?
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
+
+
表达式
两交换,价不变
由两种化合物互相交换成分,生成另外两种化合物的反应。
AB + CD AD + CB
复分解反应
四
不属于
归纳总结1:
(1)HCl+NaOH==H2O+NaCl
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
复分解反应的类型
酸 + 碱 → 盐 + 水
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
中和反应
复分解反应的五种类型
盐1 + 盐2 → 新盐1 + 新盐2
金属氧化物 + 酸 → 盐 + 水
四种基本反应类型
化学反应类型
化合反应
分解反应
置换反应
复分解反应
多变一
一变多
单换单
双交换,价不变
A+B+C…→D
A→ B+C…
A + BC→B + AC
AB + CD→ AD+ CB
归纳总结2:
H+、Cl-
Na+、
CO3 2-
Na+、
Cl-
反应前
反应后
溶液中离子种类和数目发生改变
2HCl + Na2CO3 ——
NaCl+ + H2O
——
CO2↑
复分解反应发生时的离子变化
K2SO4 + NaNO3
×
Na+、
SO42-
K+、
NO3-
K+、
SO42-
Na2SO4 + KNO3 ——
Na+、
NO3-
溶液中离子种类和数目没发生改变
反应前
反应后
√
复分解发生反应的实质:
溶液中某些离子的数目减少了。
酸、碱、盐之间并不是都能发生复分解反应,
需要满足什么样的条件,复分解反应才能发生呢?
NaCl和H2SO4、KNO3和Na2CO3能否发生复分解反应?
思考
NaCl + H2SO4 → Na2SO4 + HCl
KNO3 + Na2CO3 → K2CO3+ NaNO3
生成物都是溶于水的化合物
生成物都是溶于水的化合物
溶液中离子种类和数目都没有发生改变
实验11-3:
复分解反应发生的条件
三、复分解反应发生的条件
实验11-3:
硫酸铜溶液
氢氧化钠溶液
硫酸铜溶液
氯化钡溶液
复分解反应发生的条件
有白色沉淀生成
有蓝色沉淀生成
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
CuSO4+BaCl2 = CuCl2+BaSO4↓
讨论:
1.上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2.前面学过的酸碱中和反应也属于复分解反应,中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到共同现象是什么?
都有水生成
属于复分解反应
都有沉淀生成
都有气体生成
P75
如果几种离子混合后,离子的种类和数目不发生变化,那么,反应也就没有发生。
在复分解反应中,能使溶液中离子数目减小的情况大致有三种:(1)在反应里有沉淀生成;
(2)在反应中有气体放出;
(3)在反应中有水生成
【准确说是有弱电解质(包括水、弱酸、弱碱等)生成】
复分解反应发生的条件:
(1)生成沉淀 (2)生成气体 (3)生成水(或弱酸、弱碱)
反应类型 反应物需要满足条件 生成物需要满足条件
酸+碱
酸+盐 碱+盐 盐+盐 金属氧化物+酸 复分解反应发生的条件
一种可溶即可
(一般是酸可溶)
盐可溶或者难溶,
酸必须可溶
反应物两者都可溶
至少具备下列三个条件中的一个
①有沉淀生成
②有气体生成
③有水(或弱酸、弱碱)生成
酸可溶
复分解发生反应的实质:
溶液中某些离子的数目减少了。
判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
2HNO3 + K2CO3——
KNO3 + NaOH——
不能
BaSO4↓+ 2NaCl
2KNO3 + CO2↑+H2O
不能
练一练
P114 附录Ⅰ 部分酸、碱、盐的溶解性表(室温)
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
酸
(1)常见的酸都可溶。
归纳总结: 酸、碱、盐的溶解性规律
【H2SiO3难溶】
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
碱
NH3﹒H2O
(1)常见的酸:都可溶。
归纳总结: 酸、碱、盐的溶解性规律
(2)常见的碱类:①只溶“钾、钠、氨、钙、钡”。
②其他的碱大多数不溶于水。
【H2SiO3难溶】
Mg(OH)2、Al(OH)3、Mn(OH)2、Fe(OH)2、Zn(OH)2:均为白色沉淀
AgOH
白色沉淀
== Ag2O + H2O
Fe(OH)3[红褐色]、Cu(OH)2[蓝色]
2
灰褐色沉淀
即KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶)、NH3﹒H2O可溶于水;
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
钾钠铵盐均易溶
硝酸盐见水影无踪
AgCl
BaSO4
在水中因发生
双水解而不存在
BaCO3
CaCO3
MnCO3
ZnCO3
FeCO3
Ag2CO3
(1)常见的酸:都可溶。
归纳总结: 酸、碱、盐的溶解性规律
(2)常见的碱类:①只溶“钾、钠、氨、钙、钡”。
②其他的碱大多数不溶于水。
【H2SiO3难溶】
Mg(OH)2、Al(OH)3、Mn(OH)2、Fe(OH)2、Zn(OH)2:均为白色沉淀
AgOH
白色沉淀
== Ag2O + H2O
Fe(OH)3[红褐色]、Cu(OH)2[蓝色]
2
灰褐色沉淀
即KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶)、NH3﹒H2O可溶于水;
(3)常见盐:
AgCl和BaSO4既不溶于水也不溶于酸
碳酸盐只溶钾、钠、铵,剩下大多不溶于水
钾盐、钠盐、铵盐、硝酸盐均易溶,
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
Ca(OH)2
CaSO4
Ag2SO4
MgCO3
(1)常见的酸:都可溶。
归纳总结: 酸、碱、盐的溶解性规律
(2)常见的碱类:只溶“钾、钠、氨、钙、钡”。
其他的碱大多数不溶于水。
【H2SiO3难溶】
Mg(OH)2、Al(OH)3、Mn(OH)2、Fe(OH)2、Zn(OH)2:均为白色沉淀
AgOH
白色沉淀
== Ag2O + H2O
Fe(OH)3[红褐色]、Cu(OH)2[蓝色]
2
灰褐色沉淀
即KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶)、NH3﹒H2O可溶于水;
(3)常见盐:
AgCl和BaSO4既不溶于水也不溶于酸
碳酸盐只溶钾、钠、铵,剩下大多不溶于水
钾盐、钠盐、铵盐、硝酸盐均易溶,
(4) 四个微溶物:
Ca(OH)2、CaSO4、Ag2SO4、 MgCO3
物质溶解性口诀:
钾钠铵盐均易溶
硝酸盐见水影无踪
硫酸盐难溶铅和钡
盐酸盐不溶银、亚汞
碳酸盐只溶钾、钠、铵
可溶性的盐:钾、钠、铵盐;硝酸盐等。
BaSO4↓
PbSO4↓
AgCl↓
HgCl↓
CO32-盐:
除K2CO3
、Na2CO3
、(NH4)2CO3
其余均难溶
CaCO3、BaCO3 、Ag2CO3 、ZnCO3 、FeCO3 、CuCO3等
【SO32-盐、PO43-盐溶解性与CO32-盐相似】
酸类易溶除硅酸
碱溶钾、钠、氨、钙、钡
盐
规律总结
常见的七种沉淀
不能共存的离子对
BaSO4
BaCO3
AgCl
CaCO3
Mg(OH)2
Cu(OH)2
Fe(OH)3
白色
蓝色
红褐色
不溶于酸
能溶于酸
生成水而不共存:H+和OH-
生成气体而不共存:H+和CO32-、H+和HCO3-、NH4+和OH-
生成沉淀而不共存:CO32-和Ca2+、 Ba2+、 Mg2+、 Ag+, Ag+和Cl-、 Ba2+和SO42-
BaSO4
OH-和Mg2+、Al3+、 Zn2+、Fe2+、Fe3+ 、Cu2+、Ag+
初中常见7大沉淀
白色沉淀:碳酸钙 CaCO3
碳酸钡 BaCO3
氢氧化镁 Mg(OH)2
硫酸钡 BaSO4
氯化银 AgCl
蓝色沉淀:氢氧化铜 Cu(OH)2
红褐色沉淀:氢氧化铁 Fe(OH)3
①判断下列物质中那些属于酸,那些是碱和盐?
1. NaCl 2. NaHSO4 3.Na2SO4 4.NaHCO3
5. MgOHCl 6. Mg(OH)2 7.CaHPO 4 8.Cu2(OH)2CO3
9. HCl 10. NH4Cl 11. (NH4)2SO4
②判断下列物质是否溶于水:
Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2S Ba(OH)2 Mg(OH)2 AgNO3 Na3PO4 Ag2SO4
练一练:
↓
酸
碱
↓
↓
↓
↓
↓
微溶
练一练:
③下列物质能否发生反应 写出能发生反应的化学方程式,并注明反应类型。
(1)银与稀盐酸
(2)铜与硫酸锌溶液
(3)铝与硝酸银溶液
(4)硫酸和硝酸钠溶液
(5)氢氧化钾溶液和硝酸
(6)氯化钠溶液和硝酸银溶液
(7)碳酸钾溶液和稀硫酸
(8)硫酸铜溶液和氯化钡溶液
√
√
√
√
√
1、AgNO3 + HCl ----------
2、 K2CO3+ Ca(OH)2-----
3、NaHCO3+ H2SO4 --------
4、Na2SO4 + HCl ----------
5、H2SO4 + BaCl2--------
6、Ba(OH)2+ CuSO4 --------
7、CuSO4 + NH4NO3-----
8、HNO3 + NaOH -------
9、BaCl2+ NaOH -------
AgCl↓+HNO3
CaCO3↓+ KOH
Na2SO4+ H2O+CO2↑
不反应
BaSO4↓+ HCl
BaSO4↓+ Cu(OH)2 ↓
不反应
NaNO3 + H2O
练一练:
④下列物质间能否反应
不反应
思考:可溶于水的钡盐( Ba(NO3)2、BaCl2等)对人体有毒,但是难溶于水也难溶于酸的BaSO4,不但没有毒,而且还由于它具有不易被X射线透过的性质,可用作肠胃的内服药剂------“钡餐”。
(1)有人认为用BaCO3代替BaSO4,现请你判断,若认为可以, 说明理由。若认为不行,请你写出有关的化学方程式。
(2)若误服了BaCl2,可用于解毒的药剂是( )
A、糖水 B、硫酸钠溶液 C、食盐水 D、硫酸铜溶液
B
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
BaCO3 + 2HCl= BaCl2 + CO2↑ + H2O
不行
CaCO3+CO2+H2O=Ca(HCO3)2
原理:
Ca(HCO3)2 = CaCO3 +CO2 + H2O
石笋和钟乳石的形成
P77资料卡片
物质
混合物
单 质
纯净物
化合物
碱
盐
酸
氧化物
金属单质
非金属单质
Cu、Fe
O2、He
CaO、CO2
HCl、H2SO4
Ca(OH)2
NaCl、K2CO3
溶液、合金、混合气体(如空气)、矿石等
(只含一种物质)
(含多种物质)
(单一元素)
(多种元素)
物质的分类
五
1. CO32-或HCO3-的检验
检验试剂:
稀盐酸和澄清石灰水
检验方法:
①取样品于试管中,加入适量的稀盐酸,有气体生成;②把生成的气体通入澄清的石灰水,石灰水变浑浊,
则证明此固体含有CO32-或HCO3- 。
六、离子的检验:
①取 样
+稀盐酸
产生气体
变浑浊
+澄清石灰水
1. CO32-或HCO3-的检验
六、离子的检验:
检验试剂:
①稀盐酸和澄清石灰水
②CaCl2溶液或BaCl2溶液
操作:
②取 样
+ CaCl2溶液
产生白色沉淀
CO32-
无明显现象
HCO3-
[补充] 2.Cl-的检验方法:
操作:
现象:
结论:
注意:1)稀HNO3排除CO32-离子的干扰!
2)试剂的加入没有先后限制
试剂:
稀HNO3、AgNO3溶液
先加入稀HNO3酸化,再加入几滴AgNO3溶液。
先加入几滴AgNO3溶液,再加入稀HNO3酸化。
加入稀HNO3酸化的AgNO3溶液。
出现不溶于稀硝酸的白色沉淀AgCl。
原溶液中存在Cl-
3. SO42-的检验:
1)试剂:稀盐酸、氯化钡溶液
3)操作方法:
待测液
+稀盐酸
所得溶液
+ BaCl2溶液
产生白色沉淀,
则原溶液中含SO42-
排除CO32-、SO32-、Ag+等干扰
Na2SO4+BaCl2=BaSO4↓+2NaCl
2)原理:
BaSO4不溶于稀盐酸
问:1)为什么在加BaCl2之前,先要加几滴稀盐酸酸化?
3)能否改用稀HNO3酸化?
不能, HNO3能氧化SO32-生成SO42- ,干扰SO42-的检验
2)若先加BaCl2后加稀盐酸,产生白色沉淀,能说明含SO42-吗?
不能。 Ag+会干扰
六、离子的检验:
1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)
2、步骤:
(1)先对试样的外观进行观察(颜色、状态)
(2)将试样(固体)配成溶液,取出少许进行检验
(3 )选择合理的试剂(反应灵敏、现象明显)
(4)注意排除某些共有现象的干扰。
归纳总结:
A. Zn+H2SO4 ==ZnSO4+H2↑
B. 2KMnO4 ==K2MnO4+MnO2+O2↑
C. CaO+H2O==Ca(OH)2 D. CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
【例1】下列化学反应属复分解反应的是( )
典例探究
D
【例2】下列各组中的物质,能在溶液中共存的是( )
A. KNO3、NaCl、NaOH
B. KOH、Na2CO3、HCl
C. KNO3、NaOH、FeCl3
D. AgNO3、BaCl2、HNO3
A
离子(物质)共存问题:溶液中的物质相互交换成分(或溶液中的离子相互结合)后,如果会生成沉淀、水或气体,就说明它们不能共存,否则,就能共存。
1. 下列各组物质,能在PH=1.5的溶液中大量共存,且形成无色溶液的是:
A.NaCl BaCl2 Na2SO4
B.Na2CO3 NaCl Na2SO4
C.CuSO4 NaCl NaNO3
D.Na2SO4 HCl KCl
D
迁移练习
2.分别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是
NaNO3 NaCl H2SO4
CaCO3 NaOH Na2SO4
C. BaCl2 NaNO3 CuSO4
D. AgNO3 Na2SO4 NaCl
A
3、能在水中大量共存的一组离子是 ( )
A.NH4+、Na+、C1-、SO42-
B.H+、Na+、NO3-、CO32-
C.K+、Ba2+、OH-、SO42-
D.K+、Ag+、NO3-、C1-
A
4.下列各组离子间不能反应的是 ( )
A.H+ Na+ 0H- NO3-
B.Na+ K+ Cl- OH-
C.H+ K+ CO32- HCO3-
D.K+ Ba2+ Cl- SO42-
B
5.能够用来鉴别BaCl2、 NaCl 、 Na2CO3三种物质的试剂是 ( )
A.AgNO3溶液 B.稀硫酸
C.稀盐酸 D.稀硝酸
B
6.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是 ( )
①滴加Mg(NO3)2溶液;②过滤;
③滴加AgNO3溶液; ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
B
课 堂 达 标
1.下列反应中不属于复分解反应的是( )
A. H2SO4+Ca(OH)2=CaSO4+2H2O
B. H2SO4+BaCl2=BaSO4↓+2HCl
C. 2HCl+Fe=FeCl2+H2↑
D. 2HCl+CaSO4=CaCl2+H2O+CO2 ↑
C
B
2.下列物质混合后,不能发生复分解反应的一组是( )
A.K2SO4溶液和Ba(OH)2溶液混合
B.KCl 溶液和Cu(NO3)2溶液混合
C.CuSO4溶液和NaOH溶液混合
D.CaCO3和HCl溶液
3.下列各组离子在水中一定能大量共存,并形成无色溶液的是( )
A. Cu2+、H+、SO42-、Cl- B. Ba2+、Na+、Cl-、NO3-
C. K+、Ca2+、OH-、CO32- D. Na+、H+、 CO32- 、 NO3-
4.现有Fe、CuO、MgCl2溶液、Ca(OH)2溶液、稀H2SO4五种物质,在常温下它们两两相互发生的化学反应有( )
A.7个 B.6个 C.5个 D.4个
D
B
5.下列实验中无明显现象的是( )
A.向H2SO4溶液中滴加Ba(OH)2溶液
B.向Mg(NO3)2溶液中滴加Na2SO4溶液
C.将浓硫酸加入蒸馏水中并不断搅拌
D.将(NH4)2SO4和熟石灰混合研磨
6.通过物质间相互反应可以实现物质间的相互转化,下列物质间的转化,通过一步化学反应不能实现的是( )
A.C→CO→CO2 B.Mg→MgO→MgCl2
C.CuO→Cu(OH)2→CuCl2 D.NaOH→NaCl→NaNO3
B
C
7.不用其他试剂,仅仅利用试管和胶头滴管就可以区别下列四种物质的溶液:①CuSO4;②MgCl2;③KOH;④NaNO3。则正确的鉴别顺序是( )
A.②③①④ B.①②③④ C.①③②④ D.②①③④
C
8.除去下列物质中的少量杂质(括号内为杂质),所选用的试剂和操作错误的是( )
C
9、有一包固体粉末,可能有CaCO3、Na2SO4、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:
①将这些固体粉末加到水中,得到白色沉淀,上层清液为无色;
②该白色沉淀不溶于稀硝酸。
从实验可以判断出,该粉末中一定含有 ,
一定不含有 。
Na2SO4、BaCl2
CaCO3、CuSO4
10.下图表示物质间的转化关系(图中“→”表示某种物质转化成另一种物质)。
(1)转化①的基本反应类型是____________;
(2)向澄清石灰水中通入CO2能够实现转化②,反应的化学方程式为_______________________________;
(3)若转化③、④、⑤都是与同种物质反应生成CaCl2,则该物质是_____________.
稀盐酸(HCl)
CO2+Ca(OH)2==CaCO3↓+H2O
分解反应
1)A组发生化学变化,化学方程式为 。
实质是反应物1中的 (填粒子符号,下同)与反应物2中的______结合形成 。
2)B组发生化学变化,且B组反应物1是盐的水溶液,反应物2是碱的水溶液,则B组中反应物1是 (填名称,下同),反应物2是 ;
3)C组没有发生化学反应,原因是(微观角度解释): 。
11.将下列各组中的两种溶液混合(溶液中的原有的水分子忽略不写):
编号 反应物1 反应物2 混合后存在的粒子
A 稀盐酸(H+、Cl-) 氢氧化钾溶液(K+、OH-) K+、Cl-、H2O
B Na+、SO42-、Cu(OH)2↓
C 氯化钠溶液(Na+、Cl-) 稀硫酸(H+、SO42-) H+、SO42- 、Na+、Cl-
HCl+KOH=KCl +H2O
H+
OH-
H2O
硫酸铜溶液
氢氧化钠溶液
混合前后,溶液中的离子没有结合成新的分子
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
课题1 生活中常见的盐
第十一单元 盐 化肥
第2课时 盐的化学性质
【回顾】请书写出实验室制取 CO2的方程式。
CaCO3 + 2 HCl = CaCl2 + H2CO3
CO2↑+H2O
盐酸腐蚀含CaCO3的建材
盐的化学性质
三
盐
酸
+
【实验11-1】碳酸钠、碳酸氢钠与盐酸反应
1.与酸反应
盐的化学性质
三
澄清
石灰水
碳酸钠+盐酸 碳酸氢钠+盐酸
现 象 分 析 化学方程式
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠、碳酸氢钠均可与盐酸反应生成了CO2气体
【实验11-1】碳酸钠、碳酸氢钠与盐酸反应
1.与酸反应
盐的化学性质
三
澄清
石灰水
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
结论:含有CO32-或HCO3-的盐都能与盐酸反应,产生CO2气体。
怎样检验这 些物质中含有碳酸根呢?
方法总结
CO32-或HCO3-的检验
检验试剂:
稀盐酸和澄清石灰水
检验方法:
①取样品于试管中,加入适量的稀盐酸,有气体生成;②把生成的气体通入澄清的石灰水,石灰水变浑浊,
则证明此固体含有CO32-或HCO3- 。
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
NaHCO3 + HCl == NaCl + H2O + CO2↑
H2CO3
盐
酸
新盐
新酸
1.与酸反应
盐的化学性质
三
盐能否与碱反应呢?
要求:“强酸制弱酸”
〖实验11-2〗碳酸钠与氢氧化钙反应
2.与某些碱反应
盐的化学性质
三
〖实验11-2〗碳酸钠与氢氧化钙反应
碳酸钠溶液+澄清石灰水
现象
分析
化学方程式
有白色沉淀生成
Na2CO3+Ca(OH)2 = CaCO3 + 2NaOH
工业制烧碱的反应
2.与某些碱反应
盐的化学性质
三
盐
新盐
新碱
碱
这个原理常用作两种碱之间的相互转化。
碳酸钠与氢氧化钙反应,
生成一种难溶物碳酸钙。
要求:
(可溶)
(可溶)
(至少有一种难溶)
点石成金
葛洪是我国古代著名的炼丹家。一次,葛洪之妻鲍姑用铁勺盛“曾青”(硫酸铜溶液),几天后,葛洪发现了一个奇妙的现象:铁勺变成了“铜勺”,葛洪的徒弟高兴地跳了起来:“点石成金啦!”
CuSO4 + Fe = FeSO4 + Cu
盐
较活泼金属
新盐
新金属
“曾青得铁则为铜”
3.与某些金属反应
盐的化学性质
三
【思考】是否所有金属都可以跟CuSO4发生反应?金属与盐反应应该注意哪些方面?
在金属活动性顺序表中,只有____的金属才能把____的金属从它的__ _中置换出来,与氢的位置 __关;盐必须是___盐。
金属+盐 → 新盐+新金属
位于前面
位于后面
盐溶液
无
可溶性
不要用K、Ca、Na置换盐溶液中的金属
铁参加的置换反应生成的都是亚铁盐
Fe + CuSO4 = FeSO4 + Cu
(可溶)
小结:
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
1.快速判断下列反应是否能发生:
①Cu + AgNO3 ②Al + NaNO3
③Zn + FeSO4 ④Mg + KCl
⑤Fe + Cu(OH)2 ⑥Hg(NO3)2 + Cu
2. X 、Y、Z三种金属,其中只有Y能与盐酸反应放出氢气,X能将Z从某盐的水溶液中置换出来,X、Y、Z的金属活动性顺序依次是 。
Y X Z
练一练:
√
√
√
在医院,某病人服用硫酸钡和糖浆的混合物来检查肠胃,但是误服了碳酸钡,在胃酸的作用下会转化为有毒的氯化钡,这时,医生让病人立即服用硫酸钠进行解毒。硫酸钠为什么可以解毒?
硫酸钡是不溶于酸的白色沉淀,氯化钡与硫酸钠反应生成了沉淀,对人体就不会造成危害。
Na2SO4 + BaCl2== BaSO4 + 2NaCl
盐1
盐2
新盐1
新盐2
4.与某些盐反应
盐的化学性质
三
要求:
(可溶)
(可溶)
(至少有一种难溶)
小结:盐的化学性质
课 堂 达 标
1.下面是一些常见物质的俗称,其中错误的是( )
A.碳酸氢钠——苏打 B.碳酸钠——纯碱
C.氯化钠——食盐 D.氢氧化钙——消石灰
2.将某种固体放入稀盐酸中,有气泡产生,则这种固体肯定不是下列哪种物质( )
A.锌粒 B.纯碱 C.熟石灰 D.小苏打
A
C
3.用序号填空:① Na2CO3 ② NaCl ③ CaCO3 ④ NaHCO3
(1)用作调味品的是______;
(2)用于生产玻璃和洗涤剂的是______;
(3)用作补钙剂的是______;
(4)发酵粉的主要成分之一是______。
4.草木灰是农家肥料,它的主要成分是一种含钾的盐。取一些草木灰加到盐酸中,生成的气体可使澄清的石灰水变浑浊。
(1)由此可推断草木灰的主要成分是________ (化学式)。
(2)写出反应的化学方程式 。
②
①
③
④
K2CO3
K2CO3+2HCl = 2KCl+H2O+CO2↑
5.用石灰石、水、纯碱怎样制取烧碱?
写出有关的化学方程式:
_______________________、______________________、_________________________________。
CaCO3 CaO +CO2
高温
CaO+H2O==Ca(OH)2
Na2CO3+Ca(OH)2==CaCO3 +2NaOH
写出下列物质反应的化学方程式。
复习巩固
(1)盐酸和氢氧化钠反应
(2)实验室制取二氧化碳的反应
(3)工业制烧碱的反应
(4)硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠
(5)用盐酸除铁锈
(1)HCl+NaOH==H2O+NaCl
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
归纳总结:
(1)HCl+NaOH==H2O+NaCl
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
观察这五个反应有什么共同特点?
由两种化合物互相交换成分,生成另外两种化合物
复分解反应
概念
问题:下列反应是否属于复分解反应?
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
+
+
表达式
两交换,价不变
由两种化合物互相交换成分,生成另外两种化合物的反应。
AB + CD AD + CB
复分解反应
四
不属于
归纳总结1:
(1)HCl+NaOH==H2O+NaCl
(2)CaCO3+2HCl==CaCl2+H2O+CO2↑
(3)Na2CO3+Ca(OH)2==2NaOH+CaCO3↓
(4)Na2SO4+BaCl2==2NaCl+BaSO4↓
(5)Fe2O3+6HCl==2FeCl3+3H2O↓
复分解反应的类型
酸 + 碱 → 盐 + 水
盐 + 酸 → 新盐 + 新酸
盐 + 碱 → 新盐 + 新碱
中和反应
复分解反应的五种类型
盐1 + 盐2 → 新盐1 + 新盐2
金属氧化物 + 酸 → 盐 + 水
四种基本反应类型
化学反应类型
化合反应
分解反应
置换反应
复分解反应
多变一
一变多
单换单
双交换,价不变
A+B+C…→D
A→ B+C…
A + BC→B + AC
AB + CD→ AD+ CB
归纳总结2:
H+、Cl-
Na+、
CO3 2-
Na+、
Cl-
反应前
反应后
溶液中离子种类和数目发生改变
2HCl + Na2CO3 ——
NaCl+ + H2O
——
CO2↑
复分解反应发生时的离子变化
K2SO4 + NaNO3
×
Na+、
SO42-
K+、
NO3-
K+、
SO42-
Na2SO4 + KNO3 ——
Na+、
NO3-
溶液中离子种类和数目没发生改变
反应前
反应后
√
复分解发生反应的实质:
溶液中某些离子的数目减少了。
酸、碱、盐之间并不是都能发生复分解反应,
需要满足什么样的条件,复分解反应才能发生呢?
NaCl和H2SO4、KNO3和Na2CO3能否发生复分解反应?
思考
NaCl + H2SO4 → Na2SO4 + HCl
KNO3 + Na2CO3 → K2CO3+ NaNO3
生成物都是溶于水的化合物
生成物都是溶于水的化合物
溶液中离子种类和数目都没有发生改变
实验11-3:
复分解反应发生的条件
三、复分解反应发生的条件
实验11-3:
硫酸铜溶液
氢氧化钠溶液
硫酸铜溶液
氯化钡溶液
复分解反应发生的条件
有白色沉淀生成
有蓝色沉淀生成
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
CuSO4+BaCl2 = CuCl2+BaSO4↓
讨论:
1.上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2.前面学过的酸碱中和反应也属于复分解反应,中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到共同现象是什么?
都有水生成
属于复分解反应
都有沉淀生成
都有气体生成
P75
如果几种离子混合后,离子的种类和数目不发生变化,那么,反应也就没有发生。
在复分解反应中,能使溶液中离子数目减小的情况大致有三种:(1)在反应里有沉淀生成;
(2)在反应中有气体放出;
(3)在反应中有水生成
【准确说是有弱电解质(包括水、弱酸、弱碱等)生成】
复分解反应发生的条件:
(1)生成沉淀 (2)生成气体 (3)生成水(或弱酸、弱碱)
反应类型 反应物需要满足条件 生成物需要满足条件
酸+碱
酸+盐 碱+盐 盐+盐 金属氧化物+酸 复分解反应发生的条件
一种可溶即可
(一般是酸可溶)
盐可溶或者难溶,
酸必须可溶
反应物两者都可溶
至少具备下列三个条件中的一个
①有沉淀生成
②有气体生成
③有水(或弱酸、弱碱)生成
酸可溶
复分解发生反应的实质:
溶液中某些离子的数目减少了。
判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
2HNO3 + K2CO3——
KNO3 + NaOH——
不能
BaSO4↓+ 2NaCl
2KNO3 + CO2↑+H2O
不能
练一练
P114 附录Ⅰ 部分酸、碱、盐的溶解性表(室温)
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
酸
(1)常见的酸都可溶。
归纳总结: 酸、碱、盐的溶解性规律
【H2SiO3难溶】
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
碱
NH3﹒H2O
(1)常见的酸:都可溶。
归纳总结: 酸、碱、盐的溶解性规律
(2)常见的碱类:①只溶“钾、钠、氨、钙、钡”。
②其他的碱大多数不溶于水。
【H2SiO3难溶】
Mg(OH)2、Al(OH)3、Mn(OH)2、Fe(OH)2、Zn(OH)2:均为白色沉淀
AgOH
白色沉淀
== Ag2O + H2O
Fe(OH)3[红褐色]、Cu(OH)2[蓝色]
2
灰褐色沉淀
即KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶)、NH3﹒H2O可溶于水;
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
钾钠铵盐均易溶
硝酸盐见水影无踪
AgCl
BaSO4
在水中因发生
双水解而不存在
BaCO3
CaCO3
MnCO3
ZnCO3
FeCO3
Ag2CO3
(1)常见的酸:都可溶。
归纳总结: 酸、碱、盐的溶解性规律
(2)常见的碱类:①只溶“钾、钠、氨、钙、钡”。
②其他的碱大多数不溶于水。
【H2SiO3难溶】
Mg(OH)2、Al(OH)3、Mn(OH)2、Fe(OH)2、Zn(OH)2:均为白色沉淀
AgOH
白色沉淀
== Ag2O + H2O
Fe(OH)3[红褐色]、Cu(OH)2[蓝色]
2
灰褐色沉淀
即KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶)、NH3﹒H2O可溶于水;
(3)常见盐:
AgCl和BaSO4既不溶于水也不溶于酸
碳酸盐只溶钾、钠、铵,剩下大多不溶于水
钾盐、钠盐、铵盐、硝酸盐均易溶,
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
Ca(OH)2
CaSO4
Ag2SO4
MgCO3
(1)常见的酸:都可溶。
归纳总结: 酸、碱、盐的溶解性规律
(2)常见的碱类:只溶“钾、钠、氨、钙、钡”。
其他的碱大多数不溶于水。
【H2SiO3难溶】
Mg(OH)2、Al(OH)3、Mn(OH)2、Fe(OH)2、Zn(OH)2:均为白色沉淀
AgOH
白色沉淀
== Ag2O + H2O
Fe(OH)3[红褐色]、Cu(OH)2[蓝色]
2
灰褐色沉淀
即KOH、NaOH、Ba(OH)2、Ca(OH)2(微溶)、NH3﹒H2O可溶于水;
(3)常见盐:
AgCl和BaSO4既不溶于水也不溶于酸
碳酸盐只溶钾、钠、铵,剩下大多不溶于水
钾盐、钠盐、铵盐、硝酸盐均易溶,
(4) 四个微溶物:
Ca(OH)2、CaSO4、Ag2SO4、 MgCO3
物质溶解性口诀:
钾钠铵盐均易溶
硝酸盐见水影无踪
硫酸盐难溶铅和钡
盐酸盐不溶银、亚汞
碳酸盐只溶钾、钠、铵
可溶性的盐:钾、钠、铵盐;硝酸盐等。
BaSO4↓
PbSO4↓
AgCl↓
HgCl↓
CO32-盐:
除K2CO3
、Na2CO3
、(NH4)2CO3
其余均难溶
CaCO3、BaCO3 、Ag2CO3 、ZnCO3 、FeCO3 、CuCO3等
【SO32-盐、PO43-盐溶解性与CO32-盐相似】
酸类易溶除硅酸
碱溶钾、钠、氨、钙、钡
盐
规律总结
常见的七种沉淀
不能共存的离子对
BaSO4
BaCO3
AgCl
CaCO3
Mg(OH)2
Cu(OH)2
Fe(OH)3
白色
蓝色
红褐色
不溶于酸
能溶于酸
生成水而不共存:H+和OH-
生成气体而不共存:H+和CO32-、H+和HCO3-、NH4+和OH-
生成沉淀而不共存:CO32-和Ca2+、 Ba2+、 Mg2+、 Ag+, Ag+和Cl-、 Ba2+和SO42-
BaSO4
OH-和Mg2+、Al3+、 Zn2+、Fe2+、Fe3+ 、Cu2+、Ag+
初中常见7大沉淀
白色沉淀:碳酸钙 CaCO3
碳酸钡 BaCO3
氢氧化镁 Mg(OH)2
硫酸钡 BaSO4
氯化银 AgCl
蓝色沉淀:氢氧化铜 Cu(OH)2
红褐色沉淀:氢氧化铁 Fe(OH)3
①判断下列物质中那些属于酸,那些是碱和盐?
1. NaCl 2. NaHSO4 3.Na2SO4 4.NaHCO3
5. MgOHCl 6. Mg(OH)2 7.CaHPO 4 8.Cu2(OH)2CO3
9. HCl 10. NH4Cl 11. (NH4)2SO4
②判断下列物质是否溶于水:
Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2S Ba(OH)2 Mg(OH)2 AgNO3 Na3PO4 Ag2SO4
练一练:
↓
酸
碱
↓
↓
↓
↓
↓
微溶
练一练:
③下列物质能否发生反应 写出能发生反应的化学方程式,并注明反应类型。
(1)银与稀盐酸
(2)铜与硫酸锌溶液
(3)铝与硝酸银溶液
(4)硫酸和硝酸钠溶液
(5)氢氧化钾溶液和硝酸
(6)氯化钠溶液和硝酸银溶液
(7)碳酸钾溶液和稀硫酸
(8)硫酸铜溶液和氯化钡溶液
√
√
√
√
√
1、AgNO3 + HCl ----------
2、 K2CO3+ Ca(OH)2-----
3、NaHCO3+ H2SO4 --------
4、Na2SO4 + HCl ----------
5、H2SO4 + BaCl2--------
6、Ba(OH)2+ CuSO4 --------
7、CuSO4 + NH4NO3-----
8、HNO3 + NaOH -------
9、BaCl2+ NaOH -------
AgCl↓+HNO3
CaCO3↓+ KOH
Na2SO4+ H2O+CO2↑
不反应
BaSO4↓+ HCl
BaSO4↓+ Cu(OH)2 ↓
不反应
NaNO3 + H2O
练一练:
④下列物质间能否反应
不反应
思考:可溶于水的钡盐( Ba(NO3)2、BaCl2等)对人体有毒,但是难溶于水也难溶于酸的BaSO4,不但没有毒,而且还由于它具有不易被X射线透过的性质,可用作肠胃的内服药剂------“钡餐”。
(1)有人认为用BaCO3代替BaSO4,现请你判断,若认为可以, 说明理由。若认为不行,请你写出有关的化学方程式。
(2)若误服了BaCl2,可用于解毒的药剂是( )
A、糖水 B、硫酸钠溶液 C、食盐水 D、硫酸铜溶液
B
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
BaCO3 + 2HCl= BaCl2 + CO2↑ + H2O
不行
CaCO3+CO2+H2O=Ca(HCO3)2
原理:
Ca(HCO3)2 = CaCO3 +CO2 + H2O
石笋和钟乳石的形成
P77资料卡片
物质
混合物
单 质
纯净物
化合物
碱
盐
酸
氧化物
金属单质
非金属单质
Cu、Fe
O2、He
CaO、CO2
HCl、H2SO4
Ca(OH)2
NaCl、K2CO3
溶液、合金、混合气体(如空气)、矿石等
(只含一种物质)
(含多种物质)
(单一元素)
(多种元素)
物质的分类
五
1. CO32-或HCO3-的检验
检验试剂:
稀盐酸和澄清石灰水
检验方法:
①取样品于试管中,加入适量的稀盐酸,有气体生成;②把生成的气体通入澄清的石灰水,石灰水变浑浊,
则证明此固体含有CO32-或HCO3- 。
六、离子的检验:
①取 样
+稀盐酸
产生气体
变浑浊
+澄清石灰水
1. CO32-或HCO3-的检验
六、离子的检验:
检验试剂:
①稀盐酸和澄清石灰水
②CaCl2溶液或BaCl2溶液
操作:
②取 样
+ CaCl2溶液
产生白色沉淀
CO32-
无明显现象
HCO3-
[补充] 2.Cl-的检验方法:
操作:
现象:
结论:
注意:1)稀HNO3排除CO32-离子的干扰!
2)试剂的加入没有先后限制
试剂:
稀HNO3、AgNO3溶液
先加入稀HNO3酸化,再加入几滴AgNO3溶液。
先加入几滴AgNO3溶液,再加入稀HNO3酸化。
加入稀HNO3酸化的AgNO3溶液。
出现不溶于稀硝酸的白色沉淀AgCl。
原溶液中存在Cl-
3. SO42-的检验:
1)试剂:稀盐酸、氯化钡溶液
3)操作方法:
待测液
+稀盐酸
所得溶液
+ BaCl2溶液
产生白色沉淀,
则原溶液中含SO42-
排除CO32-、SO32-、Ag+等干扰
Na2SO4+BaCl2=BaSO4↓+2NaCl
2)原理:
BaSO4不溶于稀盐酸
问:1)为什么在加BaCl2之前,先要加几滴稀盐酸酸化?
3)能否改用稀HNO3酸化?
不能, HNO3能氧化SO32-生成SO42- ,干扰SO42-的检验
2)若先加BaCl2后加稀盐酸,产生白色沉淀,能说明含SO42-吗?
不能。 Ag+会干扰
六、离子的检验:
1、原理:
根据物质的物理性质(如颜色、状态、气味、密度等)或化学性质(生成气体↑、沉淀↓等特殊现象)
2、步骤:
(1)先对试样的外观进行观察(颜色、状态)
(2)将试样(固体)配成溶液,取出少许进行检验
(3 )选择合理的试剂(反应灵敏、现象明显)
(4)注意排除某些共有现象的干扰。
归纳总结:
A. Zn+H2SO4 ==ZnSO4+H2↑
B. 2KMnO4 ==K2MnO4+MnO2+O2↑
C. CaO+H2O==Ca(OH)2 D. CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
【例1】下列化学反应属复分解反应的是( )
典例探究
D
【例2】下列各组中的物质,能在溶液中共存的是( )
A. KNO3、NaCl、NaOH
B. KOH、Na2CO3、HCl
C. KNO3、NaOH、FeCl3
D. AgNO3、BaCl2、HNO3
A
离子(物质)共存问题:溶液中的物质相互交换成分(或溶液中的离子相互结合)后,如果会生成沉淀、水或气体,就说明它们不能共存,否则,就能共存。
1. 下列各组物质,能在PH=1.5的溶液中大量共存,且形成无色溶液的是:
A.NaCl BaCl2 Na2SO4
B.Na2CO3 NaCl Na2SO4
C.CuSO4 NaCl NaNO3
D.Na2SO4 HCl KCl
D
迁移练习
2.分别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是
NaNO3 NaCl H2SO4
CaCO3 NaOH Na2SO4
C. BaCl2 NaNO3 CuSO4
D. AgNO3 Na2SO4 NaCl
A
3、能在水中大量共存的一组离子是 ( )
A.NH4+、Na+、C1-、SO42-
B.H+、Na+、NO3-、CO32-
C.K+、Ba2+、OH-、SO42-
D.K+、Ag+、NO3-、C1-
A
4.下列各组离子间不能反应的是 ( )
A.H+ Na+ 0H- NO3-
B.Na+ K+ Cl- OH-
C.H+ K+ CO32- HCO3-
D.K+ Ba2+ Cl- SO42-
B
5.能够用来鉴别BaCl2、 NaCl 、 Na2CO3三种物质的试剂是 ( )
A.AgNO3溶液 B.稀硫酸
C.稀盐酸 D.稀硝酸
B
6.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是 ( )
①滴加Mg(NO3)2溶液;②过滤;
③滴加AgNO3溶液; ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③
C.①②③②④ D.④②③②①
B
课 堂 达 标
1.下列反应中不属于复分解反应的是( )
A. H2SO4+Ca(OH)2=CaSO4+2H2O
B. H2SO4+BaCl2=BaSO4↓+2HCl
C. 2HCl+Fe=FeCl2+H2↑
D. 2HCl+CaSO4=CaCl2+H2O+CO2 ↑
C
B
2.下列物质混合后,不能发生复分解反应的一组是( )
A.K2SO4溶液和Ba(OH)2溶液混合
B.KCl 溶液和Cu(NO3)2溶液混合
C.CuSO4溶液和NaOH溶液混合
D.CaCO3和HCl溶液
3.下列各组离子在水中一定能大量共存,并形成无色溶液的是( )
A. Cu2+、H+、SO42-、Cl- B. Ba2+、Na+、Cl-、NO3-
C. K+、Ca2+、OH-、CO32- D. Na+、H+、 CO32- 、 NO3-
4.现有Fe、CuO、MgCl2溶液、Ca(OH)2溶液、稀H2SO4五种物质,在常温下它们两两相互发生的化学反应有( )
A.7个 B.6个 C.5个 D.4个
D
B
5.下列实验中无明显现象的是( )
A.向H2SO4溶液中滴加Ba(OH)2溶液
B.向Mg(NO3)2溶液中滴加Na2SO4溶液
C.将浓硫酸加入蒸馏水中并不断搅拌
D.将(NH4)2SO4和熟石灰混合研磨
6.通过物质间相互反应可以实现物质间的相互转化,下列物质间的转化,通过一步化学反应不能实现的是( )
A.C→CO→CO2 B.Mg→MgO→MgCl2
C.CuO→Cu(OH)2→CuCl2 D.NaOH→NaCl→NaNO3
B
C
7.不用其他试剂,仅仅利用试管和胶头滴管就可以区别下列四种物质的溶液:①CuSO4;②MgCl2;③KOH;④NaNO3。则正确的鉴别顺序是( )
A.②③①④ B.①②③④ C.①③②④ D.②①③④
C
8.除去下列物质中的少量杂质(括号内为杂质),所选用的试剂和操作错误的是( )
C
9、有一包固体粉末,可能有CaCO3、Na2SO4、CuSO4、BaCl2中的一种或几种组成,做实验得到以下结果:
①将这些固体粉末加到水中,得到白色沉淀,上层清液为无色;
②该白色沉淀不溶于稀硝酸。
从实验可以判断出,该粉末中一定含有 ,
一定不含有 。
Na2SO4、BaCl2
CaCO3、CuSO4
10.下图表示物质间的转化关系(图中“→”表示某种物质转化成另一种物质)。
(1)转化①的基本反应类型是____________;
(2)向澄清石灰水中通入CO2能够实现转化②,反应的化学方程式为_______________________________;
(3)若转化③、④、⑤都是与同种物质反应生成CaCl2,则该物质是_____________.
稀盐酸(HCl)
CO2+Ca(OH)2==CaCO3↓+H2O
分解反应
1)A组发生化学变化,化学方程式为 。
实质是反应物1中的 (填粒子符号,下同)与反应物2中的______结合形成 。
2)B组发生化学变化,且B组反应物1是盐的水溶液,反应物2是碱的水溶液,则B组中反应物1是 (填名称,下同),反应物2是 ;
3)C组没有发生化学反应,原因是(微观角度解释): 。
11.将下列各组中的两种溶液混合(溶液中的原有的水分子忽略不写):
编号 反应物1 反应物2 混合后存在的粒子
A 稀盐酸(H+、Cl-) 氢氧化钾溶液(K+、OH-) K+、Cl-、H2O
B Na+、SO42-、Cu(OH)2↓
C 氯化钠溶液(Na+、Cl-) 稀硫酸(H+、SO42-) H+、SO42- 、Na+、Cl-
HCl+KOH=KCl +H2O
H+
OH-
H2O
硫酸铜溶液
氢氧化钠溶液
混合前后,溶液中的离子没有结合成新的分子
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
