化学人教版(2019)选择性必修3 3.2.1.醇(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.2.1.醇(共34张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 56.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 10:34:07 | ||
图片预览










文档简介
(共34张PPT)
第一课时 醇
第三章 烃的衍生物
第二节 醇 酚
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
醇
醇
酚
醇
OH
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
CH3
酚
①
②
③
④
⑤
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物
一、醇的结构特点、分类
1.结构特点
在烃分子中氢原子被羟基取代衍生出的含羟基的化合物中,羟基与饱和碳原子相连的化合物称为醇。官能团为羟基(—OH)。
羟基具有亲水性,低级醇都可溶于水。
①根据醇分子中羟基的个数分类
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
二元醇
CH2CH CH2
OH OHOH
丙三醇(甘油)
吸湿性,护肤
三元醇
一元醇
CH3OH
甲醇
(木精、木醇)
剧毒
用于能源领域如汽车燃料
2、醇的分类
乙二醇、丙三醇都是无色、粘稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。
工业酒精有毒!
汽车防冻剂
配制化妆品
苯甲醇
环己醇
丙烯醇
②按羟基所连烃基种类分类
可简写为 R-OH
二、饱和一元醇的命名
(2)编号:
(1)选主链:
(3)写名称
选含-OH的最长碳链为主链称某醇
从离—OH最近的一端起编号
取代基位置— 取代基名称 — 羟基位置— 母体名称
练习:写出下列醇的名称
CH3—CH—CH2—OH
CH3
①
CH3—CH2—CH—CH3
OH
②
CH3—CH—C—OH
CH3
CH2—CH3
CH3
③
练习:写出C4H10O的属于醇类所有同分异构体(不考虑空间异构)
三、 醇的同分异构体
醇类的同分异构体可有:
(1)碳链异构
(2)羟基的位置异构,
(3)相同碳原子数的饱和一元醇和醚是官能团异构
练习:写出C4H10O的所有同分异构体(不考虑空间异构)
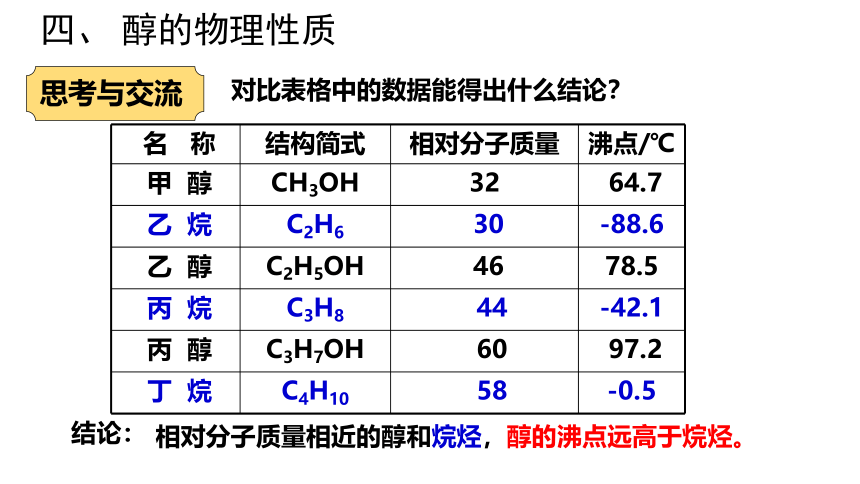
名 称 结构简式 相对分子质量 沸点/℃
甲 醇 CH3OH 32 64.7
乙 烷 C2H6 30 -88.6
乙 醇 C2H5OH 46 78.5
丙 烷 C3H8 44 -42.1
丙 醇 C3H7OH 60 97.2
丁 烷 C4H10 58 -0.5
对比表格中的数据能得出什么结论?
结论:
思考与交流
相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃。
四、 醇的物理性质
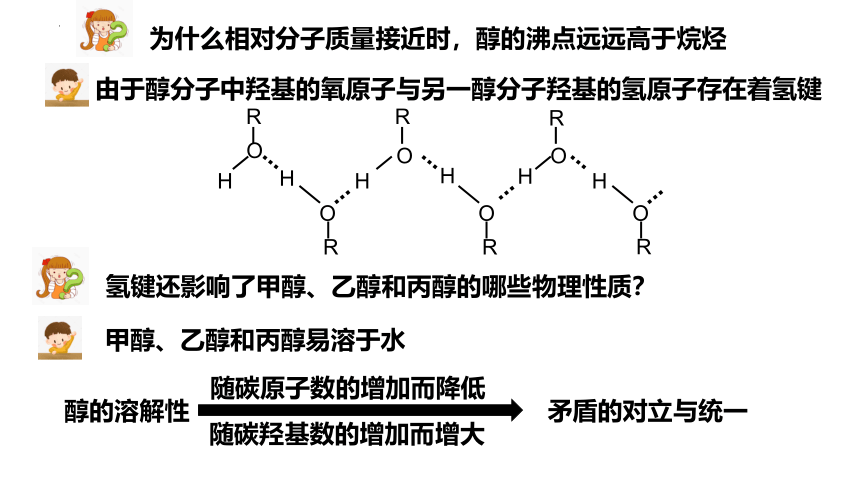
为什么相对分子质量接近时,醇的沸点远远高于烷烃
由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子存在着氢键
氢键还影响了甲醇、乙醇和丙醇的哪些物理性质?
甲醇、乙醇和丙醇易溶于水
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
随碳原子数的增加而降低
随碳羟基数的增加而增大
醇的溶解性
矛盾的对立与统一
五、醇的化学性质(以乙醇为例)
乙醇的核磁共振氢谱
1.置换反应
与活泼金属(如Na)发生置换反应,其反应方程式为
反应时乙醇分子断裂的化学键为O—H
通过与金属钠的反应可测定醇分子中羟基的个数
CH2OH
CH2OH
CH2ONa
CH2ONa
+ 2Na + H2↑
醇钠
H C C O H
H
H
H
H
(1)酯化反应:与乙酸发生反应的方程式为
2.取代反应
反应时,乙醇分子断裂的键为H—O
酯化反应的实质是:
酸脱羟基,醇脱羟基上的氢
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
反应机理:
此类反应通式:
卤原子取代了羟基,羟基和氢结合生成水
R-OH +H-X→ R-X +H2O
(2)与氢卤酸反应
醇可以与氢卤酸发生取代反应生成卤代烃和水。反应时醇分子中的C—O断裂,卤素原子取代了羟基而生成卤代烃。
乙醇与浓氢溴酸混合加热后发生取代反应,生成溴乙烷,这是制备溴乙烷的方法之一。
乙醇 溴乙烷:
CH3CH2—Br+NaOH CH3CH2—OH+NaBr
水
△
CH3CH2—OH+H—Br CH3CH2—Br+H—OH
△
溴乙烷 乙醇:
碱性条件、—X被—OH取代
酸性条件、—OH被—X取代
卤代烷
醇
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,其反应方程式为
一个脱羟基,一个脱羟基氢
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
H C C O C C H
H
H
H
H
H
H
H
H
H C C O H
H
H
H
H
醇分子中,—OH或—OH中的氢原子在一定条件下可被其他原子或原子团取代,如醇与羧酸的酯化反应、醇分子间脱水及与HX的取代反应。
醇的取代反应规律
3.消去反应(分子内脱水成烯)
乙醇在浓硫酸的作用下,加热至170℃时生成乙烯,反应方程式为
反应时乙醇分子断的键是C—H与C—O。
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
H C C O H
H
H
H
H
C=C
H
H
H
H
断键位置:
脱去 —OH 和与 —OH 相邻的碳原子上的1个H
课堂检测
写出下列醇发生消去反应的化学反应方程式
①CH3CH2CH2OH
④(CH3)3COH
②CH3CHCH2CH3
OH
③CH2OH
CH2OH
实验装置
现象 解释
实验现象
烧瓶中的液体逐渐变黑
在加热的条件下,浓硫酸能将无水乙醇脱水生成碳的单质等。
酸性高锰酸钾溶液褪色
反应生成乙烯与其发生氧化反应
溴的四氯化碳溶液褪色
反应生成乙烯与其发生加成反应
实验注意事项
(1)放入几片碎瓷片作用
(2) 浓硫酸的作用
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
防止暴沸
催化剂和脱水剂
(3)温度计的位置
(4)加药品顺序
浓硫酸缓慢加入乙醇中
(5)反应有杂质气体生成,需要除去
反应制得的乙烯中往往混有CO2、SO2等气体。其中SO2会干扰后续实验现象,可将气体通过NaOH溶液除去。
(6)温度要迅速升高并稳定在170℃
乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
CH3CH2OH
CH3CH2Br
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液
加 热
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸
加热170℃
溴乙烷与乙醇的消去反应有什么异同?
学与问
4.氧化反应
①燃烧:
C2H5OH+3O2
2CO2+3H2O(淡蓝色火焰)
实验室里也常用乙醇作为燃料,
乙醇也可用作内燃机的燃料,
②催化氧化:
③被强氧化剂氧化:
(3)与强氧化剂反应
乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
溶液由橙红色变为绿色
K2Cr2O7(H+):橙色→绿色(检验酒驾)
CH3CH2OH CH3CHO CH3COOH
KMnO4(H+):紫色→无色——直接被氧化成乙酸
若加入酸性KMnO4溶液
醇能被氧化的条件: -OH所在的碳原子上要有氢原子才可以被氧化
醇的催化氧化规律
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键。
有机化学反应中的氧化反应与还原反应
氧化反应:有机化合物分子中失去氢原子或加入氧原子的反应叫做氧化反应。(加氧或去氢)
还原反应:有机化合物分子中加入氢原子或失去氧原子的反应叫做还原反应。(加氢或去氧)
某饱和一元醇的分子式为C5H12O的同分异构体中,
能发生催化氧化的有( )种;能被氧化成醛的有( ) 种
能被酸性高锰酸钾褪色的有( )种;能被氧化成酸的有( ) 种
课堂检测
7
4
7
4
以乙醇为例 反应类型 反应物 断键位置 反应条件
置换反应 乙醇、活泼金属 ① —
取代 反应 卤代反应 乙醇、浓HX ② △
酯化反应 乙醇、羧酸 ① 浓硫酸,△
(自身)成醚反应 乙醇 一分子断①, 另一分子断② 浓硫酸,
140 ℃
消去反应 乙醇 ②⑤ 浓硫酸,
170 ℃
氧化 反应 催化氧化 乙醇、氧气 ①④或①③ 催化剂,△
燃烧反应 乙醇、氧气 全部 点燃
醇的化学性质与断键位置的规律总结
有来有往为取代,有来无往为加成,有往无来为消去,得氧失氢为氧化,得氢失氧为还原。
CH3CH2-OH
CH3CHO
CH3COOH
[O]
[O]
CH3CH2-ONa
CH3CH2-Br
CH2=CH2
CH3CH2-O-CH2CH3
乙醇的化学性质小结
Na
H2O
HBr
NaOH水溶液
浓H2SO4
170℃
浓H2SO4
140℃
CH3C-O-CH2CH3
O
第一课时 醇
第三章 烃的衍生物
第二节 醇 酚
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
醇
醇
酚
醇
OH
CH3CH2OH
CH3CHCH3
OH
CH2OH
OH
CH3
酚
①
②
③
④
⑤
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物
一、醇的结构特点、分类
1.结构特点
在烃分子中氢原子被羟基取代衍生出的含羟基的化合物中,羟基与饱和碳原子相连的化合物称为醇。官能团为羟基(—OH)。
羟基具有亲水性,低级醇都可溶于水。
①根据醇分子中羟基的个数分类
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
二元醇
CH2CH CH2
OH OHOH
丙三醇(甘油)
吸湿性,护肤
三元醇
一元醇
CH3OH
甲醇
(木精、木醇)
剧毒
用于能源领域如汽车燃料
2、醇的分类
乙二醇、丙三醇都是无色、粘稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。乙二醇可用于汽车作防冻剂,丙三醇可用于配制化妆品。
工业酒精有毒!
汽车防冻剂
配制化妆品
苯甲醇
环己醇
丙烯醇
②按羟基所连烃基种类分类
可简写为 R-OH
二、饱和一元醇的命名
(2)编号:
(1)选主链:
(3)写名称
选含-OH的最长碳链为主链称某醇
从离—OH最近的一端起编号
取代基位置— 取代基名称 — 羟基位置— 母体名称
练习:写出下列醇的名称
CH3—CH—CH2—OH
CH3
①
CH3—CH2—CH—CH3
OH
②
CH3—CH—C—OH
CH3
CH2—CH3
CH3
③
练习:写出C4H10O的属于醇类所有同分异构体(不考虑空间异构)
三、 醇的同分异构体
醇类的同分异构体可有:
(1)碳链异构
(2)羟基的位置异构,
(3)相同碳原子数的饱和一元醇和醚是官能团异构
练习:写出C4H10O的所有同分异构体(不考虑空间异构)
名 称 结构简式 相对分子质量 沸点/℃
甲 醇 CH3OH 32 64.7
乙 烷 C2H6 30 -88.6
乙 醇 C2H5OH 46 78.5
丙 烷 C3H8 44 -42.1
丙 醇 C3H7OH 60 97.2
丁 烷 C4H10 58 -0.5
对比表格中的数据能得出什么结论?
结论:
思考与交流
相对分子质量相近的醇和烷烃,醇的沸点远高于烷烃。
四、 醇的物理性质
为什么相对分子质量接近时,醇的沸点远远高于烷烃
由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子存在着氢键
氢键还影响了甲醇、乙醇和丙醇的哪些物理性质?
甲醇、乙醇和丙醇易溶于水
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
随碳原子数的增加而降低
随碳羟基数的增加而增大
醇的溶解性
矛盾的对立与统一
五、醇的化学性质(以乙醇为例)
乙醇的核磁共振氢谱
1.置换反应
与活泼金属(如Na)发生置换反应,其反应方程式为
反应时乙醇分子断裂的化学键为O—H
通过与金属钠的反应可测定醇分子中羟基的个数
CH2OH
CH2OH
CH2ONa
CH2ONa
+ 2Na + H2↑
醇钠
H C C O H
H
H
H
H
(1)酯化反应:与乙酸发生反应的方程式为
2.取代反应
反应时,乙醇分子断裂的键为H—O
酯化反应的实质是:
酸脱羟基,醇脱羟基上的氢
CH3 CH2 OH+H Br CH3 CH2 Br+H2O
△
油状液体
乙醇与浓氢溴酸混合加热发生反应生成溴乙烷
反应机理:
此类反应通式:
卤原子取代了羟基,羟基和氢结合生成水
R-OH +H-X→ R-X +H2O
(2)与氢卤酸反应
醇可以与氢卤酸发生取代反应生成卤代烃和水。反应时醇分子中的C—O断裂,卤素原子取代了羟基而生成卤代烃。
乙醇与浓氢溴酸混合加热后发生取代反应,生成溴乙烷,这是制备溴乙烷的方法之一。
乙醇 溴乙烷:
CH3CH2—Br+NaOH CH3CH2—OH+NaBr
水
△
CH3CH2—OH+H—Br CH3CH2—Br+H—OH
△
溴乙烷 乙醇:
碱性条件、—X被—OH取代
酸性条件、—OH被—X取代
卤代烷
醇
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,其反应方程式为
一个脱羟基,一个脱羟基氢
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
H C C O C C H
H
H
H
H
H
H
H
H
H C C O H
H
H
H
H
醇分子中,—OH或—OH中的氢原子在一定条件下可被其他原子或原子团取代,如醇与羧酸的酯化反应、醇分子间脱水及与HX的取代反应。
醇的取代反应规律
3.消去反应(分子内脱水成烯)
乙醇在浓硫酸的作用下,加热至170℃时生成乙烯,反应方程式为
反应时乙醇分子断的键是C—H与C—O。
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
H C C O H
H
H
H
H
C=C
H
H
H
H
断键位置:
脱去 —OH 和与 —OH 相邻的碳原子上的1个H
课堂检测
写出下列醇发生消去反应的化学反应方程式
①CH3CH2CH2OH
④(CH3)3COH
②CH3CHCH2CH3
OH
③CH2OH
CH2OH
实验装置
现象 解释
实验现象
烧瓶中的液体逐渐变黑
在加热的条件下,浓硫酸能将无水乙醇脱水生成碳的单质等。
酸性高锰酸钾溶液褪色
反应生成乙烯与其发生氧化反应
溴的四氯化碳溶液褪色
反应生成乙烯与其发生加成反应
实验注意事项
(1)放入几片碎瓷片作用
(2) 浓硫酸的作用
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
防止暴沸
催化剂和脱水剂
(3)温度计的位置
(4)加药品顺序
浓硫酸缓慢加入乙醇中
(5)反应有杂质气体生成,需要除去
反应制得的乙烯中往往混有CO2、SO2等气体。其中SO2会干扰后续实验现象,可将气体通过NaOH溶液除去。
(6)温度要迅速升高并稳定在170℃
乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
CH3CH2OH
CH3CH2Br
反应条件
化学键的断裂
化学键的生成
反应产物
NaOH的乙醇溶液
加 热
C—Br、C—H
C—O、C—H
C=C
C=C
CH2=CH2、HBr
CH2=CH2、H2O
浓硫酸
加热170℃
溴乙烷与乙醇的消去反应有什么异同?
学与问
4.氧化反应
①燃烧:
C2H5OH+3O2
2CO2+3H2O(淡蓝色火焰)
实验室里也常用乙醇作为燃料,
乙醇也可用作内燃机的燃料,
②催化氧化:
③被强氧化剂氧化:
(3)与强氧化剂反应
乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
溶液由橙红色变为绿色
K2Cr2O7(H+):橙色→绿色(检验酒驾)
CH3CH2OH CH3CHO CH3COOH
KMnO4(H+):紫色→无色——直接被氧化成乙酸
若加入酸性KMnO4溶液
醇能被氧化的条件: -OH所在的碳原子上要有氢原子才可以被氧化
醇的催化氧化规律
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键。
有机化学反应中的氧化反应与还原反应
氧化反应:有机化合物分子中失去氢原子或加入氧原子的反应叫做氧化反应。(加氧或去氢)
还原反应:有机化合物分子中加入氢原子或失去氧原子的反应叫做还原反应。(加氢或去氧)
某饱和一元醇的分子式为C5H12O的同分异构体中,
能发生催化氧化的有( )种;能被氧化成醛的有( ) 种
能被酸性高锰酸钾褪色的有( )种;能被氧化成酸的有( ) 种
课堂检测
7
4
7
4
以乙醇为例 反应类型 反应物 断键位置 反应条件
置换反应 乙醇、活泼金属 ① —
取代 反应 卤代反应 乙醇、浓HX ② △
酯化反应 乙醇、羧酸 ① 浓硫酸,△
(自身)成醚反应 乙醇 一分子断①, 另一分子断② 浓硫酸,
140 ℃
消去反应 乙醇 ②⑤ 浓硫酸,
170 ℃
氧化 反应 催化氧化 乙醇、氧气 ①④或①③ 催化剂,△
燃烧反应 乙醇、氧气 全部 点燃
醇的化学性质与断键位置的规律总结
有来有往为取代,有来无往为加成,有往无来为消去,得氧失氢为氧化,得氢失氧为还原。
CH3CH2-OH
CH3CHO
CH3COOH
[O]
[O]
CH3CH2-ONa
CH3CH2-Br
CH2=CH2
CH3CH2-O-CH2CH3
乙醇的化学性质小结
Na
H2O
HBr
NaOH水溶液
浓H2SO4
170℃
浓H2SO4
140℃
CH3C-O-CH2CH3
O
