重庆市九龙坡区2022-2023学年高一上学期期末教育质量全面监测考试化学试题(含答案)
文档属性
| 名称 | 重庆市九龙坡区2022-2023学年高一上学期期末教育质量全面监测考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 810.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 10:49:08 | ||
图片预览




文档简介
【机密】
九龙坡区2022-2023学年高一上学期期末教育质量全面监测考试
化学试题
满分:100分 考试时间:75分钟
注意事项:
1.作答前,考生务必将自己的姓名、班级、考号填写在试卷的规定位置上。
2.作答时,务必将答案写在答题卡上。写在试卷及草稿纸上无效。
3.考试结束后,只交答题卡。
可能用到的相对原子质量:
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符合题意)
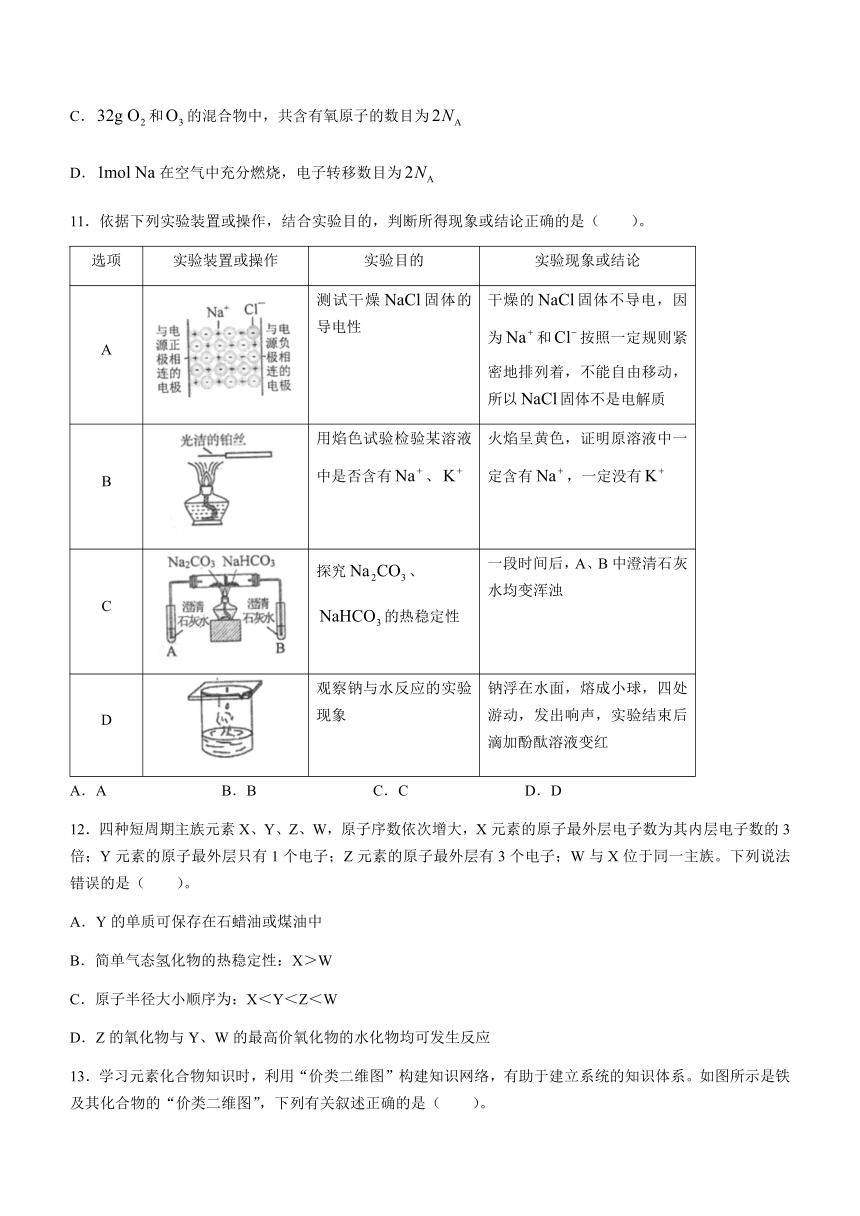
1.据《管子》载:“暮春之初,北海之民即煮海为盐。”文中涉及的操作原理与下列实验操作相似的是( )。
A.B.C.D.
2.2022年重庆遭遇了50年不遇的特大干旱,气象局进行了增雨抗旱工作。催雨剂的主要成分是干冰、液氮、碘化银。下列说法错误的是( )。
A.干冰是酸性氧化物 B.液氮属于混合物
C.碘化银属于是盐 D.水蒸气变为小雨滴的过程属于物理变化
3.下列各物质中,互为同素异形体的是( )。
A.、 B.、
C.、 D.石墨、
4.下列物质的应用与氧化还原反应有关的是( )。
A.煅烧石灰石制生石灰 B.铁粉可以用作食品袋内的脱氧剂
C.小苏打用作面点的膨松剂 D.“冰丝带“场馆用二氧化碳跨临界技术直冷制冰
5.下列离子方程式书写正确的是( )。
A.将金属钠投入水中:
B.向溶液中通入过量:
C.向碳酸镁浊液中加入足量稀盐酸:
D.硫酸和氢氧化钡溶液混合:
6.下列物质均可用于漂白,漂白原理不同于其它物质的是( )。
A.活性炭 B.次氯酸钠 C.氯水 D.漂白粉
7.常温下,下列各组离子能大量共存的是( )。
A.、、、 B.、、、
C.、、、 D.、、、
8.下列物质中,含有极性共价键的是( )。
A. B. C. D.
9.化学源自生活和生产实践,下列有关说法错误的是( )。
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.我国短道速滑队所用冰刀材料是特殊的钢材料,该合金熔点比纯铁高
C.北京冬奥会使用的“飞扬”火炬采用了氢燃料,体现了“绿色低碳”的发展理念
D.胶体金可用于快速检测新型冠状病毒抗原,其分散质粒子直径在之间
10.设为阿伏加德罗常数的值,下列叙述正确的是( )。
A.溶液中含有的数目为
B.标准状况下,中含有的质子总数为
C.和的混合物中,共含有氧原子的数目为
D.在空气中充分燃烧,电子转移数目为
11.依据下列实验装置或操作,结合实验目的,判断所得现象或结论正确的是( )。
选项 实验装置或操作 实验目的 实验现象或结论
A 测试干燥固体的导电性 干燥的固体不导电,因为和按照一定规则紧密地排列着,不能自由移动,所以固体不是电解质
B 用焰色试验检验某溶液中是否含有、 火焰呈黄色,证明原溶液中一定含有,一定没有
C 探究、的热稳定性 一段时间后,A、B中澄清石灰水均变浑浊
D 观察钠与水反应的实验现象 钠浮在水面,熔成小球,四处游动,发出响声,实验结束后滴加酚酞溶液变红
A.A B.B C.C D.D
12.四种短周期主族元素X、Y、Z、W,原子序数依次增大,X元素的原子最外层电子数为其内层电子数的3倍;Y元素的原子最外层只有1个电子;Z元素的原子最外层有3个电子;W与X位于同一主族。下列说法错误的是( )。
A.Y的单质可保存在石蜡油或煤油中
B.简单气态氢化物的热稳定性:X>W
C.原子半径大小顺序为:X<Y<Z<W
D.Z的氧化物与Y、W的最高价氧化物的水化物均可发生反应
13.学习元素化合物知识时,利用“价类二维图”构建知识网络,有助于建立系统的知识体系。如图所示是铁及其化合物的“价类二维图”,下列有关叙述正确的是( )。
A.A和水蒸气反应可得到B
B.D受热分解能生成B
C.A中加入足量的溶液可得到E
D.向F的水溶液中滴加酸性高锰酸钾溶液可以转化成G溶液
14.二氧化氯在工业上可用于淀粉及油脂的漂白及自来水的消毒,制备有以下两种方法。
方法1:60℃时,用潮湿的氯酸钠与草酸反应,反应原理为:
方法2:亚氯酸钠和稀盐酸反应,反应原理为:
下列说法正确的是( )。
A.方法1中失去电子
B.方法1中每生成标准状况下气体,转移个电子
C.方法2中是氧化剂,是还原剂
D.方法2中氧化产物和还原产物的物质的量之比为
二、填空题(本题包括4个小题,共58分)
15.(15分)化学源自生活和生产实践,并随着人类社会的进步而不断发展。根据所学知识,回答下列问题:
(1)分类是认识和研究物质及其变化的一种常用的科学方法,下图所示分类方法是__________(选填“树状分类法”或“交叉分类法”)。
(2)下列物质:①液氯 ②盐酸 ③ ④硝酸钾固体 ⑤熔融 ⑥铜,其中属于电解质的是__________(填序号,后同),能导电的是__________,④的电离方程式为__________。
(3)所含化学键的类型__________。
(4)氢化钠可在野外用作生氢剂,其原理为,该反应的还原剂是__________(填化学式),生成转移的电子数目为__________。
(5)碳酸钠是一种重要的化工基本原料,俗称__________,向碳酸钠溶液中滴加少量稀盐酸,会生成和__________(填化学式)。除去碳酸钠粉末中混有的少量碳酸氢钠,最好的方法是__________。
(6)向一定体积的溶液中逐滴加入稀硫酸至过量,混合溶液导电能力的变化如下图中__________(填字母)所示。
(7)把镁铝合金的粉末放入过量的盐酸中,充分反应后得到(标准状况),该合金中铝和镁的物质的量之比为__________。
16.(15分)下表列出了9种元素在周期中的位置。
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 C O
3
4 K
5 I
请完成下列填空:
(1)氯原子的结构示意图为__________。
(2)的电子式为__________,的结构式为__________。
(3)碳元素有多种核素,如、、,考古时利用可测定一些文物的年代。的中子数为_________,这些核素互称为__________。
(4)9种元素中,金属性最强的是__________(填元素符号),最高价氧化物的水化物酸性最强的是__________(填化学式)。
(5)、、的离子半径由大到小的顺序是__________(用离子符号表示)。
(6)铝单质与钠元素最高价氧化物的水化物反应的离子方程式为__________。
(7)碘元素是人体必需的微量元素之--。下列关于碘及其化合物说法正确的是______(填字母序号)。
A.单质的氧化性:
B.的热稳定性比强
C.在一定条件下可与溶液反应
D.取少量碘盐(含)于试管中,加水溶解,滴加几滴淀粉溶液,溶液变蓝
(8)氯化碘的化学性质和卤素单质很相似,它能与大多数金属、非金属反应,也能与水反应。与水反应反应的化学方程式为__________。
17.(14分)已知A为淡黄色固体,C是无色无味的气体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,M为黄绿色气体,J具有漂白性。各物质间的转化关系如下图所示(部分物质已省略)。
请完成下列填空。
(1)D和E的化学式为:D__________,E__________。
(2)A在生活中用途广泛,请写出其中一种用途__________,A中阴阳离子个数比为__________。
(3)A与水反应的化学方程式为__________。
(4)F转化为G的现象为__________。
(5)检验E溶液中金属阳离子的试剂是__________。
(6)高铁酸钠是一种高效多功能的新型非氯绿色消毒剂,主要用于饮用水的处理,可由J、G和B反应制得。
①该反应的化学方程式为__________。
②高铁酸钠溶液杀灭病菌后可以得到氢氧化铁胶体,进而起到净水作用。下列关于氢氧化铁胶体的说法正确的是______(填字母)。
A.在饱和溶液中滴加浓的溶液可制得胶体
B.胶体具有丁达尔效应
C.溶液、胶体都属于混合物
D.完全转化为胶体后,含有的胶体粒子数目为
18.(14分)疫情防控中,含氯消毒剂发挥了重要作用。含氯消毒剂有多种,如、、、、。某化学兴趣小组利用溶液来制备含氯消毒剂。
Ⅰ.配制一定物质的量浓度的溶液
(1)配制溶液,需用托盘天平称取______固体。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是__________。
(3)若向容量瓶加水定容时眼睛仰视液面,会造成所配溶液浓度__________(“偏高”、“偏低”或“不变”)。
Ⅱ.制备“84”消毒液
(1)仪器A的名称为__________。
(2)装置①中二氧化锰和浓盐酸反应制取氯气的化学方程式为__________。
(3)装置②中盛装的试剂为__________,用于除去中的杂质。
(4)装置③中制得“84”消毒液,其有效成分是__________(填化学式)。
(5)清洗卫生间时,“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,用离子方程式解释其原因为__________。_
(6)含氯消毒剂中有效氯含量,能反映含氯消毒剂消毒能力的大小,其定义是每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。则的有效氯含量为__________(保留小数点后两位)。
九龙坡区2022-2023学年高一上学期期末教育质量全面监测考试
化学参考答案
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14个小题,每小题3分,共42分)
题号 1 2 3 4 5 6 7
答案 C B D B C A C
题号 8 9 10 11 12 13 14
答案 D B C D C B D
第Ⅱ卷(非选择题,共58分)
二、填空题(本题包括4个小题,共58分)
15.(15分)
(1)交叉分类法(1分)
(2)④⑤(1分) ②⑤⑥(1分) (1分)
(3)离子键、(极性)共价键(2分)
(4)(1分) 或(1分)
(5)纯碱或苏打(1分) (1分) 加热(1分)
(6)C(2分)
(7)(2分)
16.(15分)
(1)(1分)
(2)(1分) (1分)
(3)8(1分) 同位素(1分)
(4)K(1分) (1分)
(5)(2分)
(6)(2分)
(7)AC(2分)
(8)(2分)
17.(14分)
(1)(1分) (1分)
(2)供氧剂、强氧化剂、漂白剂、消毒剂等(任答一点,合理即可)(1分) (1分)
(3)(2分)
(4)白色沉淀迅速变为灰绿色,最终变为红褐色。(2分)
(5)溶液和氯水(或溶液等合理答案)(2分)
(6)①(2分)
②BC(2分)
18.(14分)
Ⅰ.(1)10.0(2分)
(2)容量瓶、胶头滴管(2分)
(3)偏低(1分)
Ⅱ.(1)分液漏斗(1分)
(2)(浓)(2分)
(3)饱和溶液(1分)
(4)(1分)
(5)(2分)
(6)0.95(2分)
九龙坡区2022-2023学年高一上学期期末教育质量全面监测考试
化学试题
满分:100分 考试时间:75分钟
注意事项:
1.作答前,考生务必将自己的姓名、班级、考号填写在试卷的规定位置上。
2.作答时,务必将答案写在答题卡上。写在试卷及草稿纸上无效。
3.考试结束后,只交答题卡。
可能用到的相对原子质量:
一、选择题(本题包括14个小题,每小题3分,共42分,每小题只有一个选项符合题意)
1.据《管子》载:“暮春之初,北海之民即煮海为盐。”文中涉及的操作原理与下列实验操作相似的是( )。
A.B.C.D.
2.2022年重庆遭遇了50年不遇的特大干旱,气象局进行了增雨抗旱工作。催雨剂的主要成分是干冰、液氮、碘化银。下列说法错误的是( )。
A.干冰是酸性氧化物 B.液氮属于混合物
C.碘化银属于是盐 D.水蒸气变为小雨滴的过程属于物理变化
3.下列各物质中,互为同素异形体的是( )。
A.、 B.、
C.、 D.石墨、
4.下列物质的应用与氧化还原反应有关的是( )。
A.煅烧石灰石制生石灰 B.铁粉可以用作食品袋内的脱氧剂
C.小苏打用作面点的膨松剂 D.“冰丝带“场馆用二氧化碳跨临界技术直冷制冰
5.下列离子方程式书写正确的是( )。
A.将金属钠投入水中:
B.向溶液中通入过量:
C.向碳酸镁浊液中加入足量稀盐酸:
D.硫酸和氢氧化钡溶液混合:
6.下列物质均可用于漂白,漂白原理不同于其它物质的是( )。
A.活性炭 B.次氯酸钠 C.氯水 D.漂白粉
7.常温下,下列各组离子能大量共存的是( )。
A.、、、 B.、、、
C.、、、 D.、、、
8.下列物质中,含有极性共价键的是( )。
A. B. C. D.
9.化学源自生活和生产实践,下列有关说法错误的是( )。
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.我国短道速滑队所用冰刀材料是特殊的钢材料,该合金熔点比纯铁高
C.北京冬奥会使用的“飞扬”火炬采用了氢燃料,体现了“绿色低碳”的发展理念
D.胶体金可用于快速检测新型冠状病毒抗原,其分散质粒子直径在之间
10.设为阿伏加德罗常数的值,下列叙述正确的是( )。
A.溶液中含有的数目为
B.标准状况下,中含有的质子总数为
C.和的混合物中,共含有氧原子的数目为
D.在空气中充分燃烧,电子转移数目为
11.依据下列实验装置或操作,结合实验目的,判断所得现象或结论正确的是( )。
选项 实验装置或操作 实验目的 实验现象或结论
A 测试干燥固体的导电性 干燥的固体不导电,因为和按照一定规则紧密地排列着,不能自由移动,所以固体不是电解质
B 用焰色试验检验某溶液中是否含有、 火焰呈黄色,证明原溶液中一定含有,一定没有
C 探究、的热稳定性 一段时间后,A、B中澄清石灰水均变浑浊
D 观察钠与水反应的实验现象 钠浮在水面,熔成小球,四处游动,发出响声,实验结束后滴加酚酞溶液变红
A.A B.B C.C D.D
12.四种短周期主族元素X、Y、Z、W,原子序数依次增大,X元素的原子最外层电子数为其内层电子数的3倍;Y元素的原子最外层只有1个电子;Z元素的原子最外层有3个电子;W与X位于同一主族。下列说法错误的是( )。
A.Y的单质可保存在石蜡油或煤油中
B.简单气态氢化物的热稳定性:X>W
C.原子半径大小顺序为:X<Y<Z<W
D.Z的氧化物与Y、W的最高价氧化物的水化物均可发生反应
13.学习元素化合物知识时,利用“价类二维图”构建知识网络,有助于建立系统的知识体系。如图所示是铁及其化合物的“价类二维图”,下列有关叙述正确的是( )。
A.A和水蒸气反应可得到B
B.D受热分解能生成B
C.A中加入足量的溶液可得到E
D.向F的水溶液中滴加酸性高锰酸钾溶液可以转化成G溶液
14.二氧化氯在工业上可用于淀粉及油脂的漂白及自来水的消毒,制备有以下两种方法。
方法1:60℃时,用潮湿的氯酸钠与草酸反应,反应原理为:
方法2:亚氯酸钠和稀盐酸反应,反应原理为:
下列说法正确的是( )。
A.方法1中失去电子
B.方法1中每生成标准状况下气体,转移个电子
C.方法2中是氧化剂,是还原剂
D.方法2中氧化产物和还原产物的物质的量之比为
二、填空题(本题包括4个小题,共58分)
15.(15分)化学源自生活和生产实践,并随着人类社会的进步而不断发展。根据所学知识,回答下列问题:
(1)分类是认识和研究物质及其变化的一种常用的科学方法,下图所示分类方法是__________(选填“树状分类法”或“交叉分类法”)。
(2)下列物质:①液氯 ②盐酸 ③ ④硝酸钾固体 ⑤熔融 ⑥铜,其中属于电解质的是__________(填序号,后同),能导电的是__________,④的电离方程式为__________。
(3)所含化学键的类型__________。
(4)氢化钠可在野外用作生氢剂,其原理为,该反应的还原剂是__________(填化学式),生成转移的电子数目为__________。
(5)碳酸钠是一种重要的化工基本原料,俗称__________,向碳酸钠溶液中滴加少量稀盐酸,会生成和__________(填化学式)。除去碳酸钠粉末中混有的少量碳酸氢钠,最好的方法是__________。
(6)向一定体积的溶液中逐滴加入稀硫酸至过量,混合溶液导电能力的变化如下图中__________(填字母)所示。
(7)把镁铝合金的粉末放入过量的盐酸中,充分反应后得到(标准状况),该合金中铝和镁的物质的量之比为__________。
16.(15分)下表列出了9种元素在周期中的位置。
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 C O
3
4 K
5 I
请完成下列填空:
(1)氯原子的结构示意图为__________。
(2)的电子式为__________,的结构式为__________。
(3)碳元素有多种核素,如、、,考古时利用可测定一些文物的年代。的中子数为_________,这些核素互称为__________。
(4)9种元素中,金属性最强的是__________(填元素符号),最高价氧化物的水化物酸性最强的是__________(填化学式)。
(5)、、的离子半径由大到小的顺序是__________(用离子符号表示)。
(6)铝单质与钠元素最高价氧化物的水化物反应的离子方程式为__________。
(7)碘元素是人体必需的微量元素之--。下列关于碘及其化合物说法正确的是______(填字母序号)。
A.单质的氧化性:
B.的热稳定性比强
C.在一定条件下可与溶液反应
D.取少量碘盐(含)于试管中,加水溶解,滴加几滴淀粉溶液,溶液变蓝
(8)氯化碘的化学性质和卤素单质很相似,它能与大多数金属、非金属反应,也能与水反应。与水反应反应的化学方程式为__________。
17.(14分)已知A为淡黄色固体,C是无色无味的气体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,M为黄绿色气体,J具有漂白性。各物质间的转化关系如下图所示(部分物质已省略)。
请完成下列填空。
(1)D和E的化学式为:D__________,E__________。
(2)A在生活中用途广泛,请写出其中一种用途__________,A中阴阳离子个数比为__________。
(3)A与水反应的化学方程式为__________。
(4)F转化为G的现象为__________。
(5)检验E溶液中金属阳离子的试剂是__________。
(6)高铁酸钠是一种高效多功能的新型非氯绿色消毒剂,主要用于饮用水的处理,可由J、G和B反应制得。
①该反应的化学方程式为__________。
②高铁酸钠溶液杀灭病菌后可以得到氢氧化铁胶体,进而起到净水作用。下列关于氢氧化铁胶体的说法正确的是______(填字母)。
A.在饱和溶液中滴加浓的溶液可制得胶体
B.胶体具有丁达尔效应
C.溶液、胶体都属于混合物
D.完全转化为胶体后,含有的胶体粒子数目为
18.(14分)疫情防控中,含氯消毒剂发挥了重要作用。含氯消毒剂有多种,如、、、、。某化学兴趣小组利用溶液来制备含氯消毒剂。
Ⅰ.配制一定物质的量浓度的溶液
(1)配制溶液,需用托盘天平称取______固体。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是__________。
(3)若向容量瓶加水定容时眼睛仰视液面,会造成所配溶液浓度__________(“偏高”、“偏低”或“不变”)。
Ⅱ.制备“84”消毒液
(1)仪器A的名称为__________。
(2)装置①中二氧化锰和浓盐酸反应制取氯气的化学方程式为__________。
(3)装置②中盛装的试剂为__________,用于除去中的杂质。
(4)装置③中制得“84”消毒液,其有效成分是__________(填化学式)。
(5)清洗卫生间时,“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,用离子方程式解释其原因为__________。_
(6)含氯消毒剂中有效氯含量,能反映含氯消毒剂消毒能力的大小,其定义是每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。则的有效氯含量为__________(保留小数点后两位)。
九龙坡区2022-2023学年高一上学期期末教育质量全面监测考试
化学参考答案
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14个小题,每小题3分,共42分)
题号 1 2 3 4 5 6 7
答案 C B D B C A C
题号 8 9 10 11 12 13 14
答案 D B C D C B D
第Ⅱ卷(非选择题,共58分)
二、填空题(本题包括4个小题,共58分)
15.(15分)
(1)交叉分类法(1分)
(2)④⑤(1分) ②⑤⑥(1分) (1分)
(3)离子键、(极性)共价键(2分)
(4)(1分) 或(1分)
(5)纯碱或苏打(1分) (1分) 加热(1分)
(6)C(2分)
(7)(2分)
16.(15分)
(1)(1分)
(2)(1分) (1分)
(3)8(1分) 同位素(1分)
(4)K(1分) (1分)
(5)(2分)
(6)(2分)
(7)AC(2分)
(8)(2分)
17.(14分)
(1)(1分) (1分)
(2)供氧剂、强氧化剂、漂白剂、消毒剂等(任答一点,合理即可)(1分) (1分)
(3)(2分)
(4)白色沉淀迅速变为灰绿色,最终变为红褐色。(2分)
(5)溶液和氯水(或溶液等合理答案)(2分)
(6)①(2分)
②BC(2分)
18.(14分)
Ⅰ.(1)10.0(2分)
(2)容量瓶、胶头滴管(2分)
(3)偏低(1分)
Ⅱ.(1)分液漏斗(1分)
(2)(浓)(2分)
(3)饱和溶液(1分)
(4)(1分)
(5)(2分)
(6)0.95(2分)
同课章节目录
