化学人教版(2019)必修第一册2.1钠及其重要的化合物(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1钠及其重要的化合物(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 508.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-02-20 14:52:35 | ||
图片预览



文档简介
(共24张PPT)
练习1、将l00ml 1mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO32-)的变化分别是( )
A.减小、减小 B.减小、增大
C.增大、增大 D.增大、减小
B
第三章金属及其重要的化合物
第一节 钠及其重要化合物3
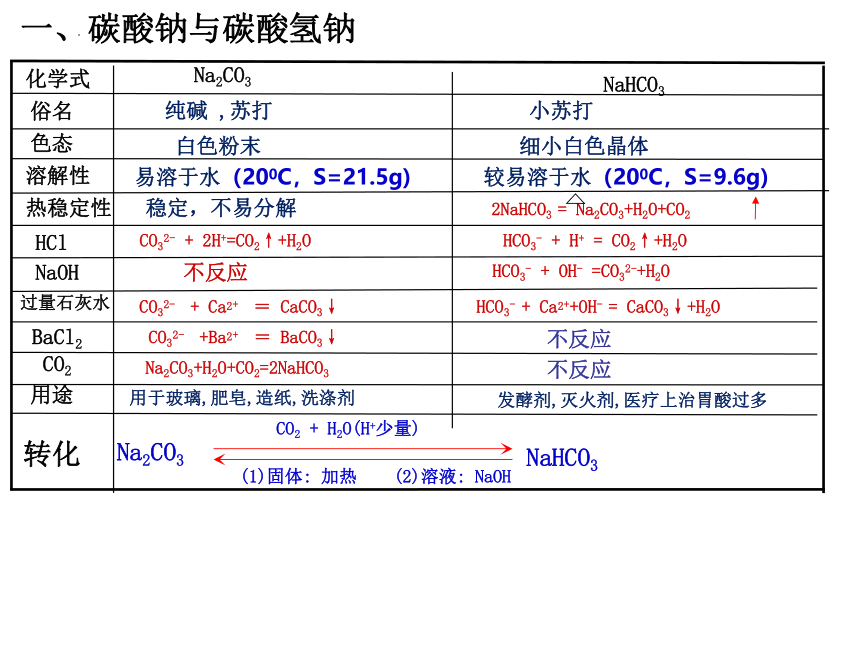
HCO3- + Ca2++OH- = CaCO3↓+H2O
HCO3- + OH- =CO32-+H2O
较易溶于水(200C,S=9.6g)
2NaHCO3 = Na2CO3+H2O+CO2
发酵剂,灭火剂,医疗上治胃酸过多
用于玻璃,肥皂,造纸,洗涤剂
不反应
Na2CO3+H2O+CO2=2NaHCO3
不反应
CO32- +Ba2+ = BaCO3↓
CO32- + Ca2+ = CaCO3↓
不反应
HCO3- + H+ = CO2↑+H2O
CO32- + 2H+=CO2↑+H2O
稳定,不易分解
易溶于水(200C,S=21.5g)
细小白色晶体
白色粉末
小苏打
纯碱 ,苏打
转化
用途
CO2
BaCl2
过量石灰水
NaOH
HCl
热稳定性
溶解性
色态
俗名
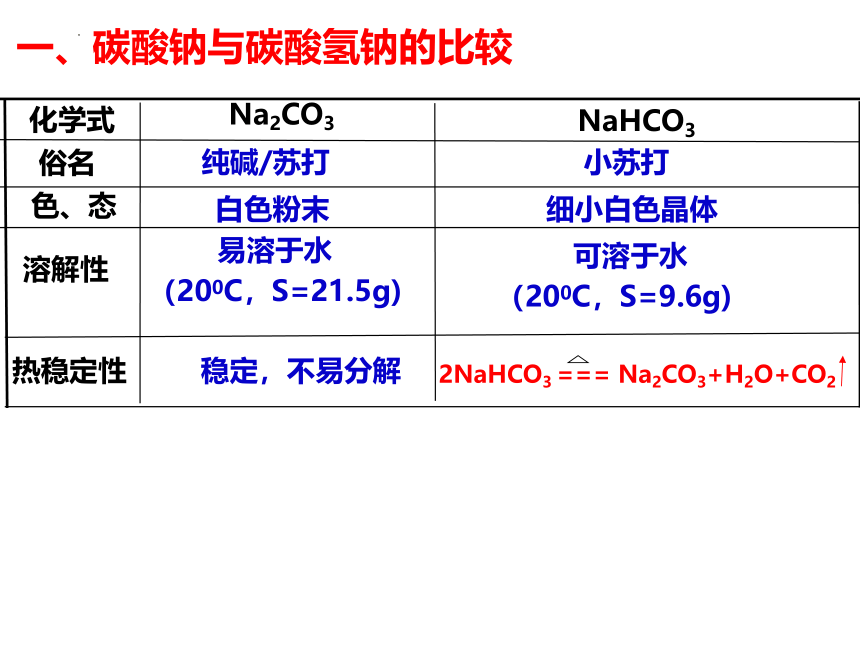
化学式
NaHCO3
Na2CO3
一、碳酸钠与碳酸氢钠
Na2CO3
NaHCO3
CO2 + H2O(H+少量)
(1)固体: 加热 (2)溶液: NaOH
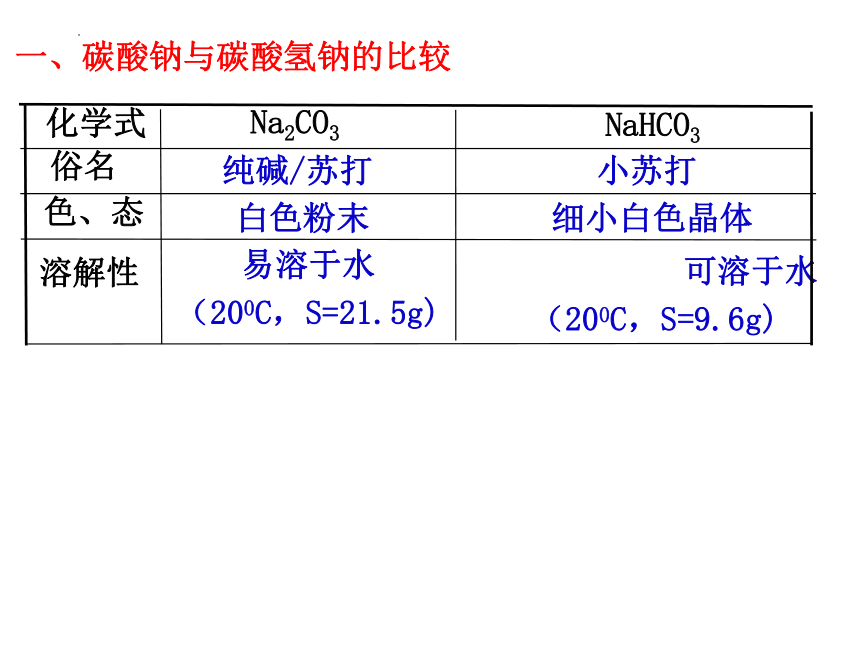
可溶于水
(200C,S=9.6g)
易溶于水
(200C,S=21.5g)
细小白色晶体
白色粉末
小苏打
纯碱/苏打
溶解性
色、态
俗名
化学式
NaHCO3
Na2CO3
一、碳酸钠与碳酸氢钠的比较
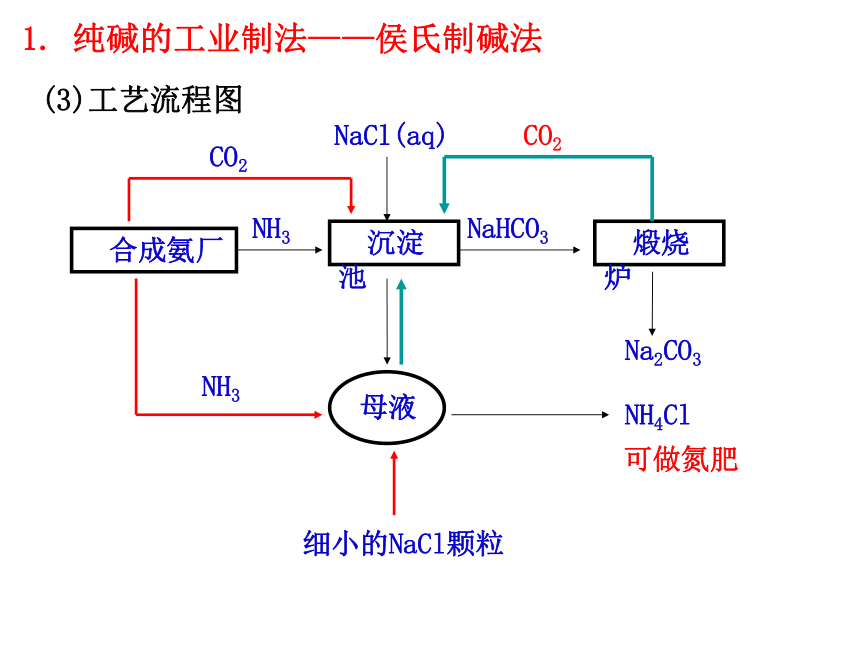
1. 纯碱的工业制法——侯氏制碱法
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(2)反应原理:
(1)化学工艺: 饱和NaCl溶液先通入足量的 ,
再通入足量的 。
2NaHCO3 === Na2CO3+H2O+CO2
NH3
CO2
侯氏制碱法的工艺中应用了物质溶解度的差异
思考:通入气体的顺序能否颠倒?
不能,因为NH3在水中的溶解度很大,使溶液呈碱性,
可以保证吸收更多的CO2,产生高浓度的HCO3-,
进一步析出NaHCO3 。
沉淀池
合成氨厂
NH3
煅烧炉
NaHCO3
NaCl(aq)
母液
Na2CO3
NH4Cl
CO2
NH3
细小的NaCl颗粒
CO2
(3)工艺流程图
1. 纯碱的工业制法——侯氏制碱法
可做氮肥
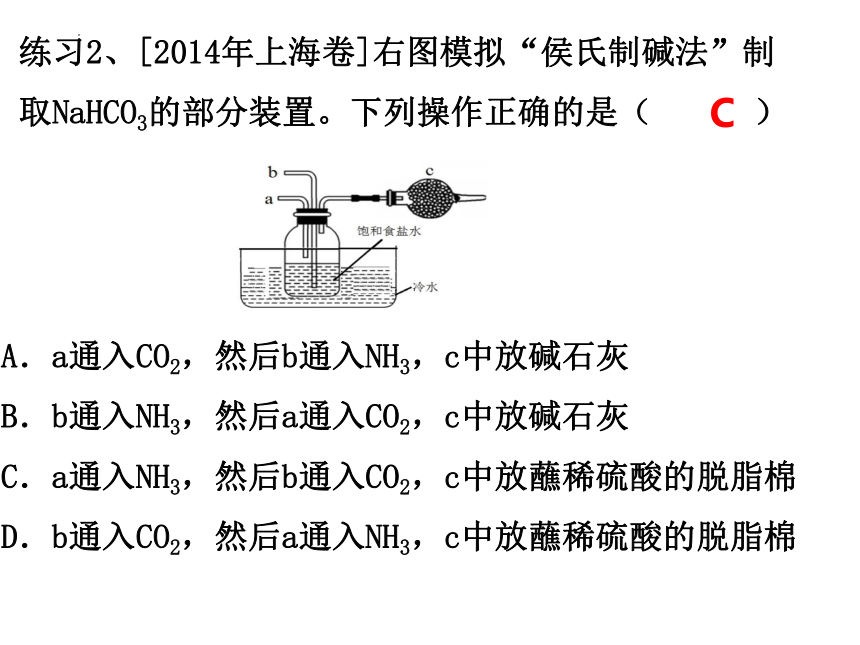
练习2、[2014年上海卷]右图模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
C
可溶于水
(200C,S=9.6g)
2NaHCO3 === Na2CO3+H2O+CO2
稳定,不易分解
易溶于水
(200C,S=21.5g)
细小白色晶体
白色粉末
小苏打
纯碱/苏打
热稳定性
溶解性
色、态
俗名
化学式
NaHCO3
Na2CO3
一、碳酸钠与碳酸氢钠的比较
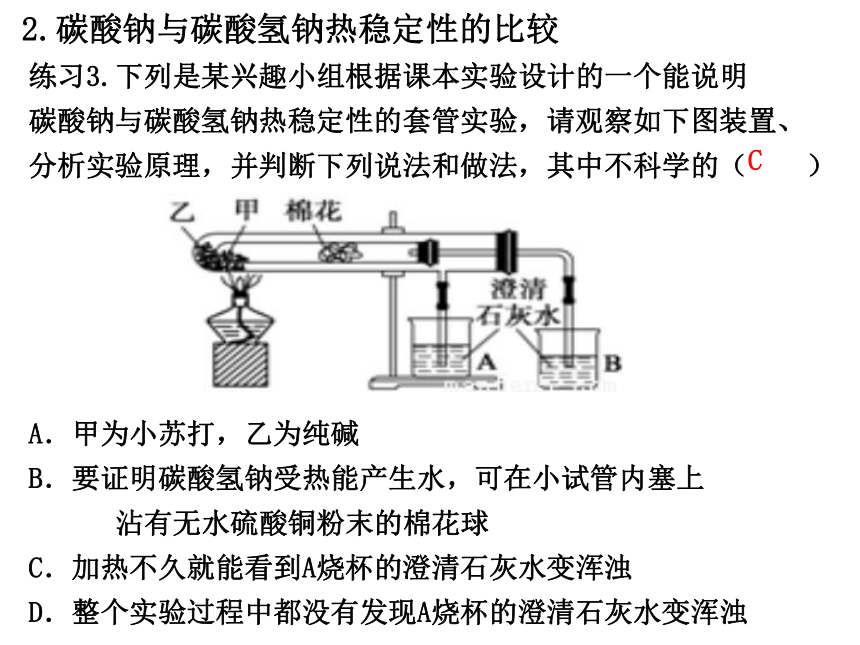
练习3.下列是某兴趣小组根据课本实验设计的一个能说明
碳酸钠与碳酸氢钠热稳定性的套管实验,请观察如下图装置、
分析实验原理,并判断下列说法和做法,其中不科学的( )
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上
沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
C
2.碳酸钠与碳酸氢钠热稳定性的比较
>
3. 与酸反应速率的差异:二者都能与酸反应。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
+H+
+H+
从反应过程看:CO32- → HCO3- →H2CO3→H2O+CO2↑
(1)因此Na2CO3、NaHCO3跟相同浓度的盐酸反应
产生CO2的速率为V(NaHCO3 ) V(Na2CO3)。
因此泡沫灭火剂常用NaHCO3,而不用Na2CO3。
(2)CO2生成量的比较:
a、等物质的量的Na2CO3、NaHCO3分别与足量的盐酸反应,产生CO2的量 (填相等或不相等)。
相等
b、等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,
产生的CO2多(填Na2CO3或NaHCO3 )。
NaHCO3
① 盐酸里滴加Na2CO3溶液:
(3) Na2CO3溶液与HCl溶液的互滴
② 向Na2CO3溶液里滴加盐酸:
现象:开始就有气体放出(开始时酸过量):
现象:开始无气体放出(开始时酸不足):
思考:仅用试管和胶头滴管,你能鉴别Na2CO3溶液和稀盐酸吗?
练习4、现有25mL 2mol·L–1的Na2CO3溶液和75mL 1mol·L–1的稀盐酸。
(1)将Na2CO3溶液逐滴滴入稀盐酸中;
(2)将稀盐酸逐滴滴入Na2CO3溶液中。
两操作的现象及结果(标准状况下)为 ( )
A.现象相同,所得气体的体积相等
B.现象相同,所得气体的体积不等
C.现象不同,所得气体的体积相等
D.现象不同,所得气体的体积不等
D
练习5. 120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.0.18 mol·L-1 D.0.24 mol·L-1
B
B
练习6、有甲、乙两个完全相同的装置,分别在它们的侧管中装入
1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL
相同浓度的盐酸(如下图),同时将两个侧管中的物质全部
倒入各自的试管中,下列叙述正确的是( )
A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D.最终两溶液中Na+、Cl-的物质的量相同
练习7、分别取等浓度的NaOH溶液各100 mL,通入一定量的CO2,随后分别取20 mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):
(1)在A情况下,溶质是 ,其物质的量之比为 。
(2)在B情况下,溶质是 ,其物质的量之比为 。
(3)原氢氧化钠溶液的物质的量浓度为 。
NaOH、Na2CO3
1∶1
Na2CO3、NaHCO3
1∶1
1.5 mol·L-1
化学式
NaHCO3
Na2CO3
4、碳酸钠、碳酸氢钠与碱、盐的反应
与石灰水反应
CO32-+Ca2+=CaCO3↓
HCO3- + Ca2++OH- = CaCO3↓+H2O
2HCO3- + Ca2++2OH- =
CaCO3↓+2H2O+CO32-
与CaCl2
溶液反应
与Al2(SO4)3溶液反应
不反应
CO32-+Ca2+=CaCO3↓
3CO32-+2Al3++3H2O
=2Al(OH)3↓+3CO2↑
3HCO3-+Al3+
=Al(OH)3↓+3CO2↑
练习8、下列实验方案中,不能测定Na2CO3和NaHCO3,
混合物中Na2CO3质量分数的是( )
A. 取a克混合物充分加热,减轻b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,
得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰
吸收,增重b克
D. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、
烘干,得b克固体
C
化学式
NaHCO3
Na2CO3
5、碳酸钠与碳酸氢钠的相互转化及用途
与CO2反应
Na2CO3+H2O+CO2=2NaHCO3
不反应
相互
转化
Na2CO3
NaHCO3
CO2 + H2O(或少量H+)
(1)固体: 加热 (2)溶液: NaOH
用途
用于玻璃,肥皂,
造纸,洗涤剂
灭火剂,
医疗上治胃酸过多
6、碳酸钠和碳酸氢钠的鉴别
(1)晶体受热:NaHCO3受热产生能使澄清石灰水变浑浊的无色无味的CO2气体。而碳酸钠受热不分解。
(2)CaCl2溶液:将CaCl2溶液滴加到Na2CO3溶液中能产生白色沉淀,滴加到NaHCO3溶液中无白色沉淀产生。
能否用澄清石灰水?
╳
(3)用盐酸溶液:向Na2CO3溶液中逐滴加入稀盐酸,开始一段无气体产生,当稀盐酸滴加到一定程度以后有气体产生。而向NaHCO3溶液逐滴加入稀盐酸,立即产生无色无味的气体。
(4)pH值:同温度下,同浓度的Na2CO3溶液和NaHCO3溶液的pH值不同。
7. Na2CO3、NaHCO3的除杂
序号 混合物(括号内为杂质) 除杂方法
① Na2CO3(s)(NaHCO3)
② NaHCO3(aq)(Na2CO3)
③ Na2CO3(aq)(NaHCO3)
加热法
滴加适量NaOH溶液
通入足量CO2
练习1、将l00ml 1mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO32-)的变化分别是( )
A.减小、减小 B.减小、增大
C.增大、增大 D.增大、减小
B
第三章金属及其重要的化合物
第一节 钠及其重要化合物3
HCO3- + Ca2++OH- = CaCO3↓+H2O
HCO3- + OH- =CO32-+H2O
较易溶于水(200C,S=9.6g)
2NaHCO3 = Na2CO3+H2O+CO2
发酵剂,灭火剂,医疗上治胃酸过多
用于玻璃,肥皂,造纸,洗涤剂
不反应
Na2CO3+H2O+CO2=2NaHCO3
不反应
CO32- +Ba2+ = BaCO3↓
CO32- + Ca2+ = CaCO3↓
不反应
HCO3- + H+ = CO2↑+H2O
CO32- + 2H+=CO2↑+H2O
稳定,不易分解
易溶于水(200C,S=21.5g)
细小白色晶体
白色粉末
小苏打
纯碱 ,苏打
转化
用途
CO2
BaCl2
过量石灰水
NaOH
HCl
热稳定性
溶解性
色态
俗名
化学式
NaHCO3
Na2CO3
一、碳酸钠与碳酸氢钠
Na2CO3
NaHCO3
CO2 + H2O(H+少量)
(1)固体: 加热 (2)溶液: NaOH
可溶于水
(200C,S=9.6g)
易溶于水
(200C,S=21.5g)
细小白色晶体
白色粉末
小苏打
纯碱/苏打
溶解性
色、态
俗名
化学式
NaHCO3
Na2CO3
一、碳酸钠与碳酸氢钠的比较
1. 纯碱的工业制法——侯氏制碱法
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(2)反应原理:
(1)化学工艺: 饱和NaCl溶液先通入足量的 ,
再通入足量的 。
2NaHCO3 === Na2CO3+H2O+CO2
NH3
CO2
侯氏制碱法的工艺中应用了物质溶解度的差异
思考:通入气体的顺序能否颠倒?
不能,因为NH3在水中的溶解度很大,使溶液呈碱性,
可以保证吸收更多的CO2,产生高浓度的HCO3-,
进一步析出NaHCO3 。
沉淀池
合成氨厂
NH3
煅烧炉
NaHCO3
NaCl(aq)
母液
Na2CO3
NH4Cl
CO2
NH3
细小的NaCl颗粒
CO2
(3)工艺流程图
1. 纯碱的工业制法——侯氏制碱法
可做氮肥
练习2、[2014年上海卷]右图模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰
C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
C
可溶于水
(200C,S=9.6g)
2NaHCO3 === Na2CO3+H2O+CO2
稳定,不易分解
易溶于水
(200C,S=21.5g)
细小白色晶体
白色粉末
小苏打
纯碱/苏打
热稳定性
溶解性
色、态
俗名
化学式
NaHCO3
Na2CO3
一、碳酸钠与碳酸氢钠的比较
练习3.下列是某兴趣小组根据课本实验设计的一个能说明
碳酸钠与碳酸氢钠热稳定性的套管实验,请观察如下图装置、
分析实验原理,并判断下列说法和做法,其中不科学的( )
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上
沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
C
2.碳酸钠与碳酸氢钠热稳定性的比较
>
3. 与酸反应速率的差异:二者都能与酸反应。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
+H+
+H+
从反应过程看:CO32- → HCO3- →H2CO3→H2O+CO2↑
(1)因此Na2CO3、NaHCO3跟相同浓度的盐酸反应
产生CO2的速率为V(NaHCO3 ) V(Na2CO3)。
因此泡沫灭火剂常用NaHCO3,而不用Na2CO3。
(2)CO2生成量的比较:
a、等物质的量的Na2CO3、NaHCO3分别与足量的盐酸反应,产生CO2的量 (填相等或不相等)。
相等
b、等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,
产生的CO2多(填Na2CO3或NaHCO3 )。
NaHCO3
① 盐酸里滴加Na2CO3溶液:
(3) Na2CO3溶液与HCl溶液的互滴
② 向Na2CO3溶液里滴加盐酸:
现象:开始就有气体放出(开始时酸过量):
现象:开始无气体放出(开始时酸不足):
思考:仅用试管和胶头滴管,你能鉴别Na2CO3溶液和稀盐酸吗?
练习4、现有25mL 2mol·L–1的Na2CO3溶液和75mL 1mol·L–1的稀盐酸。
(1)将Na2CO3溶液逐滴滴入稀盐酸中;
(2)将稀盐酸逐滴滴入Na2CO3溶液中。
两操作的现象及结果(标准状况下)为 ( )
A.现象相同,所得气体的体积相等
B.现象相同,所得气体的体积不等
C.现象不同,所得气体的体积相等
D.现象不同,所得气体的体积不等
D
练习5. 120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.0.18 mol·L-1 D.0.24 mol·L-1
B
B
练习6、有甲、乙两个完全相同的装置,分别在它们的侧管中装入
1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL
相同浓度的盐酸(如下图),同时将两个侧管中的物质全部
倒入各自的试管中,下列叙述正确的是( )
A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D.最终两溶液中Na+、Cl-的物质的量相同
练习7、分别取等浓度的NaOH溶液各100 mL,通入一定量的CO2,随后分别取20 mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):
(1)在A情况下,溶质是 ,其物质的量之比为 。
(2)在B情况下,溶质是 ,其物质的量之比为 。
(3)原氢氧化钠溶液的物质的量浓度为 。
NaOH、Na2CO3
1∶1
Na2CO3、NaHCO3
1∶1
1.5 mol·L-1
化学式
NaHCO3
Na2CO3
4、碳酸钠、碳酸氢钠与碱、盐的反应
与石灰水反应
CO32-+Ca2+=CaCO3↓
HCO3- + Ca2++OH- = CaCO3↓+H2O
2HCO3- + Ca2++2OH- =
CaCO3↓+2H2O+CO32-
与CaCl2
溶液反应
与Al2(SO4)3溶液反应
不反应
CO32-+Ca2+=CaCO3↓
3CO32-+2Al3++3H2O
=2Al(OH)3↓+3CO2↑
3HCO3-+Al3+
=Al(OH)3↓+3CO2↑
练习8、下列实验方案中,不能测定Na2CO3和NaHCO3,
混合物中Na2CO3质量分数的是( )
A. 取a克混合物充分加热,减轻b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,
得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰
吸收,增重b克
D. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、
烘干,得b克固体
C
化学式
NaHCO3
Na2CO3
5、碳酸钠与碳酸氢钠的相互转化及用途
与CO2反应
Na2CO3+H2O+CO2=2NaHCO3
不反应
相互
转化
Na2CO3
NaHCO3
CO2 + H2O(或少量H+)
(1)固体: 加热 (2)溶液: NaOH
用途
用于玻璃,肥皂,
造纸,洗涤剂
灭火剂,
医疗上治胃酸过多
6、碳酸钠和碳酸氢钠的鉴别
(1)晶体受热:NaHCO3受热产生能使澄清石灰水变浑浊的无色无味的CO2气体。而碳酸钠受热不分解。
(2)CaCl2溶液:将CaCl2溶液滴加到Na2CO3溶液中能产生白色沉淀,滴加到NaHCO3溶液中无白色沉淀产生。
能否用澄清石灰水?
╳
(3)用盐酸溶液:向Na2CO3溶液中逐滴加入稀盐酸,开始一段无气体产生,当稀盐酸滴加到一定程度以后有气体产生。而向NaHCO3溶液逐滴加入稀盐酸,立即产生无色无味的气体。
(4)pH值:同温度下,同浓度的Na2CO3溶液和NaHCO3溶液的pH值不同。
7. Na2CO3、NaHCO3的除杂
序号 混合物(括号内为杂质) 除杂方法
① Na2CO3(s)(NaHCO3)
② NaHCO3(aq)(Na2CO3)
③ Na2CO3(aq)(NaHCO3)
加热法
滴加适量NaOH溶液
通入足量CO2
